骨髓間充質干細胞旁分泌HGF體外調控肝星狀細胞
李靜,鄭雪,丁新,向輝,陳衛剛
肝臟疾病是我國常見病、多發病,肝硬化和肝癌是肝臟疾病重要的致死原因。肝纖維化是肝硬化和肝癌的中間環節,而抑制肝星狀細胞的激活和增殖是緩解肝纖維化的策略之一。骨髓間充質干細胞(BMSCs)是骨髓中的非造血組織,因具有自我更新、多向分化、免疫抑制等功能而成為臨床研究熱點[1]。現越來越多的動物實驗及臨床試驗表明BMSCs可治療骨或軟骨損傷、心臟疾病、中樞神經系統損傷、脊髓損傷[2]。近年來,BMSCs在肝纖維化方面的治療也取得了一定的進展[3],但其具體機制還不明確。本實驗將骨髓間充質干細胞與肝星狀細胞(HSCs)建立間接共培養體系,初步探討骨髓間充質干細胞緩解肝纖維化的機制。
1 材料與方法
1.1 材料 清潔級SD雄性大鼠,體質量120~180 g,購自新疆維吾爾自治區疾病預防控制中心;大鼠肝星狀細胞(上海富衡生物科技有限公司);胎牛血清(美國BI公司)、L-DMEM培養基(美國Gibco公司),0.25%胰蛋白酶(美國Hyclone公司),CD29-FITC抗體、CD45-FITC抗體、CD90-PE抗體(eBioscience公司);MTT(Solarbio公司);肝細胞生長因子ELISA試劑盒(中國Elabscience公司);c-met抗體(MCE公司);兔抗α-肌動蛋白(α-SMA)單克隆抗體(ab32575,Abcam公司);熒光二抗(山羊抗兔IgG-FITC,北京中杉金橋生物科技有限公司);PI(美國Sigma公司);Transwell insert半透膜(0.4μm,美國Corning Costar公司);Annexin V-PE細胞凋亡試劑盒(中國聯科生物公司);流式細胞儀(美國BD公司);酶標儀(美國BIO-RAD公司);激光共聚焦顯微鏡(德國ZEISS公司)。
1.2 方法
1.2.1 細胞的提取、培養和鑒定 利用全骨髓貼壁培養法提取大鼠雙下肢骨髓間充質干細胞,收集第2代對數生長期細胞,流式鑒定表面分子CD29、CD90、CD45;復蘇新購的HSCs,取第3代生長活躍的細胞,倒置相差顯微鏡下觀察活體細胞形態學改變,采用熒光免疫法檢測α-SMA的表達。
1.2.2 細胞共培養體系的建立及實驗分組 6孔板半透膜(直徑0.4μm)上層每孔接種1×105個細胞,下層接種5×104個細胞/孔。實驗分組:(1)H組,HSCs單獨培養(半透膜上層只有培養基)。(2)H-H組,HSCs和HSCs共培養。(3)M-H組,BMSCs與HSCs共培養。(4)M-H-C組,c-met抑制劑2 mmol/L預先封閉HSCs表面肝細胞生長因子(HGF)受體,4 h后BMSCs與HSCs共培養;48 h后倒置相差顯微鏡下動態觀察活體細胞形態學改變。
1.2.3 MTT法檢測HSCs增殖抑制率 各組細胞共培養48 h后,抽取上清液保留備用,0.25%胰酶消化貼壁細胞,用各組共培養上清液分別重懸各組細胞,以3 000個細胞/孔均勻接種在96孔板上,孵育4 h,向各孔加10μL MTT液,4 h后棄上清,各孔加100μL二甲基亞砜(DMSO),在酶標儀上測定各孔在450 nm處的光密度(OD)值;細胞生長抑制率=(H組平均OD值-各處理組平均OD值)/H組平均OD值×100%。
1.2.4 共聚焦顯微鏡檢測HSCs中α-SMA的表達 各組細胞共培養48 h后,棄上清,4%多聚甲醛固定細胞15 min,0.2%Triton-X-100透膜3 min,5%BSA封閉,孵α-SMA抗體,4℃過夜,次日暗室加熒光二抗,37℃孵育1~2 h,PI染核1 min,PBS洗4次,抗熒光淬滅劑封片,即刻采用激光共聚焦顯微鏡觀察。
1.2.5 流式細胞儀檢測HSCs凋亡率 各組細胞共培養48 h后,用不含EDTA的胰酶消化細胞,收集各組HSCs并計數,按照Annexin V-PE/7-ADD細胞凋亡試劑盒說明書操作,流式細胞儀檢測細胞凋亡率。
1.2.6 ELISA檢測共培養上清液HGF濃度 各孔中加入不同濃度的標準品或上下兩層共培養上清液,按照肝細胞生長因子ELISA試劑盒說明書嚴格操作,用酶標儀在450 nm波長處測量各孔OD值。以濃度為橫坐標,OD值為縱坐標,在雙對數坐標紙上繪制四參數邏輯函數的標準曲線,根據標準曲線計算各組細胞上清液中HGF濃度。
1.3 統計學方法 應用SPSS 22.0軟件對數據進行統計分析,所有計量資料以均數±標準差(±s)表示,組間比較采用單因素方差分析(one-way ANOVA),組間多重比較采用LSD-t法,P<0.05為差異有統計學意義。
2 結果
2.1 細胞形態特征及鑒定情況 原代BMSCs以集落為中心呈放射狀向周圍生長,培養至5~7 d時,細胞呈現明顯的旋渦狀。BMSCs流式鑒定結果顯示,99.3%的細胞表達CD29,98.9%的細胞表達CD90,0.8%的細胞表達CD45,表明提取的原代細胞為純化的BMSCs。HSCs在倒置顯微鏡下呈星形或多邊形伸展狀態,共聚焦結果顯示活化后的HSCs胞膜及胞漿表達α-SMA,符合實驗要求,見圖1。
2.2 BMSCs抑制肝星狀細胞的增殖 各組細胞共培養48 h后顯示,BMSCs對HSCs的增殖抑制率最大,HSCs對HSCs的增殖抑制率次之,M-H-C組幾乎無抑制,M-H組與H-H組、M-H-C組相比均有統計學意義(P<0.01),見表1。
Tab.1 Effects of BMSCs on HSCs after 48-hour co-culture表1 共培養48 h后BMSCs對HSCs的影響 (±s)
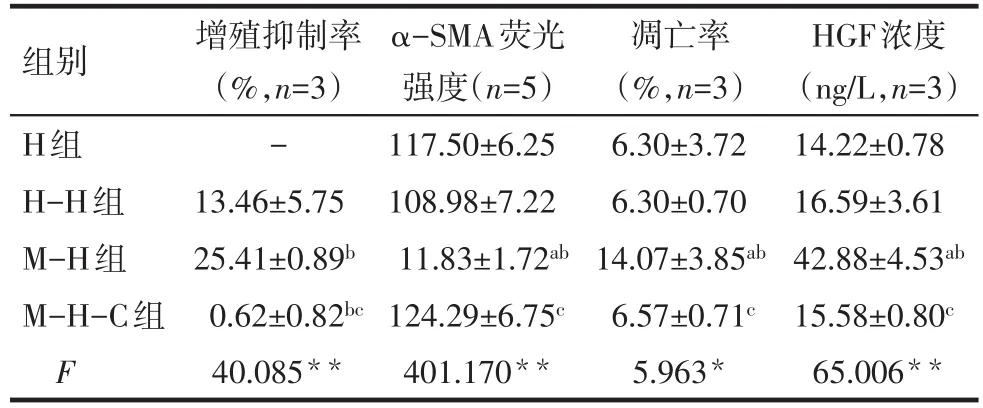
Tab.1 Effects of BMSCs on HSCs after 48-hour co-culture表1 共培養48 h后BMSCs對HSCs的影響 (±s)
*P<0.05,**P<0.01;a與H組比較,b與H-H組比較,c與M-H組比較,P<0.05
組別H組H-H組M-H組M-H-C組F增殖抑制率(%,n=3)-13.46±5.75 25.41±0.89b 0.62±0.82bc 40.085**α-SMA熒光強度(n=5)117.50±6.25 108.98±7.22 11.83±1.72ab 124.29±6.75c 401.170**凋亡率(%,n=3)6.30±3.72 6.30±0.70 14.07±3.85ab 6.57±0.71c 5.963*HGF濃度(ng/L,n=3)14.22±0.78 16.59±3.61 42.88±4.53ab 15.58±0.80c 65.006**
2.3 BMSCs抑制HSCs的活性 與M-H組比較,其余3組HSCs胞膜和胞漿α-SMA表達量均增高,差異有統計學意義(P<0.005),而其余3組間比較差異無統計學意義,見表1、圖1。
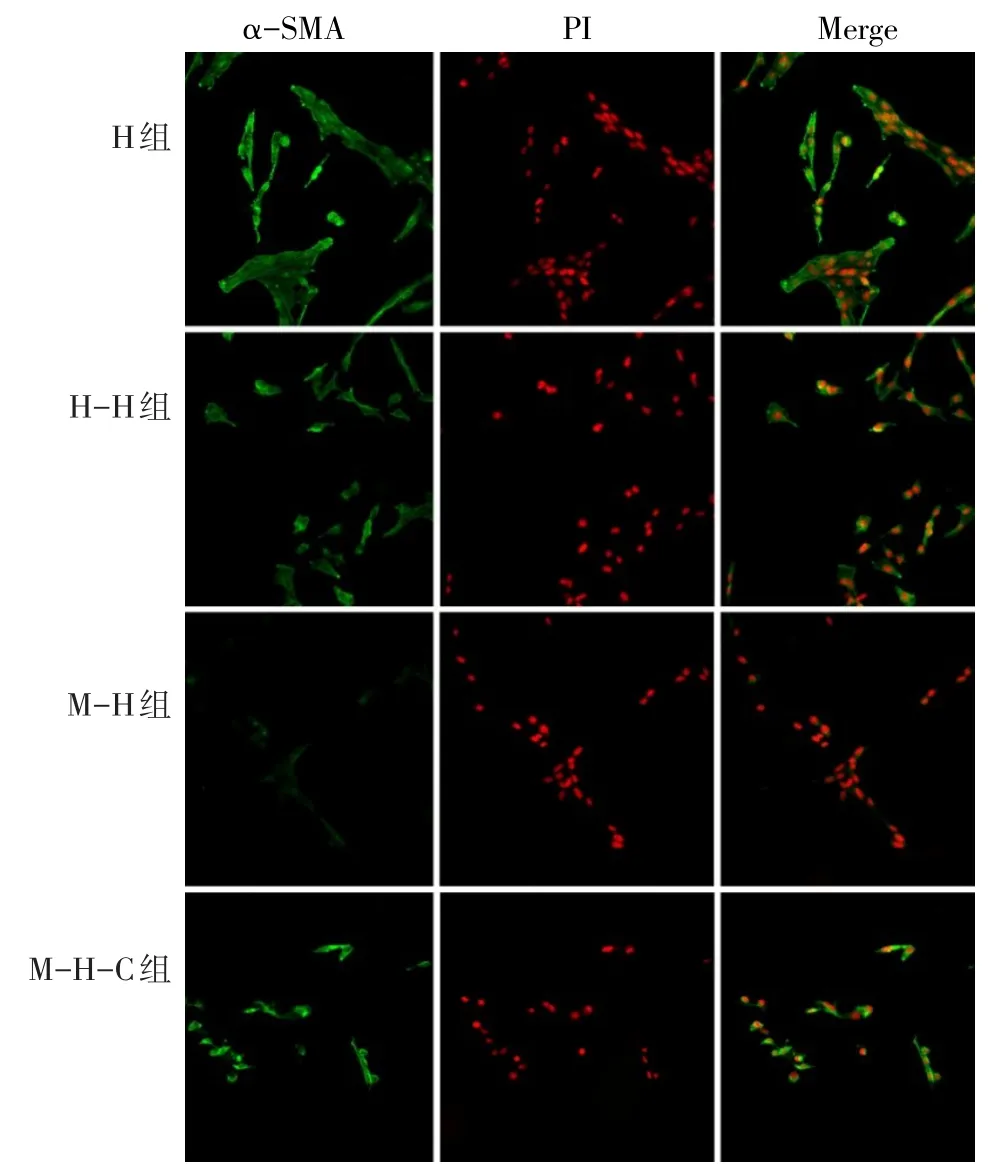
Fig.1 α-SMA expression of hepatic stellate cells in each group(×200)圖1 各組肝星狀細胞α-SMA表達量(×200)
2.4 BMSCs促進肝星狀細胞的凋亡 流式結果顯示,H組、H-H組、M-H-C組HSCs凋亡率較低,且3組差異無統計學意義,M-H組HSCs凋亡率明顯高于H組、H-H組、M-H-C組,差異有統計學意義(均P<0.05),見圖2、表1。
2.5 共培養上清液中HGF的濃度 ELISA結果顯示,繪制的標準曲線與標準相符(R2=0.99),共培養48 h后,M-H組上清液HGF濃度明顯高于H組、HH組、M-H-C組,差異均有統計學意義(均P<0.05),見表1。

Fig.2 The image of apoptosis in hepatic stellate cells圖2 肝星狀細胞凋亡圖
3 討論
目前肝硬化患者尚缺乏有效的治療方法,干細胞因具有免疫原性低、易體外擴增、多向分化潛能,給肝硬化患者帶來了新的希望。越來越多的研究表明干細胞移植治療可以逆轉肝纖維化和肝硬化,但具體機制尚不明確[4-5]。體內實驗發現,BMSCs經尾靜脈注射入四氯化碳(CCl4)誘導的肝纖維化大鼠體內,肝纖維化程度降低,HSCs的數量較對照組明顯減少,凋亡率明顯增高,這為BMSCs治療肝纖維化的機制提供了新的思路[6]。HSCs經體外傳代可被激活,活化HSCs細胞外基質的合成和降解失衡,導致細胞外基質增多,從而形成纖維化。
以往研究發現,間充質干細胞(MSCs)通過定向遷移到肝纖維化組織[7],分化為肝樣細胞[8],并通過抗肝細胞凋亡改善肝功能[9-10],α-SMA是HSCs活化的標志,MSCs可以抑制成纖維細胞的增殖和α-SMA的表達,并促進基質金屬蛋白酶的分泌[11]。Parekkadan等[12]在 BMSCs與HSCs共培養中發現,BMSCs來源的白細胞介素(IL)-10和腫瘤壞死因子(TNF)-α可抑制HSCs的增殖和膠原合成。本研究發現BMSCs與HSCs共培養48 h,BMSCs會明顯抑制活化態HSCs的增殖并促進其凋亡,且作用和上清液中HGF的濃度有關,在HGF濃度最高的M-H組中,HSCs的增殖率最低,而凋亡率最高;當封閉HGF受體(c-met)后,增殖率升高同時凋亡率下降,說明BMSCs可能通過分泌的HGF抑制HSCs的增殖并促進其凋亡。韋柳萍等[13]檢測了BMSCs與HSCs共培養24、48、72 h后HSCs的凋亡率,發現隨著培養時間的延長,HSCs的凋亡率逐漸增加,且在72 h時達到最高。然而,本研究在前期預實驗過程中發現,H組在培養72 h后,HSCs的凋亡率也明顯增高,說明此時HSCs的高凋亡率并不是由BMSCs引起的,可能是培養體系中未更換新的培養基而無法滿足HSCs的生長要求,亦或是HSCs分泌的因子引起的。Wang等[14]將BMSCs與LX2在transwell小室共培養后發現,LX2中α-SMA的表達量明顯降低,當敲低c-met后,BMSCs不能改變活化LX2中α-SMA的表達量。本研究結果同樣也顯示,在BMSCs與HSCs共培養48 h后,BMSCs使活化態的HSCs活性降低,當封閉HGF/c-met信號通路后,效應消失,說明BMSCs可通過分泌的HGF抑制HSCs的活化。
MSCs可以旁分泌多種細胞因子,如HGF、IL-10、胰島素樣生長因子-1、神經生長因子、血管內皮生長因子、腫瘤壞死因子等。HGF是一種多效生長因子,在細胞的分裂、存活、遷移、形態發生等方面發揮著重要的作用。本研究在M-H組上清液中檢測到高濃度的HGF,說明BMSCs可分泌HGF。而HSCs活化后可表達 HGF 受體 c-met[15],c-met受體屬于酪氨酸激酶家族,HSCs通過分泌TNF-α、IL-6等因子刺激MSCs分泌HGF、IL-10等,HGF與HSCs表面的c-met受體結合后激活c-met位點,通過HGF/c-met信號通路對HSCs產生影響。本實驗發現,在HGF濃度最高的M-H組中,HSCs的凋亡率最高,HSCs的增殖和活化最低,當封閉HGF/c-met信號通路后,效應消失,表明BMSCs對HSCs的影響可能是BMSCs分泌HGF通過HGF/c-met信號通路起作用的。然而,HGF/c-met下游有Akt/PKB、PI3K、JNK、ERK/MAPK、PIP3等通路,具體是哪條通路起主要作用還有待進一步研究。
此外,MSCs還可通過免疫調節和炎癥抑制的作用,抑制T、B淋巴細胞的增殖,促進抑制性細胞因子分泌,減少炎癥性細胞因子產生,從而減輕肝臟炎癥反應和肝細胞的破壞[16-17]。隨著外泌體的提出,越來越多的學者認為MSCs改善肝纖維化與外泌體有關[18-19]。Schorey等[20]認為外泌體為 MSCs與 HSCs間傳遞通訊的載體。Li等[21]認為來源于人臍帶MSCs的外泌體通過抑制肝細胞的上皮-間充質轉化、顯著恢復血清天冬氨酸轉氨酶活性,并通過降低Ⅰ/Ⅲ型膠原、轉化生長因子-β1(TGF-β1)以及Smad2的磷酸化,使TGF-β1/Smad信號通路失活,從而改善肝纖維化。
綜上所述,BMSCs可使HSCs的增殖、活化受到抑制,凋亡增加,其機制可能是BMSCs旁分泌HGF通過HGF/c-met信號通路起作用的,這也可能是BMSCs移植治療肝纖維化的機制之一。

