泌乳素及其受體在尖銳濕疣的表達
江中洪 江玉娥 曾茂森
尖銳濕疣(condyloma acuminatum,CA)是人乳頭瘤病毒(human papillomavirus, HPV)感染外生殖器、肛周等部位引起的一種常見的、易復發的性傳播疾病。許多研究表明,CA的發生、消退、復發及癌變與機體的免疫功能密切相關。泌乳素(prolactin, PRL)是垂體前葉分泌的多肽激素,皮膚是垂體外PRL的重要合成及靶向器官,參與調節細胞增殖與分化、免疫應答等生理過程。本研究采用化學發光法和免疫組化檢測CA患者外周血PRL以及皮損泌乳素受體(prolactin receptor, PRLR)的表達情況,并探討其臨床意義。
1 資料與方法
1.1 研究對象 2017年6月至2018年6月在我院皮膚性病科和婦產科就診的尖銳濕疣患者共40例,均符合《中國臨床皮膚病學》中尖銳濕疣的診斷標準[1]。男、女各20例,年齡18~38歲,平均(24.3±4.2)歲,患者1年內均未接受免疫抑制劑治療,排除口服大量雌激素、避孕藥、妊娠及哺乳期婦女,且無嚴重心肝腎疾病、腫瘤、器官移植、自身免疫性疾病及其他感染性疾病。對照組包皮組織和外周血PRL取自健康男性20名,平均(20.4±7.2)歲,由皮膚外科和泌尿外科提供,另再抽取非孕期健康女性20名外周血PRL作為對照組。所有皮膚和皮損標本經10%甲醛固定,石蠟包埋并連續切片。兩組在年齡構成(t=0.49,P=0.72)差異無統計學意義(P>0.05)。本研究經過醫院倫理委員會批準,患者簽署知情同意書。
1.2 主要儀器和試劑 Access2化學發光免疫分析儀購自美國Beckman coulter公司,PRL試劑購自羅氏公司,BX51-P雙目電子顯微鏡購自日本Olympus株式會社,兔抗人PRLR抗體購自武漢博士德公司。
1.3 方法
1.3.1 PRL檢測 所有入選對象均用干燥管收集外周血3ml,及時分離血清檢測,由檢驗科按操作常規進行上機檢測。
1.3.2 免疫組化SP法 采用免疫組織化學鏈霉素抗生物素蛋白-過氧化物酶連接(SP法)進行檢測,接試劑盒說明書進行。手術取尖銳濕疣皮損和對照組包皮組織,4%甲醛液固定,石蠟包埋,連續4 μm切片。切片脫蠟至水,3%過氧化氫溶液阻斷內源性過氧化物酶,抗原120℃修復3 min,正常山羊血清封閉10 min,加入一抗37℃孵育1 h,生物素標記的二抗和鏈霉親和素-過氧化物酶(SP)復合物各在37℃溫箱孵育30 min。DAB顯色,蘇木精復染,脫水,透明,封片。用已知陽性片作陽性對照。用PBS代替一抗作空白對照。
1.3.3 結果判定[2]免疫組化染色以胞質或胞膜棕黃色著色為陽性細胞,根據陽性細胞著色強度和百分比確定PRLR表達的半定量分級:①按細胞著色強度,無色為0分,淺黃色為1分,黃色為2分,棕黃色為3分;②按陽性細胞百分比,≤10%為0分,11%~25%為1分,26%~50%為2分,51%~75%為3分,≥76%為4分。據上述兩項分值的乘積,0為陰性(-),1~4分為弱陽性(+),6~8分為陽性(++),9~12分為強陽性(+++)。采取單盲法,每張切片隨機選取5個高倍(×400)視野,取其得分的平均數判斷該標本的半定量等級,表達陽性率:表達陽性率=陽性標本數/總標本數×100%。
1.4 統計學方法 采用SPSS 13.0統計軟件對數據進行統計學分析,計數資料的比較采用χ2檢驗,計量資料用均數±標準差表示,采用獨立樣本t檢驗,以P<0.05為有統計學意義。
2 結果
2.1 外周血PRL在尖銳濕疣患者和對照組的表達比較 本院PRL參考值男性為(4.04~15.20)ng/mL,非孕期女性為(4.79~23.30)ng/mL,本次實驗男性CA患者PRL為(9.24±4.68)ng/mL,健康男性對照組為(8.42±3.83)ng/mL,兩組比較差異無統計學意義(t=0.606,P=0.548),女性CA患者為(14.62±6.23)ng/mL,健康女性對照組為(12.42±5.46)ng/mL,兩組比較差異無統計學意義(t=1.188,P=0.242),見表1。

表1 各組PRL表達水平比較(ng/mL)
2.2 PRLR在尖銳濕疣皮損和正常包皮組織中的表達比較 見表2。

表2 PRLR在CA組和包皮組皮損表達情況(例)
PRLR在尖銳濕疣皮損有不同程度的陽性表達,PRLR受體陽性細胞集中分布于基底層、棘層細胞下部,中到強陽性表達,在角質層細胞較少表達。疣體血管內皮細胞也可見到中到強陽性表達(圖1)。在20名健康者的包皮組織PRLR受體呈弱陽性表達或不表達,分布于基底層細胞和棘層細胞 (圖2)。CA患者PRLR受體陽性表達水平均顯著高于對照組(χ2=33.35,P=0.00)。
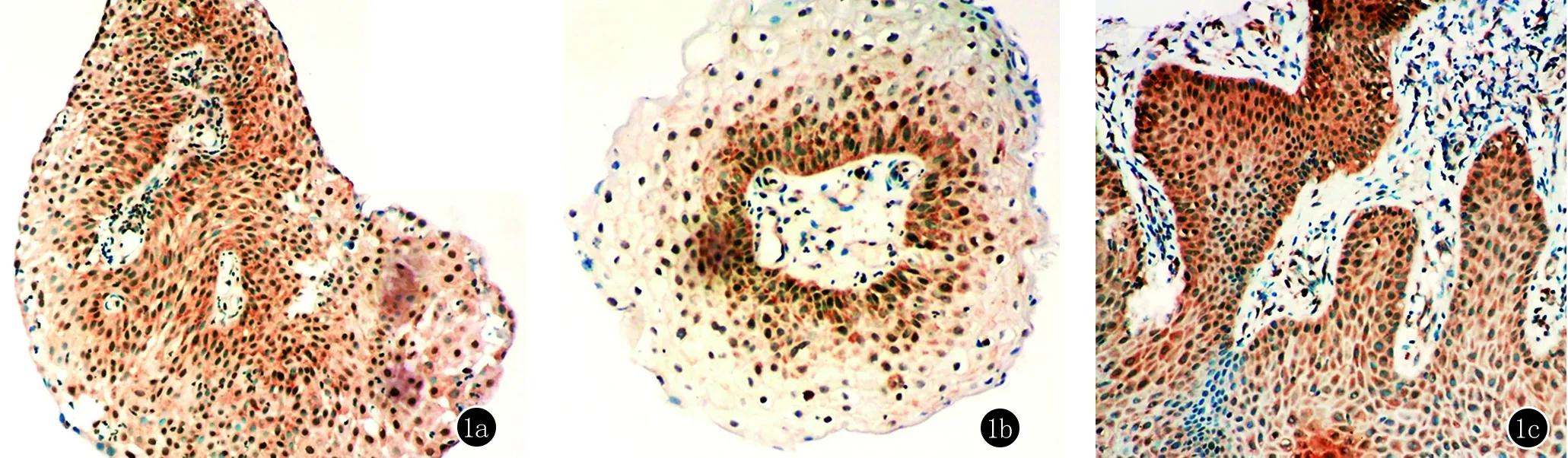
圖1 a,b,c在基底層及基層下部細胞、血管內皮細胞的胞質及胞膜被染成棕黃色(SP,×200)
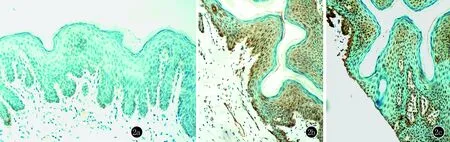
圖2 a,b,c在基底層及基層下部細胞、血管內皮細胞的胞質及胞膜被染成淺棕黃色(SP,×200)
3 討論
PRL由199個氨基酸組成的23kDa單鏈蛋白,由于翻譯后加工、修飾的不同,23 kDa的 PRL經蛋白水解切割后可生成14kDa、17kDa及22 kDa的變異型,在血清中PRL多以單體形式存在,也可形成二聚體、三聚體。PRL主要的功能是在妊娠期和哺乳期促進乳腺發育,乳汁合成和乳汁分泌的維持[3]。PRLR是造血細胞因子受體超家族成員,包括細胞外結構域,單個跨膜結構域和細胞內信號轉導結構域,幾乎存在于所有的組織和器官。由于選擇轉錄和翻譯不同,PRLR主要包括2個亞型:長型分子量為87 kDa,對PRL 親和力較高;短型分子量為36 kDa,對PRL親和力較低。這些同種型具有相同的細胞外結構域,但細胞內部分的大小和序列可能不同;此外,還有一種可溶性PRLR(PRL結合蛋白),只含有膜受體的細胞外結構域。在人體中發現的PRLR的主要同種型是長型,人PRLR除與PRL結合, PRLR還可以結合胎盤催乳素和生長激素[4]。
PRL與膜受體PRLR結合形成三聚體,通過激活JAK2/STAT5、c-Src、PI3K/AKT、MAPK、Nek3-vav2-Racl等信號通路發揮生物學作用。PRL及PRLR表達于角質形成細胞、皮膚附屬器、血管內皮細胞、成纖維細胞及免疫細胞中,參與調節細胞增殖與分化、毛囊周期、免疫應答等生理過程[5]。與垂體不同的是皮膚細胞中PRL及其受體表達主要受P物質、IFN-γ及TNF-α等細胞因子的調節[1,3]。
在表皮中PRL及PRLR主要表達于基底細胞層,PRL可促進表皮KC增殖,在體外培養皮膚KC中,PRLR表達與KC分化程度有關[6]。在皮膚免疫系統中,真皮T細胞、B細胞、巨噬細胞等均可表達PRLR,PRL可促進T細胞、B細胞增殖,抑制糖皮質激素誘導的淋巴細胞凋亡[7]。PRL可促進B細胞的抗原反應性、免疫球蛋白和自身抗體產生,增加Th-1細胞分泌IFN-γ、IL-2,PRL可促進巨噬細胞分泌IL-2發揮抗腫瘤作用[8]。PRL還可通過增加IFN-α分泌,影響朗格漢斯細胞的遷移、抗原提呈功能,在免疫反應中扮演著重要的角色[9]。
血管內皮細胞中低表達PRL,PRL可以通過上皮細胞、白細胞、巨噬細胞刺激血管生成因子如血管內皮生長因子(VEGF)的表達。PRL及其變異型在血管內皮細胞增殖和血管形成中起重要作用,23 kDa PRL可刺激血管形成,而16 kDa PRL通過與血管內皮細胞結合,抑制其增殖和促進凋亡,被稱為血管抑制素,還可抑制血管內皮細胞遷移,收縮血管降低血管通透性,而且對腫瘤的發生有抑制作用[10]。
有研究者對頑固性復發的合并有高泌乳素(HPL)血癥的女性CA患者,通過口服溴隱亭降低血泌乳素水平后,CA的復發明顯減少[11]。本實驗結果顯示,PRLR受體陽性細胞集中分布于基底層、棘層細胞下部,中到強陽性表達,在角質層細胞較少表達,提示PRL可刺激基底層細胞的增殖;同時,疣體血管內皮也可見PRLR的中到強陽性表達,提示PRL在血管的增殖和形成中起重要作用。但在患者外周血中檢測PRL,較健康對照組稍高,但差異無統計學意義(P>0.05),部分復發性CA患者PRL升高較為明顯,與頑固性復發的合并有高泌乳素血癥的女性CA患者不同的是,本研究中僅僅是部分復發性CA患者PRL升高較為明顯,推測患者皮損PRLR表達的增強,可能與HPV促進角質形成細胞的異常分化有關,或者是PRLR表型的表達出現變異有關,與PRL的結合力發生增強,其中的機制值得進一步探討。

