血清生存素水平在預測腫瘤壞死因子-α抑制劑治療類風濕關節炎臨床療效中的作用
韓俊,張英
(江漢大學附屬醫院藥劑科,武漢 430015)
類風濕關節炎 (rheumatoid arthritis,RA) 是一類慢性自身免疫性疾病,以對稱性多關節炎為主要臨床表現,如不給予積極治療,病情將逐漸加重,導致關節畸形、功能喪失,甚至導致不同程度的殘疾[1]。但隨著腫瘤壞死因子抑制劑 (tumor necrosis factor inhibitors,TNFi) 的發展和使用,RA的預后有了很大改善[2-3]。但仍然有約20%~30%的RA患者TNFi療效不佳或難以承受其高昂的費用[4-5],因此,探索可預測TNFi療效的生物標志物,對RA患者個體化治療具有重要意義。生存素是最近新發現的凋亡抑制蛋白,其表達水平與RA密切相關。研究[6]顯示,生存素陽性 (> 0.45 ng/mL) 的RA患者單獨使用甲氨蝶呤(methotrexate,MTX) 治療效果較差,生存素水平降低與較好的臨床療效相關。腫瘤壞死因子-α (tumor necrosis factor-α,TNF-α) 抑制劑是臨床最常用的TNFi,目前血清生存素在預測其治療RA患者臨床療效中的作用尚不清楚。因此,本研究擬評估血清生存素水平在預測RA患者TNF-α抑制劑臨床療效中的作用。
1 材料與方法
1.1 研究對象
選擇2015年4月至2017年3月期間在江漢大學附屬醫院接受TNF-α抑制劑治療的中高疾病活動度RA患者63例。納入標準:(1) 符合美國風濕病學會1987年修訂的RA分類標準;( 2) 年齡≥18周歲;( 3)28關節疾病活動度( disease activity score 28,DAS28) ≥3.2分;( 4) 根據病情需要自愿接受TNF-α抑制劑治療。排除標準:患有嚴重的關節變形或接受過關節手術;合并中重度肝功能或腎功能不全;6個月內使用過TNF-α抑制劑或其他生物制劑治療;有惡性腫瘤史、嚴重感染史;懷孕或哺乳期。本研究獲得了江漢大學附屬醫院倫理委員會批準,所有患者均簽署了知情同意書。
1.2 研究方法
1.2.1 治療及評估:本研究所有患者均根據病情需要和自我意愿選擇TNF-α抑制劑治療。常規推薦TNF-α抑制劑治療方案如下,TNF-α抑制劑皮下注射2次/周,25 mg/次,持續24周。根據患者實際病情需要,聯合1種抗風濕病情藥物 (disease-modifying antirheumatic drugs,DMARD) 藥 物 進 行 治 療。記錄患者的基線期信息,包括年齡、性別、病程、血沉 (erythrocyte sedimentation rate,ESR) 、C反應蛋白(C-reactive protein,CRP) 、DAS28評分、健康狀況問卷 (health assessment questionnaire,HAQ) 評分、類風濕因子 (rheumatoid factor,RF) 狀態、抗環瓜氨酸肽抗體 (anti-cyclic citrullinated peptide antibody,A-CCP)狀態以及合并用藥信息。TNF-α抑制劑治療24周時評估患者的DAS28評分,參考歐洲抗風濕病聯盟標準,臨床應答定義為DAS28評分相對于基線期下降≥1.2分;臨床緩解定義為DAS28評分<2.6分。
1.2.2 樣本采集:基線期收集RA患者血清。清晨抽取空腹靜脈血5 mL,室溫放置2 h,或4 ℃過夜后于3 000 r/min (離心半徑10 cm) 離心5 min,分離血清,置于-80 ℃冰箱中保存待用。
1.2.3 酶聯免疫吸附測定 (enzyme-linked immunosorbent assay,ELISA):嚴格按照ELISA試劑盒 (美國Abcam公司) 操作說明進行ELISA測定,測量基線期生存素表達水平。
1.3 統計學分析
采用SPSS 23.0軟件和GraphPad prism V5.01軟件進行數據分析。連續變量采用Kolmogorov-Smirnov進行正態性檢驗,符合正態分布的連續變量采用s的形式描述,非正態分布的連續變量采用中位數 (四分位間距) 形式描述。分類變量采用頻數 (百分比) 的形式表示。生存素水平 (非正態分布的連續變量) 在應答患者和無應答患者以及緩解患者和未緩解患者的組間差異比較采用Mann-Whitney U檢驗。采用受試者工作特征 (receiver operating characteristic,ROC) 曲線對生存素預測TNF-α抑制劑治療RA患者臨床應答進行評估。采用單因素logistic回歸模型分析影響TNF-α抑制劑治療RA患者臨床療效的因素,將單因素回歸分析中P≤0.1的因素進一步納入多因素logistic回歸模型,分析影響預測TNF-α抑制劑治療RA臨床療效的獨立預測因素。P < 0.05為差異有統計學意義。
2 結果
2.1 患者的基線信息
63例RA患者的平均年齡為 (48±11) 歲,其中,男19例,女44例,疾病病程中位值為59 (51~86) 個月。ESR、CRP中位值分別為36.3 (27.8~50.1) mm/h和29.1 (22.4~38.8) mg/L。DAS28評分和HAQ評分分別為5.7±1.5和1.9±0.8。RF陽性48例 (76.2%) ,RF陰性15例 (23.8%);A-CCP陽性42例 (66.7%) ,陰性21例 (33.3) 。合并治療MTX、來氟米特 (leflunomide,LEF) 和柳氮磺吡啶 (sulfasalazine,SSZ) 的患者數分別為30例 (47.6%) 、26例 (41.3%) 和7例 (11.1%) 。
2.2 TNF-α抑制劑治療臨床應答和無應答RA患者基線期血清生存素表達水平
如圖1所示,經24周TNF-α抑制劑治療后,參考歐洲抗風濕病聯盟標準對63例患者進行評估,41例符合臨床應答標準 (設為應答組) ,22例未達到臨床應答 (設為無應答組) 。應答組基線期生存素表達水平低于無應答組 (P = 0.004) 。
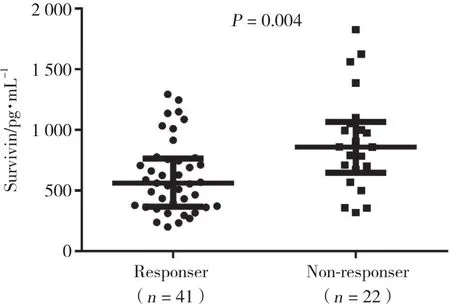
圖1 TNF-α抑制劑治療應答組與無應答組患者基線期生存素表達水平Fig.1 The expression level of survivin in TNF-α inhibitor treatment responser group and non-responser group
2.3 生存素水平預測TNF-α抑制劑治療RA患者臨床無應答的ROC曲線分析
如圖2所示,生存素表達水平對預測TNF-α抑制劑治療有無應答具有較高價值,生存素表達水平越高,則預示治療應答可能性越大,其曲線下面積 (area under the curve,AUC) 為0.717,95%CI:0.583~0.852,當取最佳分割點生存素水平為780.7 pg·mL-1時 (特異度與靈敏度之和最大的點) ,特異度為63.6%,靈敏度為80.5%。
2.4 基線期預測TNF-α抑制劑治療RA臨床應答的因素分析
為了明確基線期生存素水平在TNF-α抑制劑治療RA臨床應答中的預測作用,進一步采用單因素、多因素logistic回歸模型分析了基線期特征對于臨床應答的預測作用,其中連續變量按照中位值或均值劃分高低。單因素回歸結果表明,生存素高表達可預測TNF-α抑制劑治療RA患者無臨床應答 (P = 0.008) ,CRP水平高可以預測TNF-α抑制劑治療RA患者臨床應答 (P = 0.003) ,見表1。
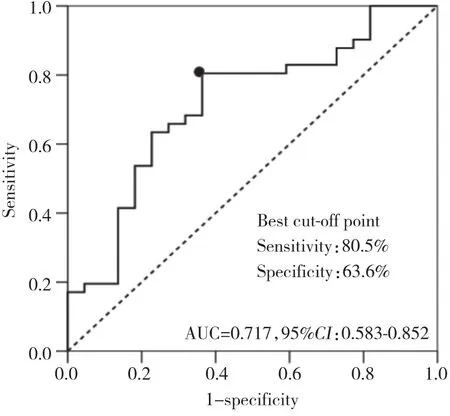
圖2 生存素預測TNF-α抑制劑治療RA患者臨床無應答的ROC曲線Fig.2 ROC curve of survivin predicts the efficacy of TNF-α inhibitor treatment for RA patients without a clinical response
將單因素logistic回歸模型中P ≤ 0.1的因素進一步納入多因素logistic回歸模型進行分析,結果顯示,生存素高表達可以獨立預測TNF-α抑制劑治療RA患者無臨床應答 (P = 0.032) ,而CRP水平高也可以獨立預測RA患者對TNF-α抑制劑治療有臨床應答 (P =0.011) ,見表2。因此,生存素高表達可以獨立于CRP預測TNF-α抑制劑治療RA患者無臨床應答。
2.5 TNF-α抑制劑治療緩解組與未緩解組基線期生存素表達水平
經TNF-α抑制劑治療24周后,DAS28評分結果顯示16例RA患者達到臨床緩解 (設為緩解組) ,47例未達到臨床緩解 (設為未緩解組) ,緩解組基線期生存素水平與未緩解組相比無統計學差異 (P =0.265) 。見圖3。
2.6 基線期預測TNF-α抑制劑治療RA臨床緩解的因素分析
單因素logistic回歸結果顯示,生存素高表達以及患者基線信息、生化指標水平、聯合用藥等均不是影響RA患者達到TNF-α抑制劑治療臨床緩解的因素 (均P > 0.1) 。因為所有因素P值均>0.1,所以沒有進行多因素回歸分析,見表3。
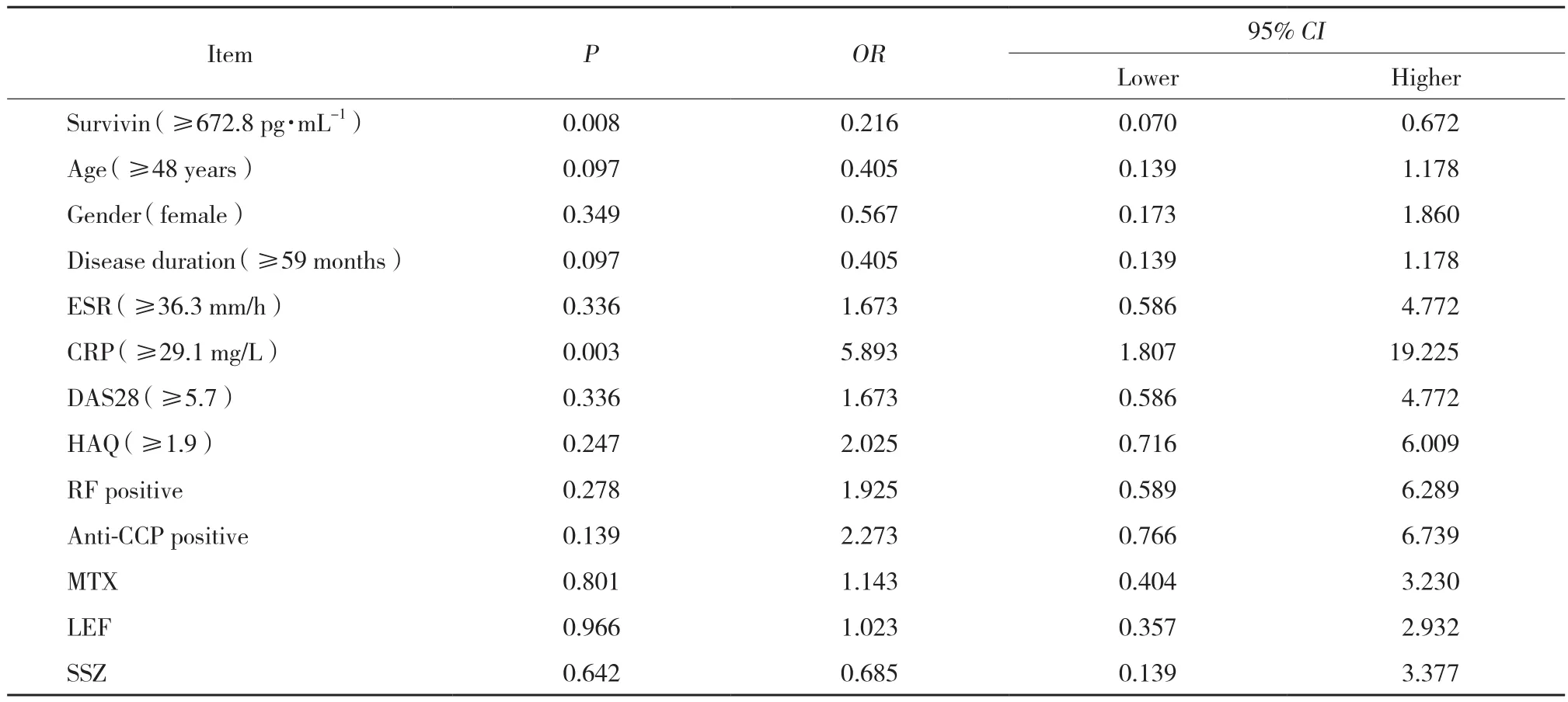
表1 影響TNF-α抑制劑治療RA患者臨床應答因素的單因素logistic回歸分析Tab.1 Univariate logistic regression analysis of clinical response factors in RA patients treated with TNF-α inhibitor
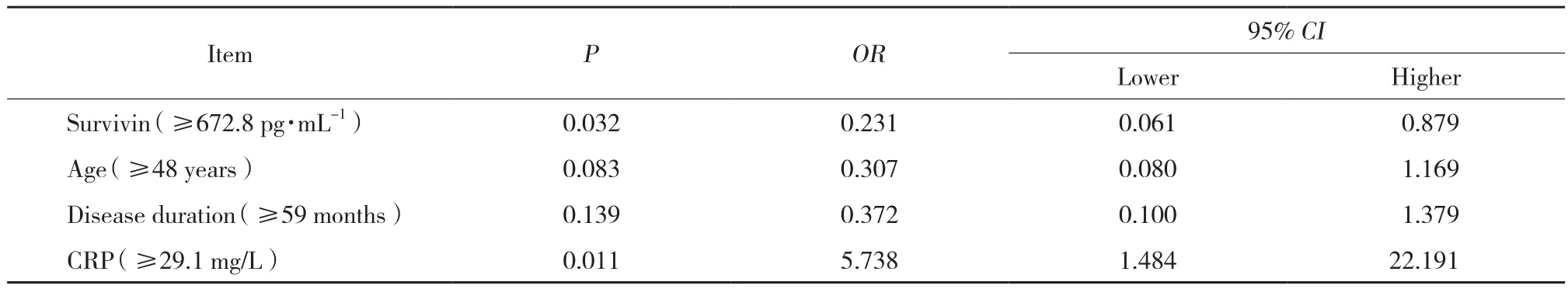
表2 影響TNF-α抑制劑治療RA患者臨床應答因素的多因素logistic回歸分析Tab.2 Multivariate logistic regression analysis of clinical response factors in RA patients treated with TNF-α inhibitor
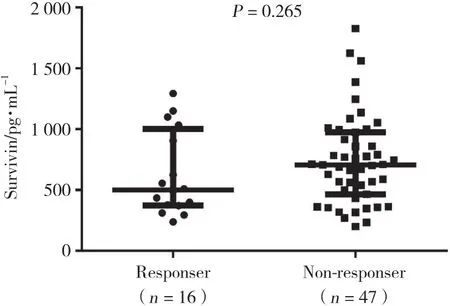
圖3 TNF-α抑制劑治療緩解組與未緩解組基線期生存素表達水平的差異Fig.3 Differences in baseline survivin level in the remission and non-remission groups after treatment with TNF-α inhibitor
3 討論
生存素是凋亡抑制蛋白家族中的一員,是由142個氨基酸組成的多功能蛋白。它可以直接或間接抑制凋亡相關蛋白caspase3/7/9的激活從而抑制細胞凋亡,此外它還參與細胞周期,具有調節細胞有絲分裂的功能,是聯系細胞周期和細胞凋亡的重要因子[7-8]。在免疫細胞中,生存素是功能T細胞受體形成和記憶T細胞分化的重要組成部分[8],還是功能性抗原遞呈所必須的,可以調節組織相容性復合體Ⅱ分子的表達和抗原遞呈樹突狀細胞的成熟,在RA發病中起著關鍵作用[9]。
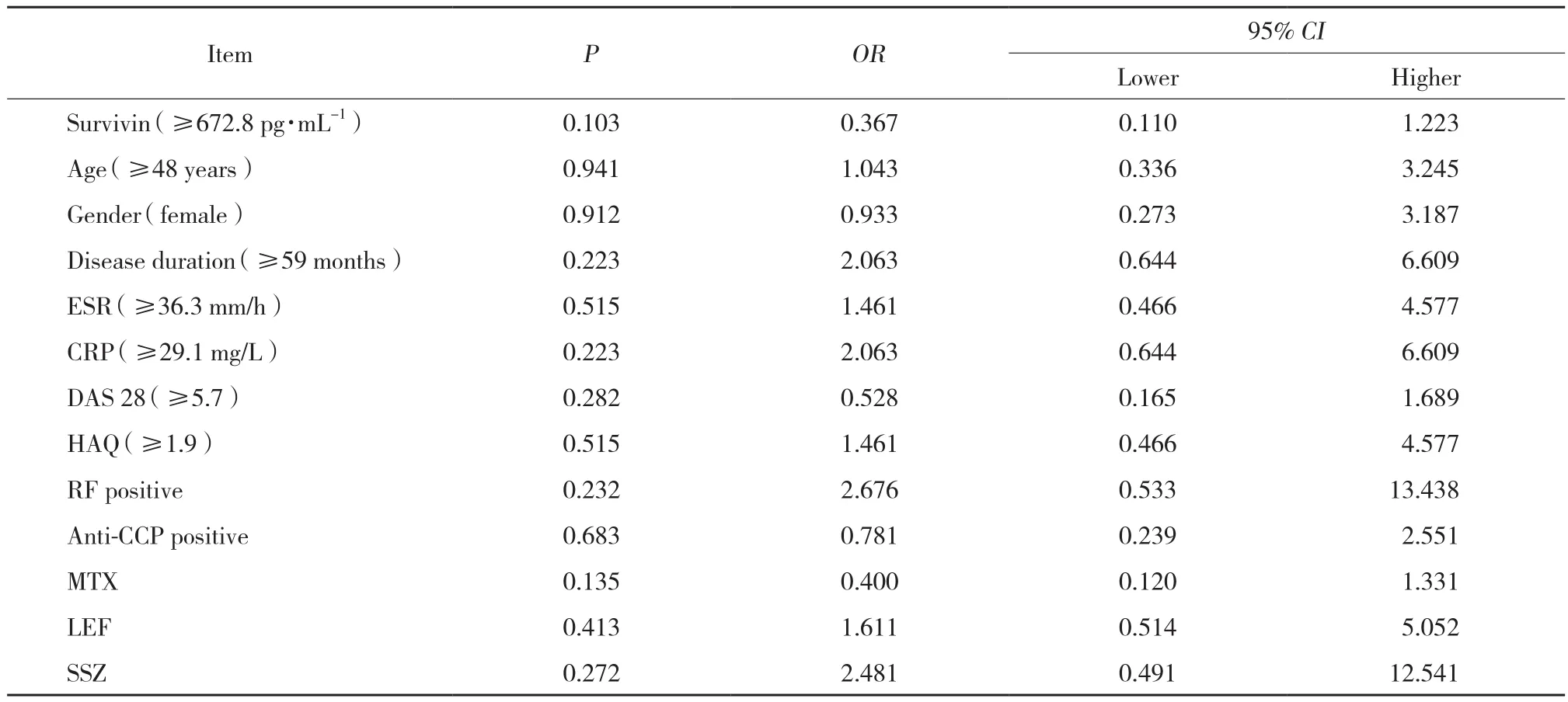
表3 影響TNF-α抑制劑治療RA患者臨床緩解的單因素logistic回歸分析Fig.3 Logistic regression analysis of clinical remission in RA patients treated with TNF-α inhibitor
研究表明,RA的發生與滑膜細胞周期失調及凋亡異常導致的關節滑膜組織過度增生、肥厚有關。已有資料證實滑膜組織、關節液及血漿中存在生存素高表達,并且與早期關節損傷和不良治療反應相關[8-10]。一項關于馬來西亞RA流行病學的研究[11]顯示,在1 233例RA患者中,有50.7%的患者血液檢測出高表達的生存素,而1 566例對照組中僅有5.4%生存素水平升高。另一項研究以87例年齡為24~89歲,病程18~526個月的RA患者為研究對象,通過ELISA方法檢測RA患者血液中生存素的表達水平,結果發現37%的RA患者生存素水平呈陽性 (生存素>0.9 ng/mL) 。而與生存素陰性的患者相比,血液生存素陽性的患者對單用infliximab治療不容易產生臨床應答和達到臨床緩解[12]。提示生存素可能可以預測RA患者對生物制劑治療的敏感性。但是生存素預測TNF-α抑制劑治療RA患者臨床療效的研究尚少,其預測作用尚不完全清楚。本研究通過ELISA檢測并分析基線期生存素水平在預測TNF-α抑制劑治療RA患者臨床療效中的作用,結果發現,生存素在臨床應答組患者中顯著下調。進一步多因素logistic回歸模型分析顯示,基線期生存素水平高可以獨立預測RA患者對TNF-α抑制劑治療不容易達到臨床應答。分析其原因可能是生存素可以抑制細胞凋亡,參與細胞周期,促進細胞增殖,而細胞增殖和抗細胞凋亡進一步促進類風濕成纖維樣滑膜細胞和類風濕關節慢性炎癥細胞的增多[8-9,11]。因此,高水平的生存素可能預示著患者預后差,疾病進展快。此外,生存素可能對生物制劑具有抵抗作用,使RA患者產生耐藥[11-13],故生存素可以獨立預測RA患者對TNF-α抑制劑治療的臨床應答。但是本研究發現,基線期生存素水平并不能預測患者對TNF-α抑制劑治療是否達到臨床緩解。可能是由于本研究評估時間較短,達到臨床緩解的患者較少,導致結果可能出現偏差。
本研究存在一些局限性:(1) 樣本量相對較小,僅63例患者,缺乏統計效能,未能找到影響療效緩解的因素,因此,未來的研究應納入更多樣本,以進一步驗證生存素對TNF-α抑制劑臨床療效的預測價值; (2) 隨訪時間較短,僅為24周,因此生存素對TNF-α抑制劑治療RA患者的長期療效及預測作用未能評估; (3) 由于患者有聯合其他DMARDs進行治療,可能會影響生存素的表達水平,從而干擾生存素預測TNF-α抑制劑治療RA臨床應答的結果,但是本研究進行了單因素和多因素logistic回歸分析,減少了其他藥物對結果預測的干擾。
綜上所述,本研究結果表明,基線期血清生存素表達水平可以作為預測TNF-α抑制劑治療中高疾病活動度RA患者臨床應答的可靠生物標志物。

