金針菇退化菌株復壯條件的優化初探
李雪飛 佟希丹 李長田 付永平 宋 冰 李 玉
?
金針菇退化菌株復壯條件的優化初探
李雪飛 佟希丹 李長田 付永平 宋 冰*李 玉*
(吉林農業大學食藥用菌教育部工程研究中心,吉林 長春 130118)
金針菇在工廠化栽培的過程中,經常出現菌種退化問題,嚴重影響產量和質量。試以金針菇的退化菌株為材料,通過組織分離、菌絲尖端分離的方法進行復壯,通過接種在4種不同培養基質上進行生長速度測定,篩選最適合金針菇復壯菌株生長的基質,并考察不同光質對復壯菌株生長的影響。結果表明:構樹基質可以促進金針菇復壯菌株生長;相對于白光和紅光,藍光更有利于金針菇復壯菌株的生長,并在一定程度上提高了產量。
金針菇;退化菌株;復壯;培養基質;光質
金針菇()又名構菌、冬菇、毛柄金錢菌等[1-2]。其顏色有白色、褐色和淡黃色,是我國重要的栽培食用菌之一,有較高的經濟價值和營養價值,且因獨特的口感和風味,備受人們的喜愛。相比其他菇種,金針菇較早實現大規模工廠化周年栽培。
金針菇生長過程中,需要適宜的溫度、濕度、光照和CO2等條件。其屬于厭氧型食用菌品種,對光照要求不嚴格,在光照或黑暗條件下均能形成子實體,而子實體形態和產量則有一定差異[3]。有研究表明,適宜的光質(顏色)在一定程度上可以提高其產量[4-5]。
金針菇在工廠化栽培過程中,經常出現菌絲老化、菌種退化,出菇不整齊,出菇延遲,產量嚴重下降。造成菌種退化的原因較多,包括核型改變、基因突變、菌株無性繁殖體感染病毒、細胞內酶合成能力下降等,此外還有菌種自身遺傳多樣性、營養不良、無限傳代、長期低溫保藏等因素[6]。在金針菇工廠化栽培的過程中,感染病毒是造成菌種退化的主要原因之一。國內外研究多次證實,感染病毒的金針菇會出現菌絲生長變弱[7]、子實體褐化的現象[8],并且由于病毒的潛隱期長、發病癥狀不明顯等導致病毒病害不易被察覺,一旦爆發將造成巨大的損失[9]。
菌種退化分為可逆和不可逆兩類,可逆的退化可通過提純復壯恢復優良特性,生產上常采用菌絲尖端分離和原生質體再生的方法進行提純復壯[10]。研究表明,在金針菇工廠化栽培中使用組織分離法提純復壯效果顯著[11];王玉、張沿江的研究均表明在食用菌菌種復壯過程中,更換培養基基質后菌種活性和成活率均有提升[12-13];張俊玲使用菌絲尖端分離法對金針菇菌株進行復壯處理后收到顯著效果[14]。
本文以金針菇的退化菌株為主要試驗材料,利用簡便易行的菌絲尖端分離法進行復壯處理,并在不同培養基上進行復壯培養,將獲得的復壯菌株在不同光質下進行出菇栽培實驗,以期篩選獲得金針菇退化菌株適宜的復壯培養基和光照條件。
1 材料與方法
1.1 供試菌株
退化菌株白色金針菇品種沈金2號和黃色金針菇品種川6號,由吉林農業大學提供。
1.2 培養基
(1)基礎培養基。①PDA培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,維生素B 10 mg/L,水1 000 mL,pH自然。②PDB液體培養基:馬鈴薯200 g/L,葡萄糖20 g/L,水1 000 mL,pH自然。
(2)復壯培養基。①CK培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,維生素B 10 mg/L,麩皮50 g/L,水1 000 mL。②構樹培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,維生素B 10 mg/L,麩皮50 g/L,構樹木屑10 g/L,水1 000 mL。③燕麥培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,維生素B 10 mg/L,麩皮50 g/L,燕麥10 g/L,水1 000 mL。④玉米粉培養基:馬鈴薯200 g/L,葡萄糖20 g/L,瓊脂20 g/L,MgSO41.5 g/L,KH2PO43 g/L,維生素B 10 mg/L,麩皮50 g/L,玉米粉10 g/L,水1 000 mL。
1.3 組織分離法制備菌種
將兩個退化菌株分別進行組織分離,在超凈工作臺內取菌柄與菌蓋連接處的菌肉置于含有PDA培養基的培養皿上,24 ℃恒溫培養箱內避光培養,獲取金針菇退化菌種待用。
1.4 菌絲尖端分離法復壯金針菇退化菌株
(1)用打孔器分別取兩退化菌株菌落邊緣菌塊(直徑0.5 cm)置于PDA培養基上,獲得白色品種復壯一代,黃色品種復壯一代。與此同時選取退化菌株中間菌落置于PDA培養基上,獲得白色原種和黃色原種,將所有接有菌塊的培養皿置于24 ℃恒溫培養箱中進行避光培養,觀察并記錄菌絲的長勢。
(2)待菌落長到一定體積后,對黃色、白色復壯一代進行菌絲尖端分離,獲得白色、黃色復壯二代;并對白色、黃色原種進行擴繁,置于24 ℃恒溫培養箱中進行避光培養,觀察并記錄菌絲長勢。重復以上步驟,獲得復壯三代和同期原種。
1.5 測量不同培養基菌絲生長速率
用打孔器分別在所獲得的復壯三代和原種中取同一位置菌塊接種于提前準備好的4種復壯培養基的正中央,每組設置3個重復,置于24 ℃恒溫培養箱內進行避光培養。與此同時,采取十字交叉法劃線,連續一周每天測量菌落大小,并記錄實驗數據,以便計算菌絲生長速率。
1.6 栽培出菇
將所獲得的退化菌株原種和白色、黃色復壯菌株在無菌條件下用打孔器取6~7個菌塊分別接種于提前準備好的PDB液體培養基中,做好標記,置于振蕩頻率為200 r/min的恒溫搖床中培養6~7天獲得液體菌種,4 ℃下保存待用。
栽培瓶規格為直徑7 cm,高12 cm,裝料高壓滅菌冷卻后置于超凈工作臺上消毒接種,每瓶接入液體菌種約10 mL。接菌后,置于24 ℃下避光培養,待菌瓶菌絲長滿后,搔菌,移入出菇室的暗箱中進行出菇管理。
出菇室溫度控制在15 ℃,空氣相對濕度80%~90%,同時設置白、紅、藍三色光處理,白色光為對照,每天光照時間8 h,觀察子實體的生長情況,記錄原基個數并進行觀察。待子實體成熟后,測定菌柄長度、粗細、菌蓋直徑和單瓶產量等商品性狀。
2 結果與分析
2.1 不同復壯培養基對復壯菌株生長的影響
通過比較金針菇復壯菌株與原種退化菌株在各培養基上的生長速率(表1)發現,在構樹培養基中各菌株菌絲生長速率均較快,兩個品種復壯之后菌絲生長速度明顯加快,且黃色品種菌絲生長速率較白色品種快,復壯效果更為明顯。
通過不同培養基菌絲長勢方差分析,得出構樹培養基所對應的Sig.=0.047<0.05,說明其對菌絲長勢具有顯著性影響,而玉米培養基和燕麥培養基對應Sig.值均>0.05,說明對菌絲長勢均沒有顯著影響。
通過比對金針菇復壯菌株與原種退化菌株生長性狀(表2),可看出復壯菌株各性狀均有改良,其中子實體原基個數、生物學效率增加明顯。生物學效率相比原種退化菌株,黃色品種提高17%,原基數增加20個,子實體重增加2.2 g;白色品種提高13%,原基數增加12個,子實體重提高2.7 g。
2.2 不同光質對復壯菌株的影響
通過比較金針菇復壯菌株與原種退化菌株在各光照處理下的子實體性狀(表3),得出兩個復壯菌株的各項性狀均優于原種退化菌株,而藍光處理組子實體重和原基數目均優于紅、白光處理。
3 結論與討論
3.1 結論
本研究采用組織分離法和菌絲尖端分離法對菌株進行復壯。將金針菇兩個品種分別置于4種復壯培養基內進行培養,并通過對菌絲生長速度的測量比對,得出結論:在復壯方法為菌絲尖端分離時,添加構樹木屑的培養基菌絲生長速率較快。由此推測,構樹木屑含有更有利于菌絲生長的營養成分,且金針菇黃色品種較白色品種復壯效果顯著。
復壯處理后對原種退化菌株和復壯菌株在不同光照下進行出菇栽培實驗,復壯菌株與原種退化菌株相比:黃色品種生物學效率提高17%,原基數增加20個,子實體重提高2.2 g;白色品種生物學效率提高13%,原基數增加12個,子實體重提高2.7 g。得出結論:金針菇復壯菌株的各項指標均優于原種退化菌株,且在三色光中,藍色光照射處理的子實體重以及原基數量均有所提高,優于白光、紅光的處理效果。
3.2 討論
目前,金針菇主要為工廠化周年栽培生產,若想保證其產量及質量,就必須從源頭發現并及時解決問題,保證菌種的質量。但由于菌種的長時間保存和多次擴繁,均在一定程度上導致活力下降,影響產品產量和質量。為此需要對金針菇的菌種進行復壯,增強其活力。
菌種退化除了病毒感染的原因外,還有營養不良、無限傳代、菌種保藏不當等原因[15]。因此不能考慮單一因素,而要齊頭并進,從小處著手。對退化菌種,可采取及時剔除、定期分離純化、創造適合的培養基質及環境條件、控制菌種的傳代次數、更換不同的培養基質等措施[16]。食用菌菌株的復壯方法主要有傳統的組織分離法、菌絲尖端分離法、原生質體再生法等。相比原生質體再生法,菌絲尖端分離法容易得到純的提純復壯的菌株;若將退化的菌株直接進行原生質體再生,無疑增加了篩選的工作量,也很難達到滿意的效果。本實驗采用的菌絲尖端分離法具有操作簡單、轉化效率高、不需要特殊的儀器設備等優點,目前最為常用。
本研究所進行的栽培實驗為小批量實驗,初步斷定在金針菇的栽培過程中,藍色光源為有利光源,在一定程度上促進生長,提高產量。但是光源應用也需講究,否則會有相反的作用。2012年,佟希丹報道,不同品種在不同時期用不同光照照射不同時間,對金針菇的生長均有不同的影響[17]。在今后的研究中,應考慮在金針菇生長不同時期的不同光照強度以及復合光的應用。金針菇工廠化周年生產,把補充光源的范圍和密度作為一個變量考慮進去,在保證節約能源的前提下可提高產量,增加收入。
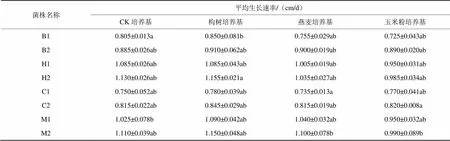
表1 金針菇復壯菌株與原種退化菌株在各培養基上的生長速率比較
注:B1標記為組織分離培養所得樣本白色退化菌株,B2標記為組織分離培養所得樣本白色復壯菌株;H1標記為組織分離培養所得樣本黃色退化菌株,H2標記為組織分離培養所得樣本黃色復壯菌株;C1標記為菌料中菌絲培養所得樣本白色退化菌株,C2標記為菌料中菌絲培養所得樣本白色復壯菌株;M1標記為菌料中菌絲培養所得樣本黃色退化菌株,M2標記為菌料中菌絲培養所得樣本黃色復壯菌株。
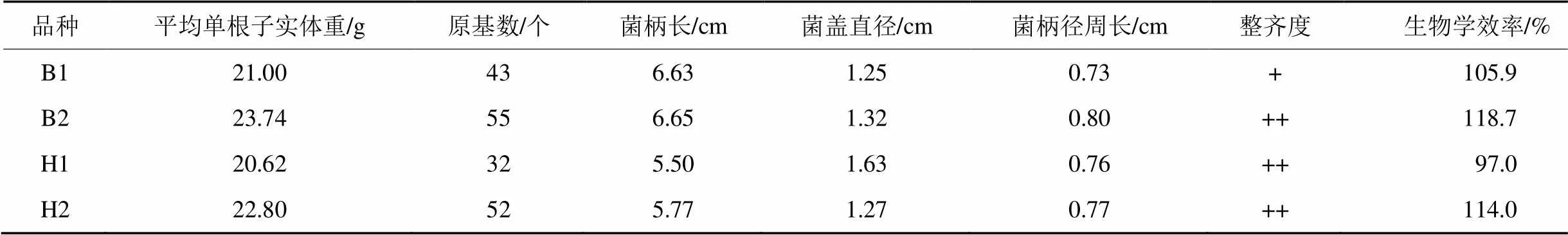
表2 金針菇復壯菌株與原種退化菌株生長性狀比對
注:B1標記為白色退化菌株,B2標記為白色復壯菌株;H1標記為黃色退化菌株,H2標記為黃色復壯菌株。
生物學效率=(子實體鮮重/培養料干重)×100%。
“+”越多表示子實體整齊度越好。
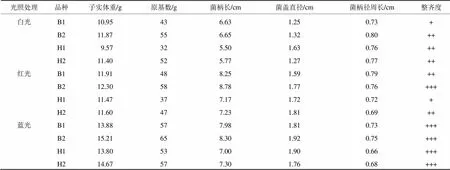
表3 金針菇復壯菌株與原種退化菌株在各色光照處理下的子實體性狀
注:B1標記為白色退化菌株,B2標記為白色復壯菌株;H1標記為黃色退化菌株,H2標記為黃色復壯菌株。
“+”越多表示子實體整齊度越好。
[1] Wang PM, Liu XB, Dai YC, et al. Phylogeny and species delimitation of Flammulina: taxonomic status of winter mushroom in East Asia and a new European species identified using an integrated approach[J]. Mycological Progress, 2018(7): 1-18.
[2] 戴玉成, 楊祝良. 中國五種重要食用菌學名新注[J/OL].菌物學報: 1-6[2018-12-11]. https://doi.org/10.13346/j. mycosystema.180117.
[3] 錢磊, 張志軍, 周永斌, 等. 光對食用菌生長的影響[J]. 天津農業科學, 2017, 23(7): 103-106.
[4] 劉明月, 何長征. 光質對金針菇子實體生長發育的影響[J]. 中國食用菌, 1997(6): 11-13.
[5]張楊. 金針菇的光效應[J]. 食用菌, 1984(1): 29.
[6] 李亞嬌, 郭九峰. 食用菌菌種退化機制及預防措施的最新研究進展[J]. 黑龍江農業科學, 2018(2): 136-139.
[7] Magae Y, Hayashi N. Double-stranded RNA and virus-like particles in the edible basidiomycete Flammulina velutipes(Enokitake)[J]. FEMS microbiology Letters, 1999, 180(2): 331-335.
[8] Magae Y, Sunagawa M. Characterization of a mycovirus associated with the brown discoloratin of edible mushroom, Flammulina velutipes[J]. Virology Journal, 2010(7): 342.
[9] 張俊玲, 章爐軍, 尚曉冬, 等. 主栽金針菇品種中病毒的快速檢測和鑒定[J]. 中國農學通報, 2015, 31(6): 234-240.
[10] 劉昆昂, 張根偉, 馬宏, 等. 黃色金針菇菌株提純復壯技術研究[J]. 食用菌, 2017, 39(2):21-23.
[11] 陳志松. 工廠化栽培金針菇菌種退化與復壯的研究[J].中國食用菌, 1998(05): 10.
[12] 周君強. 食用菌菌種復壯四法[J]. 吉林農業, 2007(03): 38.
[13] 張沿江, 張翠艷, 吳金玉. 食用菌菌種復壯的方法[J]. 農村科學實驗, 2003(5): 34.
[14]張俊玲, 章爐軍, 劉建輝, 等. 金針菇褐化病毒(FvBV)脫毒方法[J]. 微生物學通報, 2015, 42(10): 1952-1961.
[15] 姚衛紅, 張麗娜, 劉美秀. 淺談菌種的退化及有效包藏方法[J]. 中國衛生產業, 2013(3): 189-189.
[16] 赫朝燦. 菌種退化的原因、處理措施及菌種保藏探析[J]. 生物技術世界, 2015(2): 1.
[17] 佟希丹. 不同光質LED對黃白品種金針菇商品性狀與產量的影響[D]. 長春: 吉林農業大學, 2012.
Preliminary study onoptimization of conditions for rejuvenation of degenerated strains of
Li Xuefei Tong Xidan Li Changtian Fu Yongping Song Bing*Li Yu*
(Engineering Research Center of Chinese Ministry of Education for Edible and Medicinal Fungi, College of Agronomy, Jilin Agricultural University, Changchun 130118, JilinProvince, China)
Industrial cultivation ofstrains are often affected by degeneration leading to yield and quality loss. In this study, two degenerated strains ofwere used as starter materials from which rejuvenated strains were obtained by tissue and mycelial tip isolation technique. The most suitable media for reviving the growth of the degenerated strains was screened by measuring their growth rate on four different media, and the effects of different light quality on their growth were also investigated.The results showed that a media prepared fromin addition to blue light was the best in rejuvenating the growth of degenerated strains ofand increased their yield to a certain extent. This rejuvenation method will provide technical support for commercial production of, as well as in the preservation of strains.
; Degenerated strains; Rejuvenation; Illumination
S646
B
2095-0934(2019)01-052-05
長春市科技局資助項目(15SS11),公益性行業(農業)科研專項(No.201503137);吉林省教育廳項目(No.JJKH20180670KJ);高等學校學科創新引智計劃資助項目(No.D17014)
,E-mail:yuli@126.com(李玉);song19800123@126.com(宋冰)。

