聯合細胞膜片和自組裝多肽技術構建一種新型BMSCs膜片-RADA16組織工程復合體的研究
李豆豆 周維維 王蕾 劉露 李春絨 劉思麟 曹猛
骨組織工程是組織工程學中的一個分支,它主要利用工程學的原理和方法將種子細胞復合于生物支架上形成細胞-支架復合體,最終移植于缺損處達到修復再生的目的[1]。此外,細胞膜片技術(cell sheet technology,CST),也稱細胞片層技術,是種子細胞利用自身的細胞外基質(ECM)形成的數層致密細胞聚合體,也是目前骨組織工程的常用方法之一[2]。
對于理想的骨組織工程支架材料,有利于細胞粘附、增殖和分化的表面性能、合適的空隙、以及良好的生物安全性等均是十分重要的影響因素[3-4]。自組裝多肽(Self-assembled peptides,SAP)是以多肽為基本組成單元,依靠多肽分子天然自組裝得到的新穎支架材料。RADA16(AcN-RADARADARADARADA-CNH2)是一種具有納米級纖維的自組裝多肽凝膠,其纖維空隙、簡單的氨基酸成分和充分的含水量,更接近天然細胞外基質,可作為細胞支架提供理想的三維生長環境[5-8]。
本實驗擬構建BMSCs膜片-RADA16復合體,探究復合體對細胞的增殖情況以及成骨分化能力的影響。
1 材料與方法
1.1 實驗動物和主要材料、儀器
實驗動物: 8 周齡SD大鼠。 α-MEM培養基(Hyclone,美國);胎牛血清(杭州四季青);胰蛋白酶(Sigma,美國); RADA16水凝膠 (Corning,美國);羅丹明標記的鬼筆環肽(Cytoskeleton,美國);地塞米松、β-甘油磷酸鈉、吲哚美辛、抗壞血酸、胰島素、油紅O、茜素紅(Sigma-Aldrich,美國);BCIP/NBT 堿性磷酸酯酶顯色試劑盒(康為世紀);CCK-8試劑盒(南京恩晶生物);掃描電子顯微鏡(JSM-6700F,日本);激光掃描共聚焦顯微鏡(Olympus Fluoview FV1000,日本);反轉錄和定量 PCR試劑盒(Ta) (Ka) (Ra,日本);實時定量PCR儀(Prime Q,英國);SynergyTMHT酶聯免疫檢測儀(BioTek, 美國)。
1.2 BMSC的分離培養和鑒定
SD大鼠脫頸處死,無菌條件下取股骨及脛骨,剃除肌肉。剪掉股骨和脛骨的骨骺端,露出骨髓腔,用添加青、鏈霉素的α-MEM培養基沖出骨髓,輕輕吹打均勻,接種于25 cm2培養瓶中,置37 ℃、 5% CO2和飽和濕度的培養箱中培養。
流式細胞儀檢測細胞表面標記: 細胞傳至P3代,調整細胞數量至每EP管1×106個, 各管依次加入單克隆抗體CD29、CD34、CD45、CD90。同時每管樣品設立同型陰性對照。避光冰上孵育45 min,用500 μl PBS(含1%BSA)重懸細胞,流式細胞儀進行檢測分析。
BMSCs體外誘導分化:選擇P3代BMSCs,以3×105個/孔的濃度接種于6孔培養板,待細胞貼壁生長至密度達80%時,在各孔的完全培養液中分別加入下列誘導劑:①成脂細胞誘導劑(1 mmol/L地塞米松、 10 mg/L胰島素、 50 mmol/L IBMX、 吲哚美辛 0.2 mmol/L)。②成骨細胞誘導劑(1 mmol/L地塞米松、 1 mol/L β-甘油磷酸鈉、 50 mmol/L抗壞血酸)。成脂細胞誘導劑誘導14 d后,經4%多聚甲醛固定,對誘導分化的脂肪細胞進行油紅O染色;成骨細胞誘導劑誘導7 d和21 d后,經4%多聚甲醛固定,對誘導分化的成骨細胞分別進行BCIP/NBT堿性磷酸酶和茜素紅染色。
1.3 BMSC膜片和BMSC-RADA16復合體的構建
選擇P3代細胞,以5×105個/孔的濃度接種于6孔培養板,待細胞貼壁生長至密度達90%~100%時,在完全培養基中加入成膜誘導液(50 μg/ml的抗壞血酸)。
超聲波水浴降低RADA16凝膠粘度,用無菌去離子水稀釋原液1%(w/v)至0.25%,以250 μl/孔的體積加入24 孔培養板。小心緩慢地在凝膠表面加入培養基(500 μl/孔加入24 孔培養板)促進凝膠化。在孵箱中孵育,第一小時內每隔1、 10、 30 min小心更換培養基以平衡凝膠pH,置于孵箱中過夜。培養好的BMSCs膜片包裹凝膠支架,每3 天更換培養液。
1.4 掃描電鏡和激光共聚焦顯微鏡觀察形貌
將BMSCs膜片和BMSCs膜片-RADA16復合體用 3%戊二醛固定過夜,乙醇梯度脫水、冷凍干燥后噴金,掃描電鏡觀察表面的微細結構。
在 24 孔培養板中放置蓋玻片,BMSCs膜片和BMSCs膜片-RADA16復合體培養14 d 后, 4% 多聚醛固定 10 min,PBS 清洗30 s,再用0.5% Triton X-100 處理 5 min。 加入200 μl 100 nm的鬼筆環肽(5 U/ml) 溶液浸沒樣本,黑暗中室溫孵育 30 min,用 100 nm 的 DAPI 染色 5 min。滴加抗熒光淬滅封片液封片,激光共聚焦熒光顯微鏡觀察并拍照。
1.5 CCK-8測定生長曲線
選用P3代細胞,以2×104個/孔的密度接種于24 孔培養板,成膜后繼續培養,每日在其中一板中,加入1 ml培養基和 100 μl CCK-8,避光置入 37 ℃ 培養箱,培養 4 h。每孔吸出100 μl轉移至96 孔板,用酶聯免疫檢測儀檢測吸光度(A)值,激發光波長為 495 nm。記錄各孔吸光值、求其均值并繪制細胞生長曲線。
1.6 Real-Time PCR測定細胞的成骨分化
BMSCs膜片和BMSCs膜片-RADA16復合體以成骨誘導培養基培養。在第 3、 7、 14 天時將各組培養基去除后,用RNAiso Plus提取細胞總RNA,以 20 μl體系將RNA反轉錄為 cDNA。反應條件為:37 ℃ 15 min; 85 ℃ 5 s; 4 ℃。引物根據 NCBI上 Primer-BLAST 設計并經過比對,由北京奧科合成,具體見表 1。結果以 Ct 值表示,以GAPDH為內參照,以2-ΔΔCt計算基因相對表達量。
1.7 統計學分析
采用SPSS 17.0 對數據進行統計分析,兩獨立樣本比較用成組t檢驗,檢驗水準為α=0.05,P<0.05為存在顯著性差異。
2 結 果
2.1 BMSCs的鑒定
流式細胞儀檢測結果顯示: P3代 BMSCs均一表達CD29,CD90,陽性率分別為99.1%、 99.8%;而CD34、 CD45呈陰性,陽性率分別為1.0%、 1.5%(圖 1)。BMSCs成脂誘導分化鑒定:誘導而成的脂肪細胞累積脂質,脂滴變大合并呈串珠狀。經油紅O染色呈鮮紅色 (圖 2A)。BMSCs成骨誘導分化鑒定:堿性磷酸酶染色可見細胞膜及胞漿內礦化顆粒沉積,染色呈藍黑色、深染顆粒(圖 2B)。茜素紅染色礦化結節呈現紅褐色(圖 2C)。以上結果說明培養細BMSCs為骨髓間充質干細胞。

表 1 PT-PCR引物Tab 1 Primers for RT-PCR
2.2 BMSCs膜片和BMSCs-RADA16復合體的形態學觀察
BMSCs膜片、RADA16凝膠支架以及復合體大體觀如圖 3。掃描電鏡觀察結果顯示:膜片細胞生長狀態良好,突觸清晰,有部分細胞正在分裂, 并可見細胞間橋(圖 4A和4B);膜片與支架材料共培養后,細胞在材料上伸出觸角,粘附到支架材料上,并有部分觸角向支架材料孔隙內生長(圖 4C)。電鏡可見支架材料疏松多孔的表面形態(圖 4D)。

圖 1 BMSCs流式細胞儀鑒定結果Fig 1 Identification of BMSCs by flow cytometer

A: 油紅O染色(×20); B: BCIP/NBT堿性磷酸酶(×4); C: 茜素紅染色(×4)圖 2 BMSCs誘導分化觀察A: Oil red O staining(×20); B: BCIP/NBT alkaline phosphatase(×4); C: Alizarin red staining(×4)Fig 2 Induced differentiation of BMSCs
激光共聚焦顯微鏡結果顯示:細胞核被 DAPI 染料染成藍色,細胞骨架被羅丹明-鬼筆環肽染料染成紅色。 2 組細胞生長旺盛,可以觀察到粗大的細胞骨架,其中BMSCs-RADA16復合體組細胞伸展性更好,說明細胞活性更好(圖 5)。
2.3 CCK-8測定生長曲線
細胞生長曲線結果如圖 6 顯示。經統計學分析: 第1~2 天, 2 組間無顯著性差異(P>0.05); 第3~8 天, BMSCs-RADA16復合體組比BMSCs膜片組細胞數量多,且兩者之間有顯著性差異(P<0.05)。
2.4 Real-Time PCR測定成骨表達水平
PCR結果如圖 7所示: 在誘導3、 7、 14 d時, 復合體中成骨相關基因ALP、OCN、COL-1、RUNX2總體趨勢呈上升水平,提示與BMSCs膜片相比,復合體中BMSCs的成骨基因表達量顯著升高。
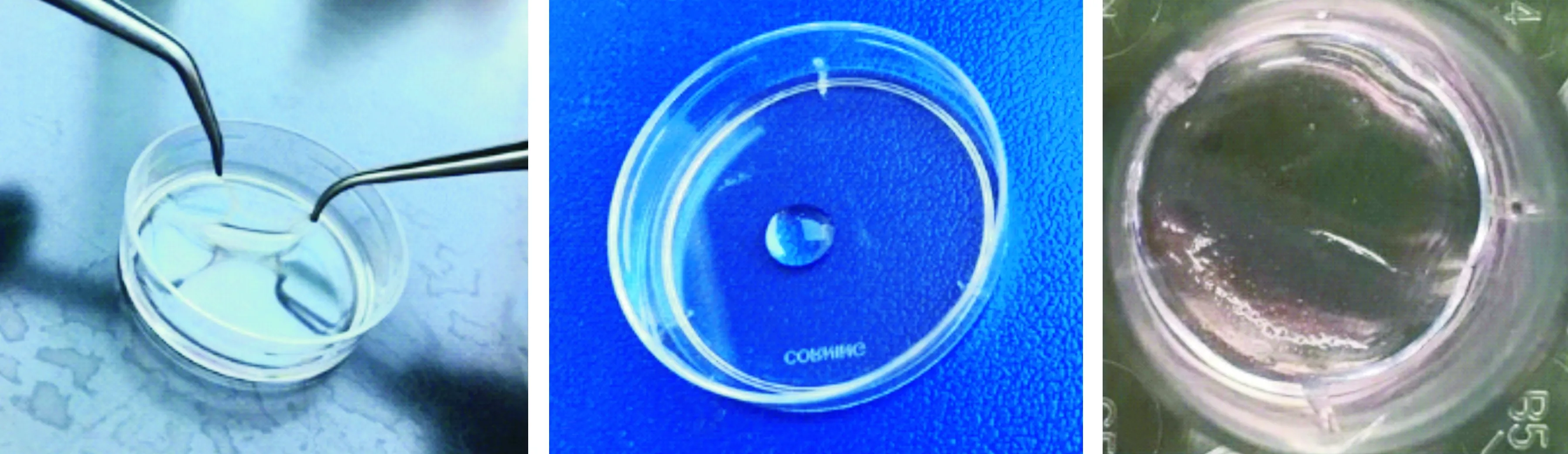
圖 3 膜片、支架及復合體大體觀Fig 3 General view of the cell sheet, scaffold and complex
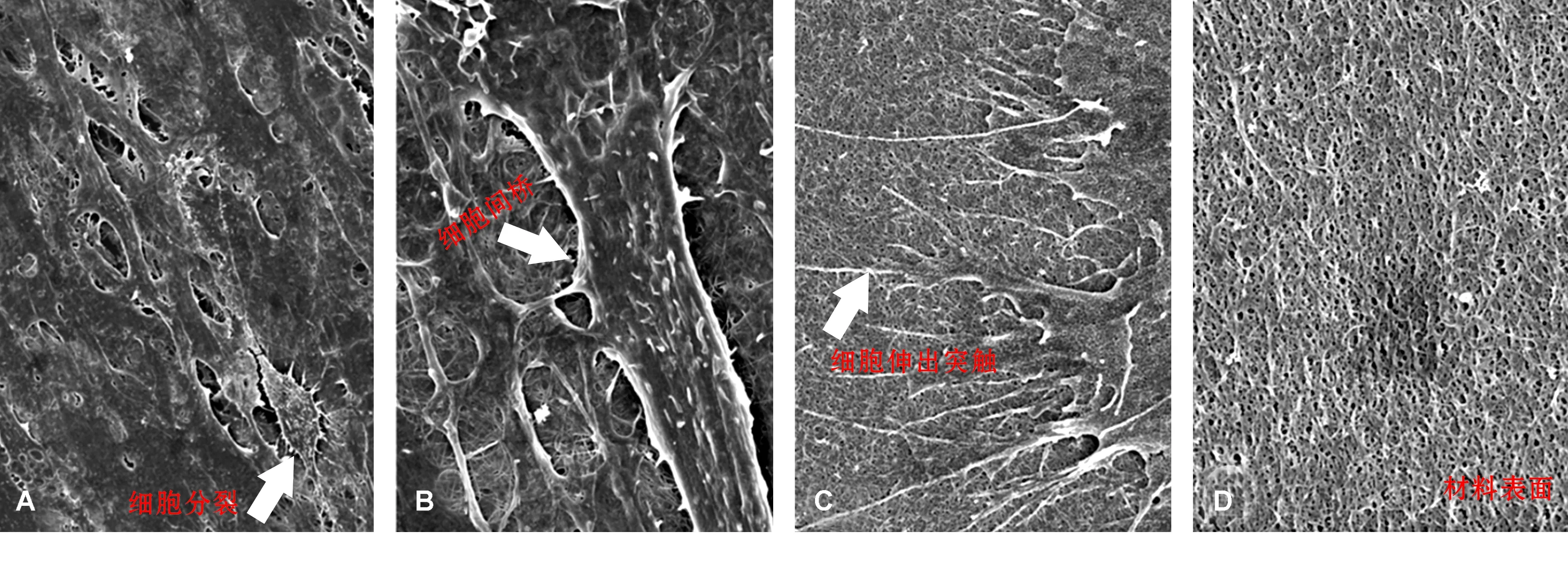
A: ×1 000; B: ×5 000; C: ×10 000; D: ×20 000圖 4 BMSCs和支架形貌(SEM)Fig 4 Morphology of BMSCs and scaffold(SEM)
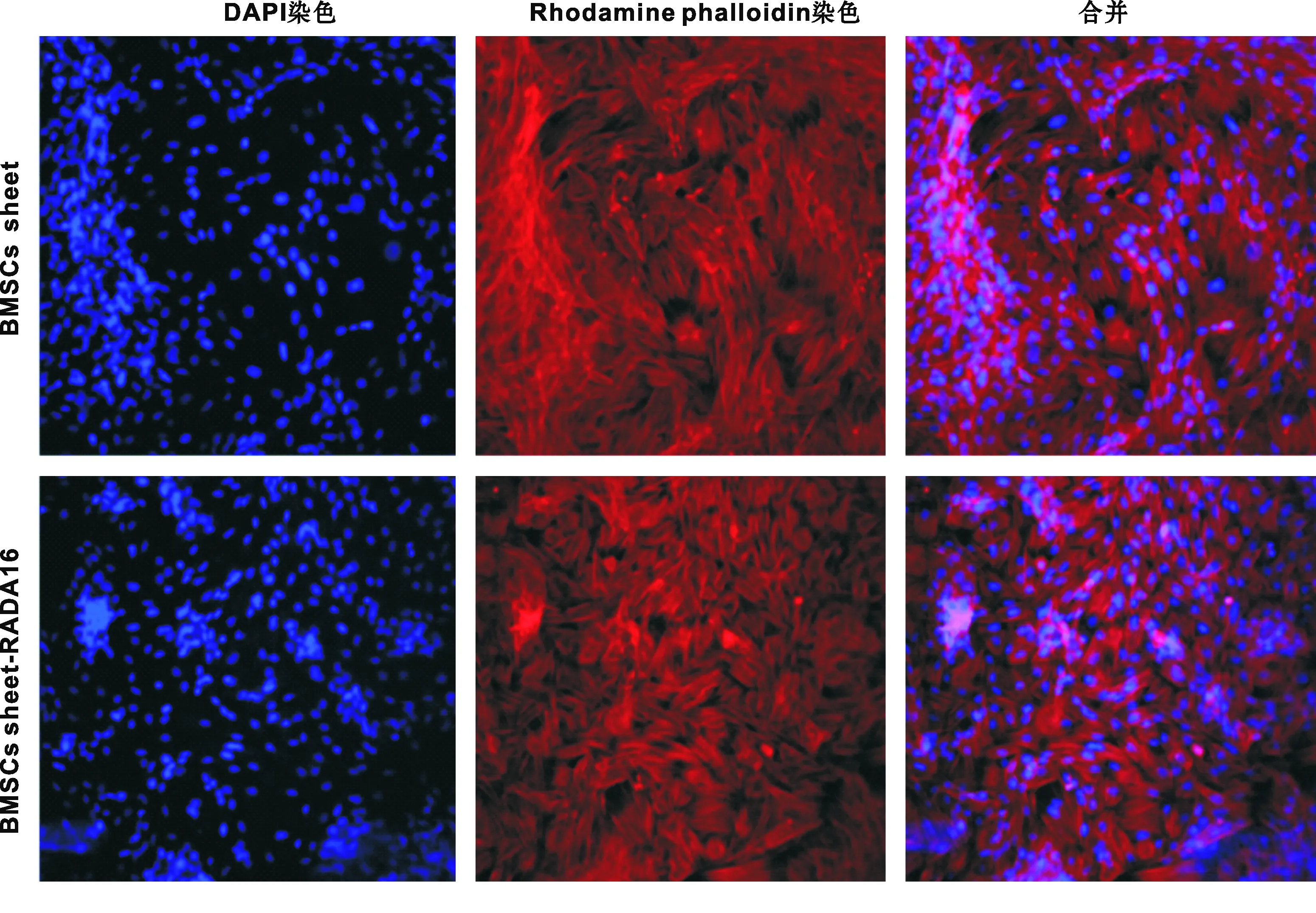
圖 5 DAPI 和Rhodamine phalloidin染色(LCM, ×200)Fig 5 DAPI and Rhodamine phalloidin staining (LCM, ×200)
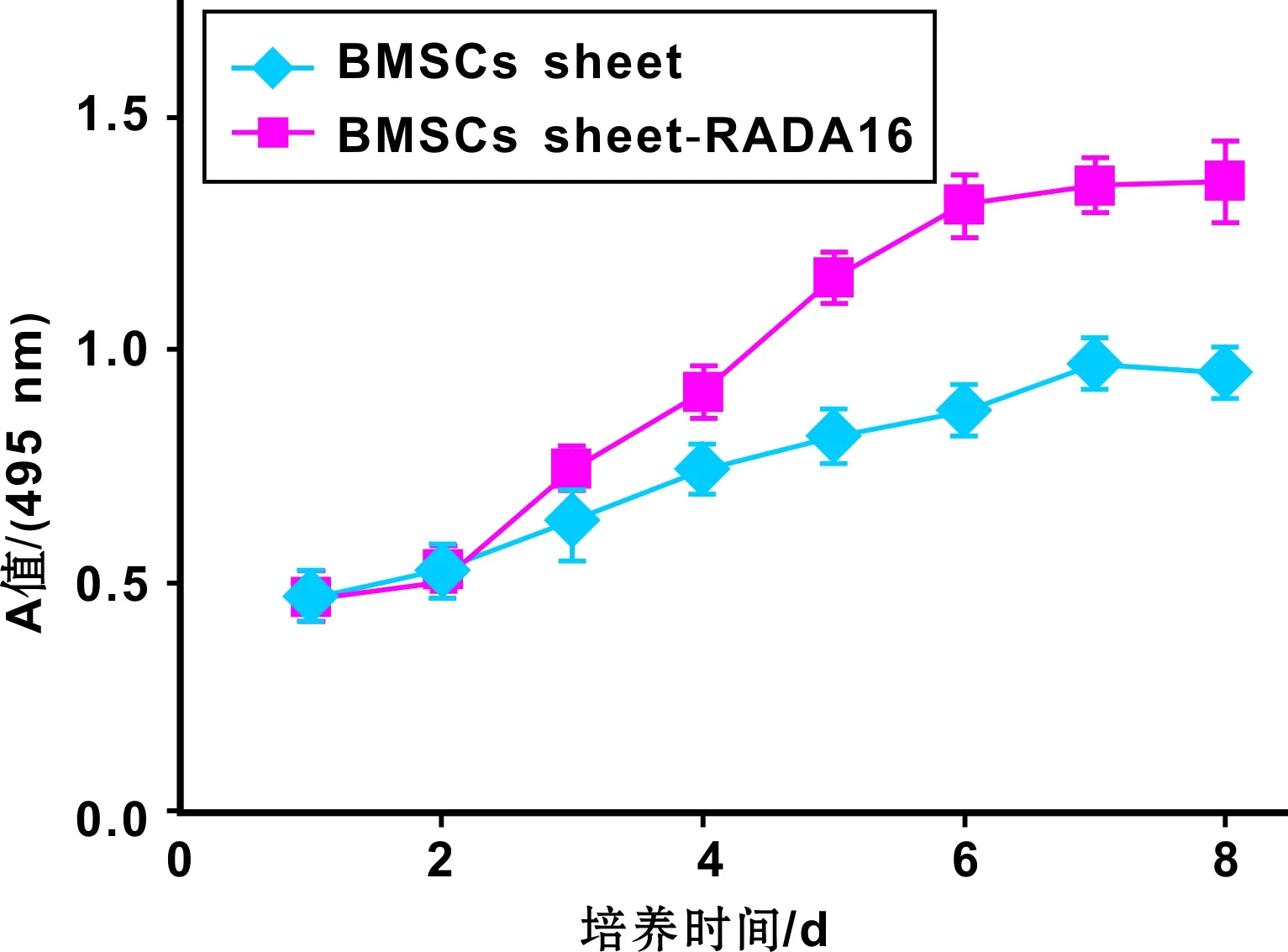
圖 6 BMSCs曲線Fig 6 Growth Curves of BMSCs
3 討 論
組織工程是現代修復重建醫學領域的新思路, 組織工程兩大關鍵要素是種子細胞和生物支架。
目前,研究學者們主要通過應用種子細胞構建細胞膜片或將細胞與支架材料相復合的方法來制備骨組織移植物。細胞膜片是一種細胞聚合體,在高密度接種細胞后, 通過刺激細胞分泌外基質而形成數層致密的細胞片,具有一定的韌性和強度[9]。細胞膜片雖然對小面積骨缺損有一定的效果,但是當缺損較大時,往往因為細胞自組裝聚合能力的限制及中心營養供應等問題難以構建大體積細胞膜片移植物修復大面積的骨缺損[2]。另外,單純的細胞膜片雖然可塑性強,但機械強度欠佳,常需與其他支架材料復合來提供機械支撐的作用[9]。
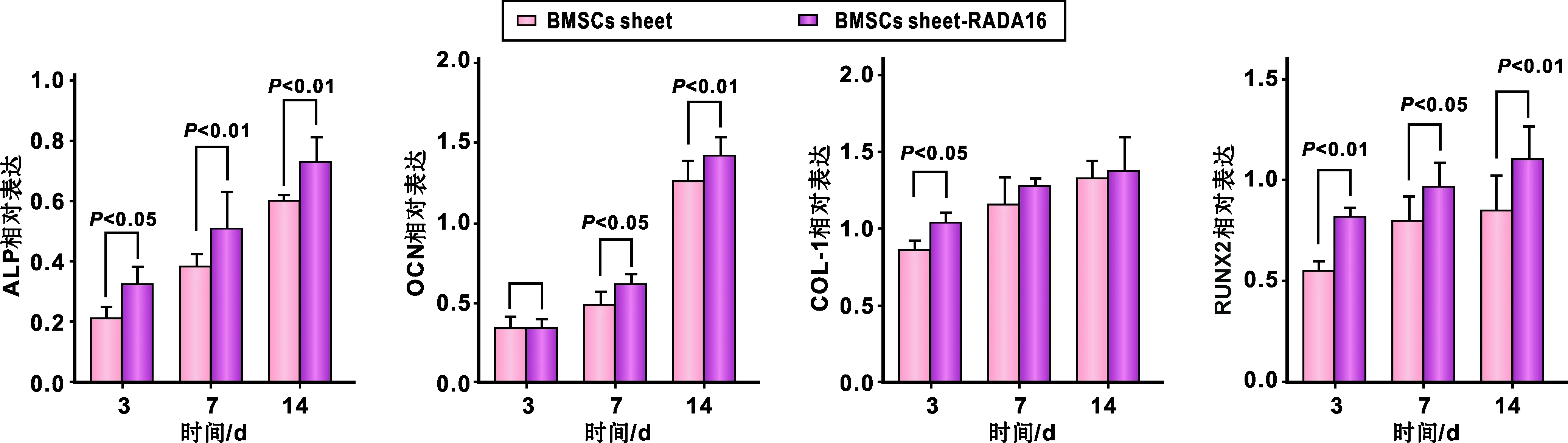
圖 7 ALP,OCN,COL-1,RUNX2成骨基因相對表達量(RT-PCR)Fig 7 The relative expression levels of ALP, OCN, COL-1 and RUNX2(RT-PCR)
隨著組織工程材料的發展,細胞與支架材料復合來修復骨缺損也得到廣泛應用。Villa等[10]將小鼠的 BMSCs 接種到膠原-羥基磷灰石支架材料上修復顱骨缺損,結果發現移植后3 周,可觀察到新骨形成。 有學者將細胞膜片與聚乳酸聚乙醇酸共聚物(PLGA)等支架用于組織工程中,取得了一定的效果[11-12]。但有研究表明[13], 當PLGA降解時會產生酸性環境, 移植區域產生的酸性 pH不僅會阻礙細胞向 PLGA 支架遷移,還會導致細胞活性的顯著降低。尋找合適的骨組織工程支架材料,將細胞膜片與支架材料結合用于再生醫學,找到可能更優的組織工程方法,是本實驗的出發點。
自組裝多肽納米纖維支架(Self-assembled peptides nanofiber scaffolds,SAPNS) 是一類具有三維網狀結構的新型生物支架,其結構、生物功能、機械力學等特性類似天然細胞外基質,并選擇性調控種子細胞生物學行為。生物大分子的基本特征之一是分子自組裝,通過自組裝形成水凝膠可以有效的模擬精細的生物和天然大分子物質,是真正意義上的仿生材料。RADA16 是兩親性多肽(amphiphilic peptides, PAs),在改變多肽溶液pH值或加入堿性陽離子的情況下,自組裝生成的一類具有三維網狀結構的新型生物支架[14]。
多肽內活性片段的含量約為5%,含水量超過99%,高含水量、大表面積、高孔隙率等特性使 SAPNS 以類似天然 ECM的形式包繞種子細胞,利于營養物質、活性分子及氧氣等彌散,且利于細胞黏附、增殖、遷移和分化[15-17]。本實驗中通過倒置相差顯微鏡、掃描電鏡和激光共聚焦顯微鏡等多層面觀察到細胞在支架材料上生長狀態良好;通過增殖實驗顯示BMSCs與RADA16凝膠支架結合初期細胞數量略低,這可能與環境改變和細胞適應有關,后期增殖速度增高并超過單純BMSCs膜片,這些均表明RADA16多肽納米纖維支架材料的生物相容性良好,對細胞毒性低。此外,研究表明[18],在成骨誘導液的培養條件下,RADA16多肽支架材料中骨髓間充質干細胞的鈣含量和骨鈣素含量隨著培養時間呈現上升趨勢,礦化的細胞外基質能夠遍布整個三維RADA16支架材料。該研究結果說明,RADA16可以作為骨髓間充質干細胞的載體材料用于骨組織工程研究。本實驗通過PCR技術對成骨相關的早期因子、晚期因子以及轉錄相關因子的檢測,顯示BMSCs膜片-RADA16中細胞的成骨能力比單純BMSCs膜片高,這可能是因為凝膠創造了細胞生長良好的微環境,有利于細胞間生物活性信息分子的交流和傳遞。
BMSCs膜片-RADA16復合體在一定程度上克服了單純BMSCs膜片操作性能差和機械性能不佳等問題;同時RADA16形成的水凝膠支架在體內最終降解為小分子多肽和氨基酸,有良好的生物相容性;RADA16比蛋白質有更加規整的氨基酸序列和多樣的氨基酸殘基種類,并可在其末端連接不同功能的多肽,作用在不同的靶細胞發揮特定的功能。關于BMSCs膜片-RADA16復合體的性能還需要更多的體內研究驗證。
4 結 論
自組裝多肽RADA16是一種良好的組織工程支架材料,新型的BMSCs膜片-RADA16復合體可能作為一種植入體用于組織工程中。

