TGFβ/Smad信號通路在口腔鱗癌熱療中的表達變化
周昊 劉奕 廖楚航 郭駿 費偉
熱療(Hyperthermia)作為一種新興的治療惡性腫瘤的方法,副作用較小且無累積。以往的臨床研究已經(jīng)證實熱療在惡性腫瘤晚期、復發(fā)性腫瘤和轉移性疾病的治療中都是有效的[1]。雖然熱療對惡性腫瘤的抑制作用已經(jīng)得到公認,但是其潛在的分子機制仍不清楚。
轉化生長因子β(Transforming growth factorβ,TGFβ)是一種多功能細胞因子,它可以通過抑制機體的抗腫瘤免疫應答,從而誘導腫瘤細胞的增殖、轉移以及腫瘤組織血管生長[2-3]。Smad蛋白是TGFβ主要的信號傳導分子,參與廣泛的生物學過程[4]。研究發(fā)現(xiàn),經(jīng)典的TGFβ/Smad信號系統(tǒng)在上皮源性的惡性腫瘤(包括OSCC)的發(fā)生和轉移中起著重要的作用[5-7]。而TGFβ/Smad信號系統(tǒng)與血管內(nèi)皮細胞生長因子(Vascular endothelial growth factor, VEGF)-A,促淋巴生成因子VEGF-D和VEGF-R3,促轉移因子uPAR和MMP都有著密切的關系,而這些因子的表達已經(jīng)被證實在熱療的過程中都發(fā)生了改變[8-11]。
本課題組前期研究已經(jīng)證實了熱療可抑制VEGF-C和-D在口腔鱗狀細胞癌(Oral squamous cell carcinoma,OSCC)中的表達[8]。同時,其他的一些基因如VEGF-A、尿激酶受體(Urokinase type plasminogen activator receptor,uPAR)、凝血酶敏感蛋白-1(Thrombospondin-1,TSP-1)以及基質金屬蛋白酶(Matrix metalloproteinase,MMP)的表達在熱療的過程中都會發(fā)生改變[9-11],這些結果均提示熱療可能通過改變一些腫瘤相關因子的表達來改變腫瘤生長和轉移的特性。但是,TGFβ/Smad信號系統(tǒng)是否在熱療誘導的抗腫瘤機制中起重要的作用還未見相關報道。
本研究擬從基因水平和蛋白水平檢測熱療對OSCC動物模型中TGFβ, Smad2, Smad3, Smad4和Smad7表達的影響,初步探尋TGFβ/Smad信號系統(tǒng)在熱療抗腫瘤過程中發(fā)揮的作用及其分子學機制。
1 材料與方法
1.1 實驗動物
BALB/C-nu/nu裸鼠,雌性, 4~5 周齡,體重15~20 g,飼養(yǎng)于無特異性病原菌,恒溫(20~26 ℃),恒濕(45%~50%)的空氣潔凈的層流架內(nèi)。
1.2 腫瘤模型建立
實驗所用口腔鱗狀細胞癌細胞株Tca8113購自四川大學口腔疾病研究國家重點實驗室;基本實驗步驟如下;細胞株從液氮冰存中復蘇,培養(yǎng)于RPMI培養(yǎng)液(15%滅活小牛血清,青霉素200 U/ml, 鏈霉素200 U/ml), 37 ℃, 5% CO2培養(yǎng)箱。收集對數(shù)生長期細胞,制備濃度為1×107/ml細胞懸液,皮下接種于裸鼠雙側臀部,每個部位接種約0.1 ml。待腫瘤體積達到100 mm3,隨機將裸鼠分為加熱組(HT組)和未加熱組(C組),每組10 只。
1.3 腫瘤加熱模型的建立
采用水浴加熱法給加熱組裸鼠局部腫瘤加熱。將荷瘤裸鼠予以戊巴比妥鈉鎮(zhèn)靜后,置于水浴箱內(nèi)加熱,腫瘤置于水面下至少1 cm,加熱條件: 42.5 ℃恒溫,加熱40 min[9]。使用小風扇降溫避免全身加熱,并保持室內(nèi)溫度恒定。共加熱5次(每次間隔7 d),最后1 次加熱7 d后處死裸鼠,同時處死未加熱組裸鼠,分離取出腫瘤組織,液氮保存,后轉存于-80 ℃冰箱,備用。
1.4 RT-PCR檢測
取保存的腫瘤組織磨碎后加入Trizol(50 mg組織加入1 ml)抽提RNA,并用RevertAidTM試劑盒(Thermo, USA)逆轉錄成 cDNA; 取逆轉錄產(chǎn)物進行實時熒光定量 RT-PCR(ABI Prism 7700,USA)。引物序列見表 1。
1.5 Western blot檢測

表 1 引物序列Tab 1 The sequences of the primers
使用蛋白提取試劑盒(KeyGEN, China)提取腫瘤組織蛋白,BCA蛋白檢測試劑盒(Pierce, USA)測定蛋白濃度。蛋白變性后,冷卻上樣,凝膠電泳半干法轉入PVDF膜后置于封閉緩沖液(搖床振蕩1 h),分別加入目標基因一抗(Cell Signaling technology, 1∶10 000, USA), 4 ℃過夜,TBS/T洗滌后孵育二抗,ECL顯影條帶并進行灰度分析(Bio-Rad, USA)。
2 結 果
2.1 目標基因mRNA的表達變化
RT-PCR結果顯示: 2 組樣本中均檢測到目標基因mRNA的表達。加熱組中TGFβ、Smad2、Smad3的mRNA表達比未加熱組明顯降低(P<0.05),Smad7的mRNA表達明顯升高(P<0.05),而Smad4的mRNA表達變化無明顯統(tǒng)計學意義(圖 1)。
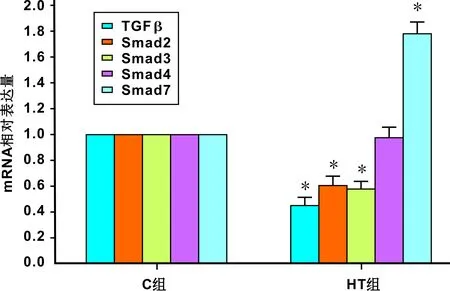
圖 1 TGFβ/Smad相關分子mRNA表達的變化(*: P<0.05)Fig 1 The mRNA levels of TGFβ/Smad relative factors (*: P<0.05)
2.2 目標基因蛋白表達的變化
Western blot結果顯示:兩組中均檢測到目標基因蛋白的表達。TGFβ、Smad7、Smad4蛋白的表達變化與mRNA表達變化一致,而Smad2和Smad3的表達無明顯變化,磷酸化的Smad2和Smad3(pSmad2和pSmad3)表達則明顯降低(P<0.05)(圖 2)。
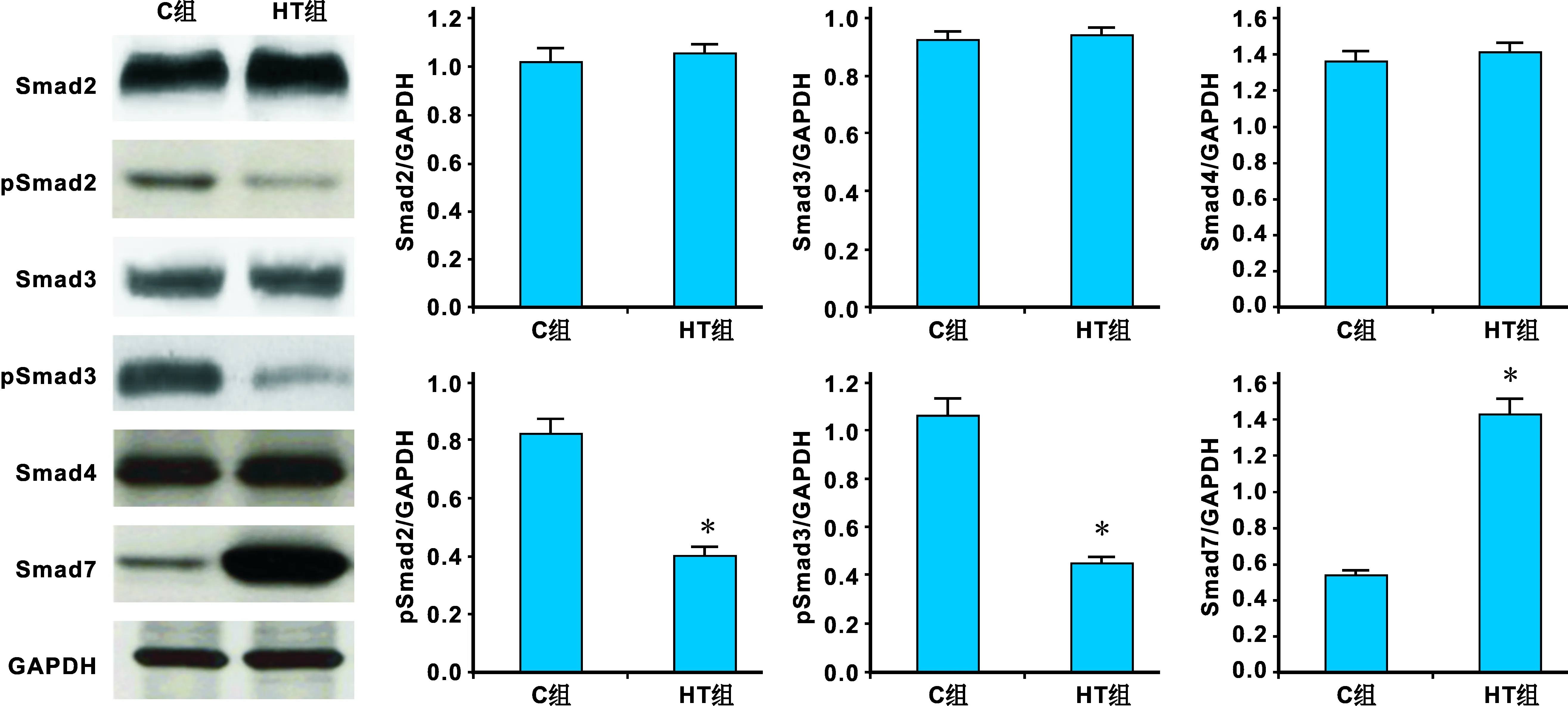
圖 2 TGFβ/Smad相關分子蛋白表達的變化(*: P<0.05)Fig 2 The protein levels of TGFβ/Smad relative factors (*: P<0.05)
3 討 論
TGFβ被認為是一種促腫瘤因子,它可以促進上皮細胞間質轉型(Epithelial-mesenchymal-transition, EMT),而EMT是上皮細胞來源的惡性腫瘤獲得侵襲和遷移能力的重要生物學過程[12],另外TGFβ還能夠通過自分泌和旁分泌機制,激活促轉移因子如VEGF、FGF、uPAR、MMP2/9 和 VEGFR3的表達,從而在惡性腫瘤的發(fā)生和轉移中發(fā)揮重要作用[13-15]。Smad蛋白是TGFβ唯一的直接轉錄因子,它作為TGFβ主要的細胞內(nèi)介導分子,參與了廣泛的生物學進程[9]。現(xiàn)有8 種Smad蛋白被發(fā)現(xiàn),TGFβ/Smad 信號通路包括R-Smad(Smad2和Smad3)、Co-Smad(Smad4)、I-Smad(Smad7)。研究證實,TGFβ/Smad信號系統(tǒng)在腫瘤的發(fā)生和轉移中扮演重要的角色[2,7,12]。
腫瘤細胞比正常細胞對于溫度更敏感,加熱可以使其內(nèi)皮細胞破裂,增加血管壁的粘附性以及血液的粘稠度, 繼而致血栓形成,最終導致腫瘤組織的破壞,熱療就是基于以上原理達到治療的作用[16-17],其分子學機理還不清楚。本課題前期研究結果發(fā)現(xiàn)熱療能夠抑制淋巴轉移因子VEGF-C和VEGF-D的表達[8]。本研究中檢測了熱療后OSCC動物模型中TGFβ/Smad信號系統(tǒng)相關因子的表達變化,初步探尋TGFβ/Smad信號系統(tǒng)在熱療對惡性腫瘤治療過程中所起的作用。結果顯示,對荷瘤裸鼠進行加熱后,腫瘤細胞中TGFβ、Smad2和Smad3的mRNA表達降低,Smad4的表達無明顯變化,而Smad7的表達明顯升高;蛋白的檢測結果略有不同,TGFβ、Smad4和Smad7的表達表達變化與mRNA表達一致,不同的是在加熱過后Smad2和Smad3的表達沒有變化,而 pSmad2和pSmad3的表達降低。在經(jīng)典的TGFβ/Smad信號傳導通路中,TGF-β首先激活II型受體(typeII TGF-β receptor, TβRII),隨后磷酸化I型跨膜受體(TβR I),活化的TβRII再磷酸化R-Smad(Smad2和Smad3),R-Smad的非活性發(fā)夾結構活化之后與Smad4結合形成復合物進入細胞核,通過直接或者間接與DNA結合,與不同轉錄因子相互作用從而調(diào)控各種生物學效應[4]。Xie等[18]對798例頭頸部鱗狀細胞癌樣本進行檢測,發(fā)現(xiàn)Smad蛋白活性未受損的患者5年生存率大概為45%,而缺失pSmad2和pSmad3表達的患者5 年生存率為90%。這說明了磷酸化的R-Smad對于TGFβ/Smad信號的促腫瘤效應至關重要。本研究發(fā)現(xiàn)加熱之后pSmad2和pSmad3的蛋白表達降低,而Smad7的表達明顯升高。Smad7作為抑制型Smad(I-Smad)在TGFβ/Smad信號通路中起著抑制R-Smad磷酸化的作用,它可以競爭性抑制磷酸化Smad2/3和與TβRⅠ形成穩(wěn)定的復合體,Smad7還能與Smad泛素調(diào)節(jié)因子(Smad ubiquitinregulatory factors, Smurfs)結合抑制R-Smad磷酸化,從而抑制TGFβ信號[19-21]。TGFβ/Smad信號系統(tǒng)在熱療過程中可能是通過上調(diào)Smad7的表達,從而抑制Smad2和Smad3的磷酸化而達到抑制TGFβ所介導的促腫瘤效應。
綜上所述,TGFβ/Smad信號系統(tǒng)在熱療所產(chǎn)生的抗腫瘤效應中扮演著特定的角色,而Smad7對R-Smad磷酸化的抑制作用可能起著某種關鍵作用。

