白藜蘆醇誘導小細胞肺癌H446細胞凋亡機制的研究
李王平 馬李杰 潘 蕾 金發(fā)光
白藜蘆醇是廣泛存在于自然界的一種多酚類化合物,具有很強的生物活性[1-4]。多項研究發(fā)現(xiàn),白藜蘆醇對多種惡性腫瘤細胞均有明顯的抑制作用,主要機制為抑制蛋白質-酪氨酸激酶的活性、抑制癌細胞增殖,誘導癌細胞分化、凋亡等[5-8]。小細胞肺癌惡性程度高,倍增時間短,轉移早而廣泛,雖然對化療、放療敏感,初治緩解率高,但極易發(fā)生繼發(fā)性耐藥,容易復發(fā),截止目前,小細胞肺癌的治療方法仍以放化療為主。小細胞肺癌的治療效果在過去的幾十年中沒有明顯改善,對于小細胞肺癌靶向治療及免疫治療的相關研究較為滯后[9-13]。雖然已有一些針對小細胞肺癌靶向治療的臨床實驗,但目前尚未有明確的療效報道,部分患者使用免疫調節(jié)劑,但療效欠佳[14-15]。本文擬探討白藜蘆醇對人小細胞肺癌H446細胞增殖的抑制作用及誘導H446細胞凋亡的作用及可能的機制,旨在為小細胞肺癌化療治療提供理論基礎。
材料和方法
一、實驗材料
人小細胞肺癌H446細胞由第四軍醫(yī)大學唐都醫(yī)院呼吸內科實驗室提供。FBS培養(yǎng)基、RPMI1640培養(yǎng)基、RPMI1640培養(yǎng)基購自美國Hyclone公司,MTT、白藜蘆醇購自Sigma 公司,DMSO 購自Invitrogen 公司,胎牛血清、胰蛋白酶購自Gibco公司,AV/PI染料購自碧云天生物技術公司,Annexin V-FITC細胞凋亡檢測試劑盒(BD)。主要儀器設備:細胞培養(yǎng)箱(美國熱電公司),光學顯微鏡、倒置拍攝顯微鏡(蔡司公司),低速離心機(湘儀),酶標檢測儀(賽默飛),流式細胞儀(BD),DHE熒光探針(碧云天生物技術公司),JC-10膜電位探針(ab112133)。
二、研究方法
1. 細胞培養(yǎng): 觀察細胞生長情況,進行傳代擴增。觀察細胞狀態(tài)良好,細胞生長密度80%~90%,可以進行傳代;將培養(yǎng)皿中原有培養(yǎng)液棄去,用PBS洗2次; 加入0.25%的胰酶消化細胞,在顯微鏡下觀察細胞消化情況,待細胞變圓后吸去胰酶; 加入完全培養(yǎng)基終止消化,將細胞吹打為單細胞懸液;將細胞按照一定比例進行分離,加入適量的完全培養(yǎng)液培養(yǎng),37 ℃,5% CO2培養(yǎng)箱中;每天觀察細胞狀態(tài),擴增到足夠的細胞量后開始實驗,一般2 d可傳一代。
2. MTT檢測
(1)白藜蘆醇的細胞毒性觀察及實驗濃度篩選: 將處于對數(shù)生長期時的細胞,以5×104cells/ml密度接種到96孔細胞培養(yǎng)板,每孔150 μl,每個濃度梯度3個復孔,37 ℃,5% CO2培養(yǎng);將白藜蘆醇分別用完全培養(yǎng)基稀釋至20 μg/ml,30 μg/ml,40 μg/ml,50 μg/ml,60 μg/ml,70 μg/ml,80 μg/ml,90 μg/ml,100 μg/ml,110 μg/ml和120 μg/ml按照實驗分組給藥處理,以CK、DMSO作為對照;培養(yǎng)24 h后在每孔加入15 μl的MTT,37 ℃,5% CO2培養(yǎng)箱內避光孵育3~4 h;棄上清,加入200 μl的DMSO,室溫搖床震蕩10 min;酶標儀492 nm波長測出同一時間點OD值,用測得的OD值進行細胞增殖影響的分析。
(2) 根據(jù)前期濃度篩選結果進一步觀察白藜蘆醇的細胞毒性作用特點: 將處于對數(shù)生長期時的細胞,以5×104cells/ml密度接種到96孔細胞培養(yǎng)板,每孔150 μl,每個濃度梯度3個復孔,37 ℃,5% CO2培養(yǎng);實驗分組1:將白藜蘆醇分別用完全培養(yǎng)基稀釋至20 μg/ml,30 μg/ml,40 μg/ml,給藥處理,設空白對照,孵育24 h;實驗分組2:將白藜蘆醇用完全培養(yǎng)基稀釋至30 μg/ml,給藥處理,分別培養(yǎng)12 h,24 h和48 h,設空白對照;每孔加入15 μl的MTT,37 ℃,5% CO2培養(yǎng)箱內避光孵育3~4 h;棄上清,加入200 μl的DMSO,室溫搖床震蕩10 min;酶標儀492 nm波長測出同一時間點OD值,用測得的OD值進行細胞增殖影響的分析。
3. 流式檢測細胞凋亡、細胞內ROS及線粒體膜電位: 取對數(shù)生長期細胞,以細胞密度為1×105個/ml接種于6孔板中,每孔3 ml,于37 ℃,5% CO2培養(yǎng)箱中培養(yǎng);實驗分組1:將白藜蘆醇分別用完全培養(yǎng)基稀釋至20 μg/ml,30 μg/ml,40 μg/ml,設空白對照,給藥處理24 h;實驗分組2:將白藜蘆醇用完全培養(yǎng)基稀釋至30 μg/ml,給藥處理,分別培養(yǎng)12 h,24 h和48 h,設空白對照;實驗分組:分別用不含EDTA的胰酶消化收集細胞后,以離心半徑8 cm,1 500 r/min離心5 min,然后收集細胞;用預冷的1×PBS(4 ℃)重懸細胞,以離心半徑8 cm,1 500 r/min離心5 min,洗滌細胞,然后加入300 μl的1×Binding Buffer懸浮細胞;加入5 μl的Annexin V-FITC并混勻,避光室溫孵育15 min。加入10 μl的PI染色,混勻細胞,繼續(xù)避光孵育10 min;用PBS重懸細胞,上流式細胞儀檢測。
4. 流式檢測ROS: 取對數(shù)生長期細胞,以細胞密度為1×105個/ml接種于6孔板中,每孔3 ml,于37 ℃,5% CO2培養(yǎng)箱中培養(yǎng);實驗分組1:將白藜蘆醇分別用完全培養(yǎng)基稀釋至20 μg/ml,30 μg/ml,40 μg/ml,設空白對照,給藥處理24 h;實驗分組2:將白藜蘆醇用完全培養(yǎng)基稀釋至30 μg/ml,給藥處理,分別培養(yǎng)3、6、12、24 h,設空白對照;分別用胰酶消化收集以上各實驗組細胞后,以離心半徑8 cm,1 500 r/min離心5 min;用PBS清洗細胞,加入DHE熒光染料,37 ℃下避光孵育30 min;PBS重懸細胞后上流式細胞儀進行ROS檢測。
5. 流式檢測線粒體膜電位: 取對數(shù)生長期細胞,以細胞密度為1×105個/ml接種于6孔板中,每孔3 ml,于37 ℃,5% CO2培養(yǎng)箱中培養(yǎng);實驗分組1:將白藜蘆醇分別用完全培養(yǎng)基稀釋至20 μg/ml,30 μg/ml,40 μg/ml,設空白對照,給藥處理24 h;實驗分組2:將白藜蘆醇用完全培養(yǎng)基稀釋至30 μg/ml,給藥處理。分別培養(yǎng)3、6、12、24 h,設空白對照;用胰酶消化收集以上各實驗組細胞后,以離心半徑8 cm,1 500 r/min離心5 min;用PBS清洗細胞,加入JC-10熒光染料,37 ℃避光孵育45 min;PBS重懸細胞后上流式細胞儀進行JC-10檢測。
三、統(tǒng)計學方法
結 果
一、白藜蘆醇對H446細胞的毒性觀察及MTT檢測結果
1. 白藜蘆醇作用于H446細胞后形態(tài)學變化: 白藜蘆醇給藥后,觀察發(fā)現(xiàn)不同濃度的白藜蘆醇可造成不同比例的細胞死亡,隨著藥物濃度增加,細胞死亡增多。細胞死亡后,出現(xiàn)細胞圓縮,失去原有形態(tài),細胞不貼壁。在光鏡下(100×)可以觀察到細胞變得不透亮,失去活性,隨著濃度增加,異常細胞明顯增多。而對照組細胞形態(tài)正常,表現(xiàn)為細胞形態(tài)展開,細胞透亮,細胞狀態(tài)良好,細胞活性高,見圖1。
2. MTT檢測不同濃度白藜蘆醇對H446細胞增殖的抑制作用: MTT檢測發(fā)現(xiàn),白藜蘆醇從30 μg/ml濃度開始,H446細胞增殖出現(xiàn)明顯抑制,40 μg/ml時細胞抑制率迅速上升,且隨著給藥濃度增加,其抑制率增加,到達一定濃度后其細胞抑制率不再上升,與對照組相比差異均有統(tǒng)計學意義,P<0.01,見圖2。
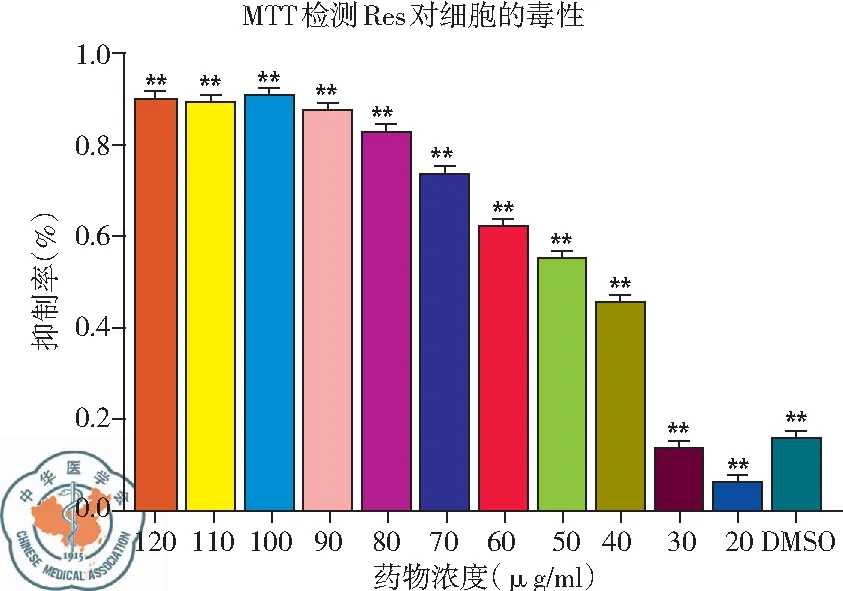
圖2 不同濃度白藜蘆醇對H446細胞的抑制率
3. 白藜蘆醇對H446細胞增殖抑制作用的特點觀察
(1)白藜蘆醇不同濃度下及作用不同時間后細胞形態(tài)變化:從形態(tài)學變化可以看出,隨著白藜蘆醇濃度增加和白藜蘆醇作用時間的延長,受損細胞數(shù)增多,受損程度變重,光鏡下可觀察到細胞形態(tài)不貼壁,圓縮,透亮度變低,異常細胞數(shù)目隨著作用濃度和作用時間的增加而增多,見圖3、4。
(2)MTT檢測白藜蘆醇不同濃度下及作用不同時間后對H446細胞增殖的抑制作用: 實驗結果表明,與CK相比較,Res在30 μg/ml時開始產生細胞抑制,40 μg/ml時其抑制率顯著上升,差異有統(tǒng)計學意義(P<0.01),說明Res的細胞毒性作用有濃度依賴的特點;而作用不同時間細胞抑制率結果顯示,隨著作用時間的延長,細胞抑制率增加,在作用24 h時產生明顯抑制,作用48 h時抑制率接近70 %,差異有統(tǒng)計學意義,P<0.01,說明Res的細胞抑制有時間依賴的特點,見圖5。

圖1 白藜蘆醇作用于H446細胞后的形態(tài)學變化(100×);注:A:100~120 μg/ml濃度,細胞完全死亡;B:70~90 μg/ml濃度,大部分細胞出現(xiàn)圓縮,失去原有形態(tài),細胞不貼壁;C:40~60 μg/ml濃度,50%以上細胞不透亮,失去活性;D:20~30 μg/ml大部分細胞狀態(tài)良好,CK組細胞形態(tài)展開,透亮,細胞狀態(tài)良好,活性高;E:DSMO組大部分細胞狀態(tài)良好
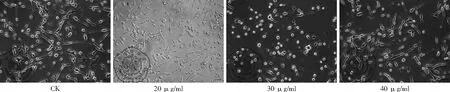
圖3 不同濃度白藜蘆醇作用時細胞形態(tài)變化(100×)

圖4 30 μg/ml白藜蘆醇作用不同時間后細胞形態(tài)變化(100×)
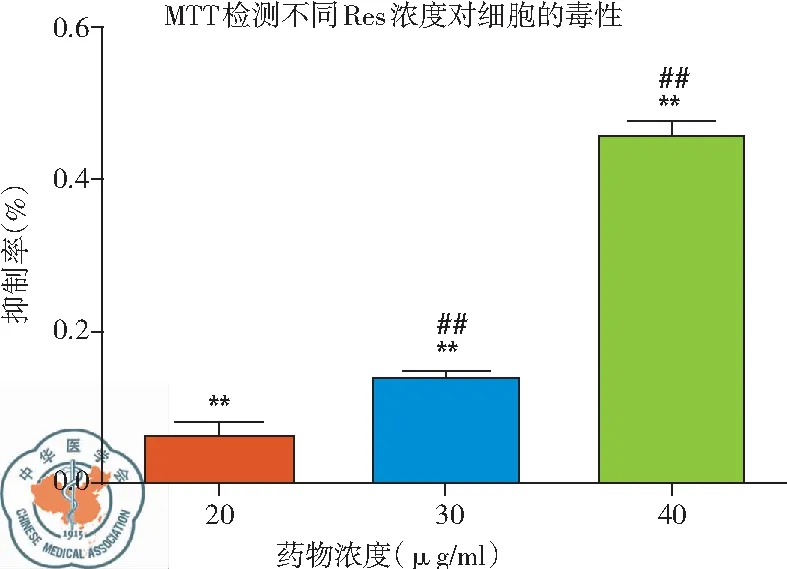
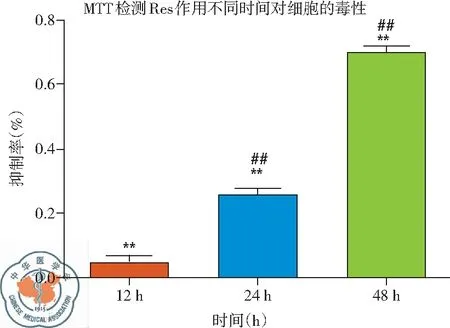
圖5 不同濃度白藜蘆醇及作用不同時間(30 μg/ml)細胞抑制率
二、流式檢測細胞凋亡
1. 不同濃度白藜蘆醇作用后H446細胞凋亡變化: 流式檢測結果顯示,與CK組相比,不同濃度白藜蘆醇誘導的細胞凋亡程度不同,隨著白藜蘆醇給藥濃度的增加,細胞凋亡數(shù)量顯著增加,在40 μg/ml時凋亡比例增加顯著,差異有統(tǒng)計學意義(P<0.01),見圖6、7。
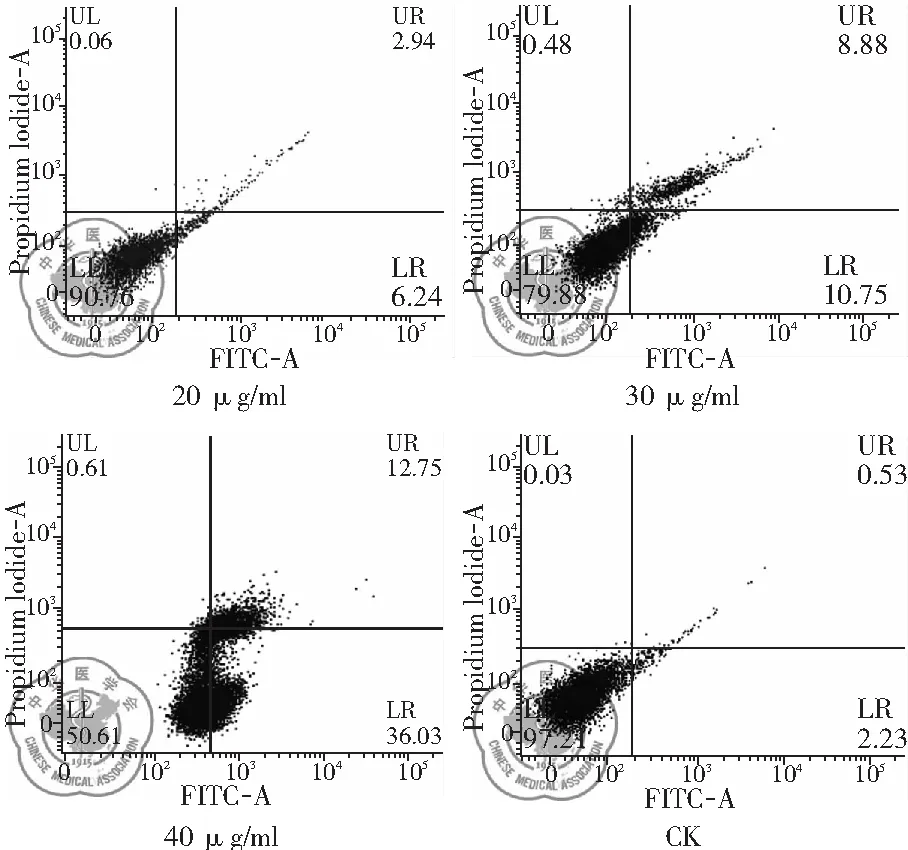
圖6 不同濃度白藜蘆醇流式檢測的細胞凋亡變化
圖7 不同濃度白藜蘆醇致H446細胞凋亡率
凋亡檢測結果說明白藜蘆醇誘導的細胞凋亡與濃度相關,具有濃度依賴性的特點。
2. 白藜蘆醇作用不同時間H446細胞凋亡變化: 流式檢測結果發(fā)現(xiàn),與CK組相比,給藥時間不同,導致的細胞凋亡程度不同。作用24 h后,細胞凋亡比例顯著上升,作用48 h后凋亡比例超過50%,說明隨著給藥時間的延長,細胞凋亡數(shù)量增多,凋亡率增加,Res的促細胞凋亡作用有時間依賴性特點,差異有統(tǒng)計學意義(P<0.01),見圖8、9。
三、流式細胞儀檢測ROS
1. 不同濃度白藜蘆醇作用后細胞內ROS釋放變化: 流式細胞儀熒光測量結果顯示,隨著白藜蘆醇濃度增加,細胞內ROS釋放增多。40 μg/ml 濃度時ROS釋放量顯著增多,說明ROS釋放有濃度依賴性,差異有統(tǒng)計學意義,(P<0.01),見圖10、11。

圖8 30 μg/ml白藜蘆醇作用不同時間流式檢測的細胞凋亡變化
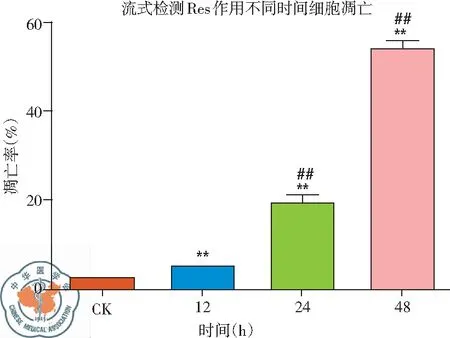
圖9 30 μg/ml 白藜蘆醇作用不同時間H446細胞凋亡率
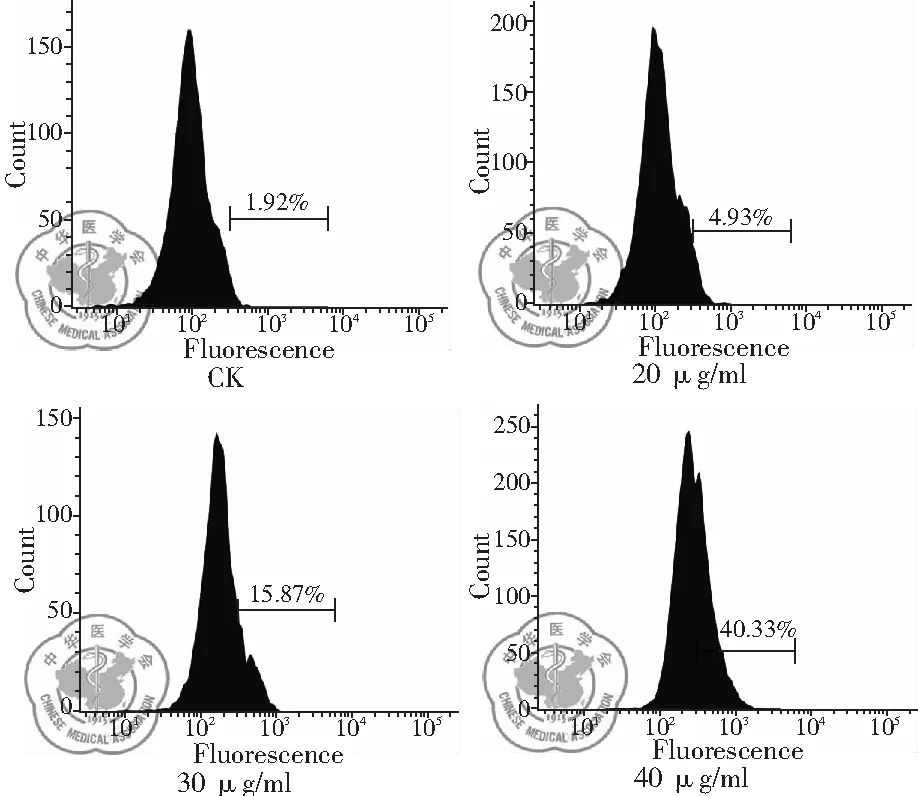
圖10 不同濃度白藜蘆醇給藥時細胞內ROS釋放情況
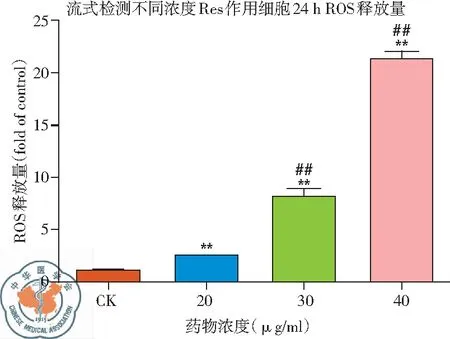
圖11 不同濃度白藜蘆醇給藥時細胞內ROS釋放量
2. 白藜蘆醇給藥不同時間細胞內ROS釋放變化: 由流式檢測結果可以看出,在Res給藥后細胞內ROS逐漸釋放,隨著白藜蘆醇給藥時間延長,細胞內ROS釋放量逐漸增多,細胞ROS釋放有時間依賴性,差異有統(tǒng)計學意義(P<0.01),見圖12、13。
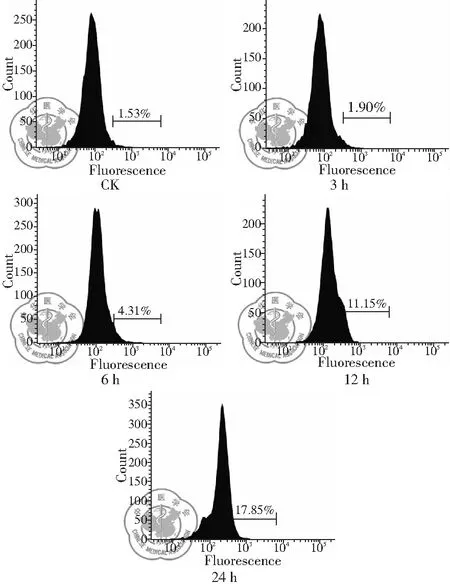
圖12 30 μg/ml 白藜蘆醇給藥不同時間細胞內ROS釋放情況
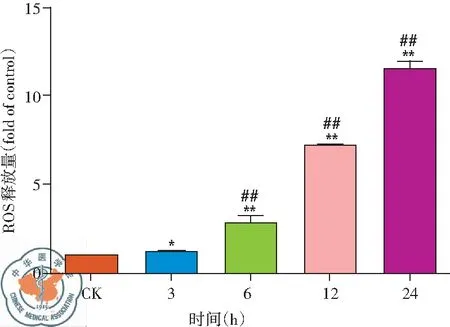
圖13 30 μg/ml白藜蘆醇給藥不同時間細胞內ROS釋放量
四、流式細胞儀檢測線粒體膜電位
1. 不同濃度白藜蘆醇給藥后線粒體膜電位變化: 流式細胞儀檢測結果顯示,與CK組相比,白藜蘆醇給藥濃度不同,線粒體膜電位的下降程度也不同,隨著濃度的增加,下降程度增加,白藜蘆醇濃度40 μg/ml 時線粒體膜電位下降最為顯著,有濃度依賴的特點。即隨著濃度的增加,線粒體膜電位下降增加,差異有統(tǒng)計學意義(P<0.01),見圖14、15。
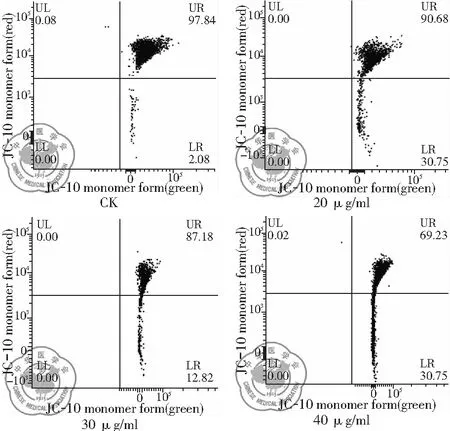
圖14 不同濃度白藜蘆醇給藥后線粒體膜電位變化
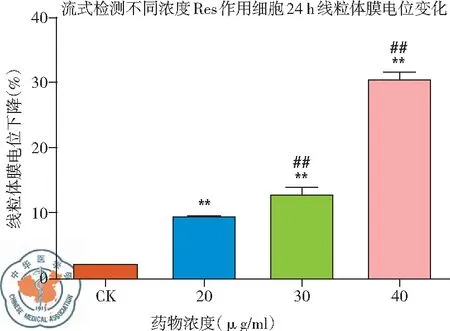
圖15 不同濃度白藜蘆醇給藥后線粒體膜電位下降率
2. 流式細胞儀檢測白藜蘆醇作用不同時間線粒體膜電位變化: 流式結果顯示,與CK組相比,隨著白藜蘆醇給藥時間的延長,線粒體膜電位下降更加明顯,給藥24 h下降最為明顯,呈現(xiàn)時間依賴性,差異有統(tǒng)計學意義(P<0.01),見圖16、17。
討論
白藜蘆醇是一種多酚類化合物,主要來源于花生 、葡萄(紅葡萄酒)、虎杖、桑椹等植物,具有很強的生物活性,近年來因其由于具有防癌及抗癌作用備受研究關注[16]。研究顯示白藜蘆醇對眾多的腫瘤具有體外細胞毒性效應,包括骨髓瘤、淋巴瘤、乳腺癌、皮膚癌、宮頸癌、卵巢癌、胃癌、前列癌、結腸癌、肝癌、胰腺癌、甲狀腺癌等[17-19]。研究表明白藜蘆醇的抗增殖活性與刺激癌細胞凋亡有關[20-23]。有人提出,細胞凋亡的激活可能是化療藥物破壞癌細胞的一種可能機制[24]。在很多人體腫瘤中,細胞凋亡受損,說明細胞凋亡功能的破壞是正常細胞轉化為腫瘤細胞的重要因素[25]。
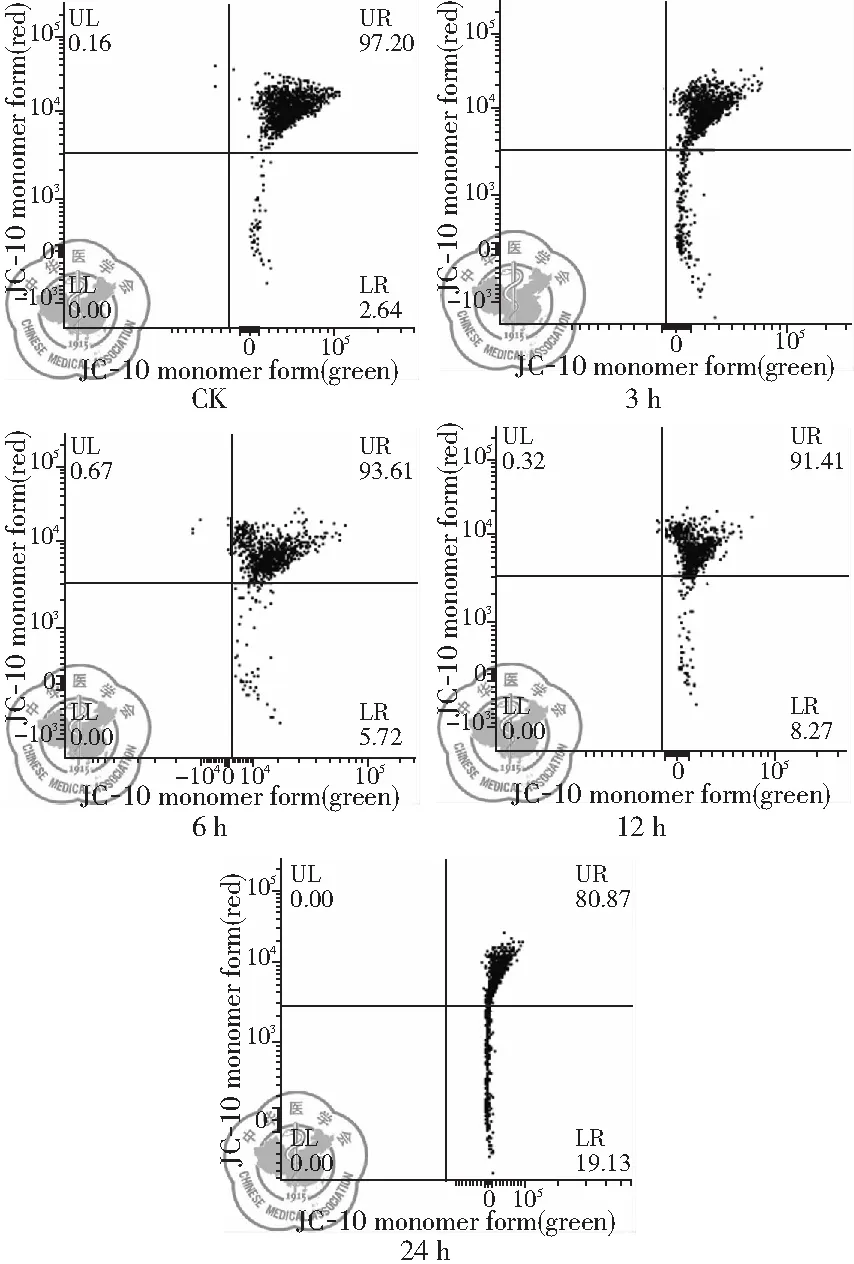
圖16 30 μg/ml 白藜蘆醇給藥不同時間線粒體膜電位變化
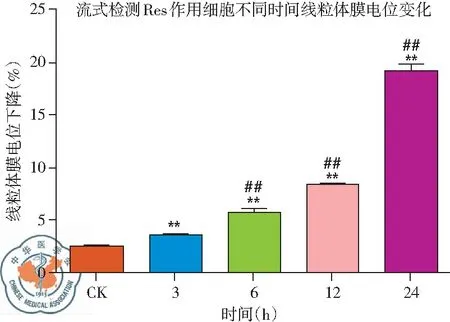
圖17 30 μg/ml 白藜蘆醇給藥不同時間線粒體膜電位下降率
本文先采用了濃度篩選的方法,即通過不同濃度的白藜蘆醇作用于H446細胞,觀察其毒性作用變化與藥物濃度之間的關系。細胞毒性研究結果提示,白藜蘆醇作用于H446細胞后,細胞形態(tài)學發(fā)生了明顯變化,而且不同的濃度造成的損傷程度不同,在細胞培養(yǎng)中出現(xiàn)了不同比例的細胞死亡。 根據(jù)濃度梯度觀察結果,選擇30 μg/ml白藜蘆醇進一步觀察其對H446細胞的毒性作用特點,觀察其毒性作用是否與作用時間有相關性。研究結果顯示,隨著白藜蘆醇作用時間的增加,受損細胞變多,受損程度變重。MTT檢測結果提示白藜蘆醇可對H446細胞增殖產生抑制,其抑制率隨濃度、時間而增加,抑制率增加的特點,表現(xiàn)為濃度和時間依賴,并與細胞形態(tài)學觀察結果相符。
線粒體是人體供能物質產生的最主要場所,ATP生成的任一過程受阻,氧化呼吸鏈電子功能傳遞障礙,都會導致細胞供能和組織代謝發(fā)生異常,導致機體發(fā)生異常[26]。腫瘤細胞由于其線粒體結構和功能異常,因此不能發(fā)揮正常的產能功能,其代謝會發(fā)生紊亂,繼而導致腫瘤的不斷發(fā)展[27-29]。細胞受到凋亡因素刺激后,線粒體的功能和結構都會發(fā)生異常,線粒體呼吸鏈氧化磷酸化脫偶,細胞內ROS生成增多,活性氧生成達到一定程度后可使線粒體腫脹,導致線粒體膜的通透性改變;ROS可促發(fā)和加速線粒體膜通透性轉運孔的異常開放,導致ROS生成進一步增多,形成正反饋,使線粒體膜電位下降加速至不可逆,發(fā)生細胞凋亡[30]。
本文對白藜蘆醇作用于H446細胞后,細胞凋亡、活性氧及線粒體膜電位3個指標進行了觀察,這些觀察指標與線粒體功能密切相關,并從不同濃度、不同時間來進行觀察。實驗結果表明,白藜蘆醇可誘導H446細胞凋亡,增加細胞內活性氧的生成,導致線粒體膜電位下降,且其作用具有時間依賴和濃度依賴的特點,差異有統(tǒng)計學意義,P<0.01。
細胞凋亡可導致線粒體功能障礙,可引起ROS生成增多,而ROS生成增多可使線粒體腫脹,線粒體腫脹后通透性增高,使得線粒體膜電位的電壓平衡不能維持,導致線粒體膜電位下降,線粒體結構破壞,功能發(fā)生異常,線粒體功能發(fā)生異常后,又可誘導細胞凋亡,因此,以上因素相互作用、相互影響,形成因果循環(huán)。本文結果顯示白藜蘆醇對H446細胞的抑制與線粒體功能障礙密切相關。這一途徑在Luo 等[31]研究中亦得到證實,該研究結果認為白藜蘆醇可通過ROS介導的DNA損傷誘導肺癌細胞早衰。另一項關于白藜蘆醇誘導人肺腺癌細胞A549的研究結論,亦認為白藜蘆醇的促細胞凋亡功能與線粒體功能障礙相關[32]。
綜述所述,白藜蘆醇對H446細胞增殖具有明顯的抑制作用,可誘導H446細胞凋亡,細胞內ROS釋放增多,并進一步導致線粒體膜電位下降,其作用效果具有濃度依賴和時間依賴的特點。白藜蘆醇可通過線粒體功能障礙途徑誘導H446細胞凋亡。

