納米氧化鋁負載釩催化劑在CO2氣氛下的乙苯脫氫性能研究
朱 忖 ,檀東辰 ,汪全華 ,陳樹偉 *,潘大海 ,崔杏雨 ,喬 巖 ,李瑞豐 *
(1.太原理工大學化學與化工學院,山西 太原 030024;2.中國科學院煤炭化學研究所煤炭轉化國家重點實驗室,山西 太原 030001)
苯乙烯(ST)在石油化工和高分子材料的生產領域中扮演著十分重要的角色。近年來,隨著我國經濟的快速發展,苯乙烯需求保持著持續增長的趨勢。目前,絕大部分的苯乙烯,通過乙苯(EB)催化脫氫制得[1],工業上為利用含鉀Fe系催化劑,在600~700℃的高溫條件下進行,此過程為強吸熱可逆反應且受熱力學平衡限制。為了實現大規模的連續化生產,工業上通常通入大量過熱水蒸氣供熱、稀釋平衡體系、緩解結焦以及防止催化劑的過度還原[2,3]。由于水的比熱容和氣化焓較大,水蒸氣的使用會產生較高生產成本[4]。另外,后續氣液分離過程中水蒸氣液化又釋放出大量熱量,并且這部分熱量很難得以回收[5]。同時,水蒸氣氣氛還促進了副反應的進行[6]。在世界能源、環境問題備受關注的今天,節約能源,保護環境是我們發展的前提,因此現行的苯乙烯生產工藝急需改進。
化石燃料的燃燒過程產生大量CO2,排放后污染環境,引起溫室效應,威脅到人類的生存環境[7]。而這些CO2是寶貴的碳資源,CO2的捕集、存儲、循環利用或以CO2為原料合成有價值的化合物的研究非常值得關注。近年來以CO2作為氧化劑的反應,引起了眾多研究者的重視,如氧化低碳烷烴制烯烴[8];氧化乙苯脫氫制苯乙烯[9-12]等。利用CO2溫和的氧化性,烷烴與CO2反應生成烯烴和CO,有效地抑制反應過程中,中間產物的深度氧化,從而得到更高的烯烴收率[13],并且CO2+C→2CO消除表面積炭,提高了催化劑的穩定性[14]。
目前,CO2氧化乙苯脫氫工藝中,研究較多的為Fe系和V系催化劑,收到一定的效果,但尚未達到工業化要求。一些研究人員提出改善催化劑載體,對催化性能有很大的影響[15,16]。近年來,納米氧化鋁由于其良好的化學特性和熱穩定性,在工業催化和商業應用中作用突出,因此也成為研究的熱點。
本文以纖維狀納米氧化鋁作為載體,制備了負載型釩基催化劑,對其在CO2氣氛下氧化乙苯脫氫制苯乙烯的性能進行了研究,通過多種表征手段闡釋了纖維狀納米氧化鋁載體優于商業γ-Al2O3載體的原因,探討了催化劑的失活機制。纖維狀納米氧化鋁具有高比表面,使得釩物種在其表面高度的分散,暴露出更多的活性位從而提高了催化性能。
1 實驗部分
1.1 催化劑載體的制備
以仲丁醇鋁為鋁源,通過溶膠-凝膠的方法制備纖維狀納米氧化鋁(記為Al-n)。根據文獻中報道[17]具體的合成步驟如下:稱取5.1g仲丁醇鋁在60℃下溶于3mL的無水乙醇中,不斷攪拌,回流直至完全溶解,然后緩慢滴加5.3mL的蒸餾水,2h后反應完全,將反應后的產物放置70℃烘箱中干燥24h,最后在550℃下焙燒6h,從而得到所需載體。
1.2 催化劑的制備
催化劑的制備采用簡便的等體積浸漬法,將所得Al-n載體浸漬在一定體積、質量比為1:2的偏釩酸銨:草酸溶液中,室溫靜置24h,于120℃恒溫烘箱中放置12h,取出樣品研磨,550℃下焙燒6h。制得不同負載量的釩基納米氧化鋁催化劑,記為x V/Al-n,其中的x代表x mmol/g,即負載在每克纖維狀納米氧化鋁載體的釩原子的量平均為x毫摩爾。同時,作為對照,本文采用相同的方法制備了負載量為0.8mmol/g,常規氧化鋁(記為Al-g)負載釩催化劑,記為0.8V/Al-g。
1.3 催化劑的性能測試
催化劑的性能評價,使用的是自制的微型固定床反應器 (φ=6mm),單次反應催化劑用量為300mg。反應在常壓下進行,反應前先在N2氣氛下由室溫升溫至550℃活化,隨后通入CO2,穩定15min后,使用2ZB-1L10雙柱塞微量泵通入乙苯,乙苯與CO2(N2)的進料物質的量比為20:1,乙苯的通入量為0.3mL/h。采用北京東西分析儀器有限公司(East-west,Peking,China)生產的裝有 OV-1701型色譜柱、氫火焰離子檢測器(FID)氣相色譜儀對液相試樣進行檢測。主反應為EB+CO2→ST+CO+H2O,其液態物質主要為苯乙烯、未反應的乙苯以及少量副產物C6H6和C6H5-CH3。
1.4 催化劑的表征
采用日本島津公司生產的Shimadzu 6100型X射線衍射儀(XRD),對載體以及催化劑粉末進行晶相分析,測試采用自動旋轉 Cu-Kα射線 (λ=0.15418nm)為入射光源,Ni濾波,石墨單色器,管電壓 40kV,管電流 30mA。 掃描范圍為 2θ=10~70°,速度 8°/min。
采用日本JEOL公司生產的JEM-2011型透射電鏡,觀察樣品的微觀結構,工作電壓為200kV。首先需要將樣品用超聲波分散在一定量的無水乙醇溶液中,用滴管將懸浮物均勻的分散在鍍有碳膜的銅網上。
采用美國康塔公司 (Quantachrome)生產的Quadra Win型物理吸附儀,對載體以及催化劑的織構特性進行分析。首先將樣品在300℃下真空活化3h,然后以N2作為吸附質,在液氮溫度77k下進行測定。樣品的比表面積按照BET公式進行計算,孔分布由等溫吸附線的BJH模型得到,總孔體積Vp由相對壓力為0.99時的最大氮氣吸附量得到。
使用天津先權公司(Xi-quan,Tianjin,China)生產的TP-5076型動態吸附儀測定催化劑的氧化還原能力,精準稱量100mg樣品置于U型管中,通入高純氦氣在300℃下活化1h后,先將樣品冷卻至室溫,以30mL/min的速度通入體積分數為10%的氫氣和氬氣的混合物,以10℃/min的速度程序升溫至850℃進行還原,用熱導檢測器檢測H2消耗量。
采用德國NETZSCH公司生產的STA449F3型TG/DTG同步熱分析儀,分析催化劑的積炭情況,采用10℃/min的升溫步長將樣品在空氣氣氛下,程序升溫至800℃。
2 結果與討論
2.1 纖維狀納米氧化鋁載體的形貌
圖1為550℃焙燒后,纖維狀納米氧化鋁的TEM圖,從圖可以看出,以仲丁醇鋁為鋁源,采用溶膠-凝膠的方法可以制得分散性較好網狀纖維結構的納米氧化鋁,直徑大約在5~15nm,長度大約在70~100nm。 圖 2a顯示,在 2θ=45°和 67°出現了較寬的特征衍射峰,說明載體在550℃焙燒之后出現了很弱的γ-Al2O3的結晶相。圖2b為Al-n載體的N2吸附脫附等溫線、孔徑分布以及具體織構參數。Al-n的N2吸附-脫附等溫線屬于Ⅳ型吸附等溫線,在相對壓力較低(p/p0<0.5)的情況下首先發生單分子層吸附,之后為多分子層吸附,當相對壓力在 (0.5~0.9)之間時,出生毛細管凝聚現象,吸附等溫線急速上升,并且由于吸附-脫附的不完全同步產生H1型滯后環。滯后環呈規整的平行四邊形,表明材料擁有典型的圓柱形介孔結構;滯后環的陡峭代表孔徑分布十分規整。具體數據顯示,Al-n擁有較大的最可幾孔徑7.3nm,較高比表面291m2/g,較大的孔容0.53m3/g。此方法操作簡單,反應時間短,為纖維狀納米氧化鋁的制備提供了新的方法和思路。

圖1 550℃焙燒后纖維狀納米氧化鋁的TEM圖
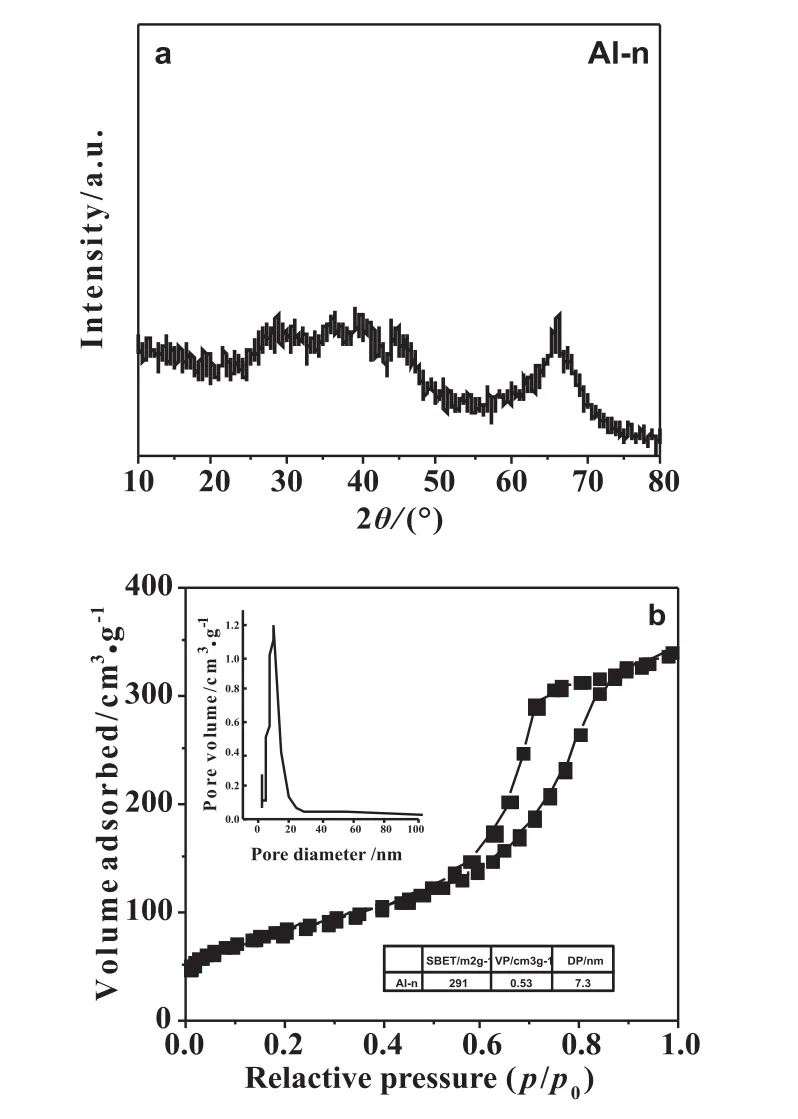
圖2 纖維狀納米氧化鋁載體的XRD譜圖(a)和N2吸附脫附等溫線以及相應的孔徑分布圖(b)
2.2 負載量對催化性能的影響
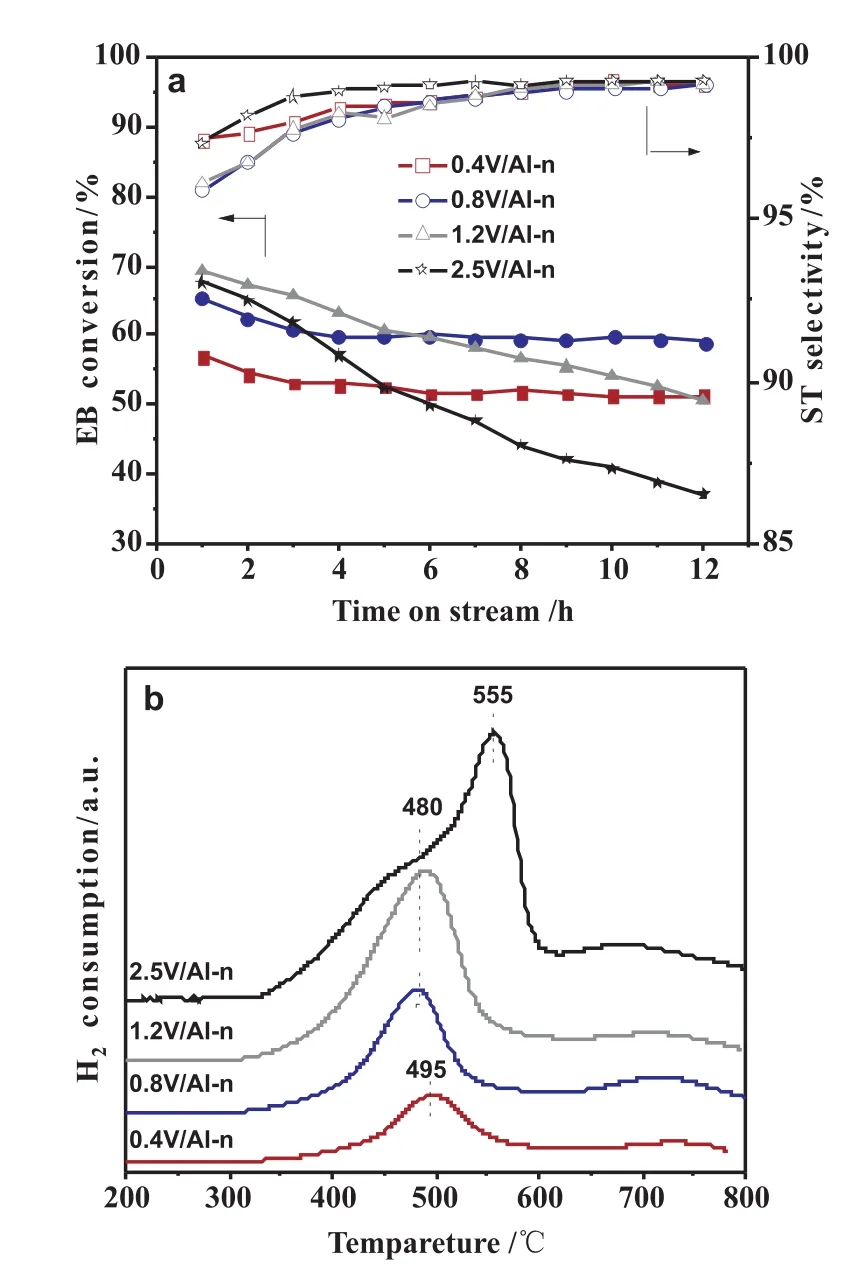
圖3 不同負載量VOx/Al-n催化劑的催化性能(a)和H2-TPR 圖(b)
圖3a為不同釩負載量催化劑在CO2氣氛下的乙苯轉化率和苯乙烯選擇性。從圖可以看出,對于不同釩負載量催化劑,苯乙烯選擇性變化趨勢一致,緩慢增加然后穩定在較高值(≥95%);乙苯轉化率的情況則不同,乙苯的初始轉化率隨著釩負載量的增加呈現先增加后減小的趨勢,1.2V/Al-n表現出最高乙苯初始轉化率為72.67%,但是催化劑失活較快。低負載量0.4V/Al-n催化劑具有最好的穩定性能,隨著反應的進行,一直保持著較高的乙苯轉化率(約51%)。進一步增加釩含量到0.8mmol/g時,轉化率明顯提高,穩定性能也較好,乙苯初始轉化率和苯乙烯選擇性分別達到65.16%和95.91%,在反應12h之后,乙苯轉化率仍為59.05%。繼續增加釩負載量,乙苯初始轉化率有所增加,但穩定性能大幅度下降。
圖3b為不同釩負載量催化劑的H2-TPR曲線,可以看出負載量低于1.2mmol/g時,只有一個還原峰在485~490℃之間并隨釩負載量增加向低溫移動,這個還原峰歸屬于高度分散的釩物種。當負載量增加至2.5mmol/g時,480℃處的峰削弱,555℃處增加的還原峰成為主峰,這個峰歸屬于V2O5晶體。圖4為催化劑反應前后的XRD譜圖,當負載量<1.2mmol/g時,沒有出現V2O5的特征衍射峰,說明釩在載體表面高度分散或以低聚態的形式存在;當負載量≥1.2mmol/g時,開始出現V2O5晶體特征衍射峰,并且隨著釩負載量的增加衍射峰強度增強,反應后XRD圖中出現V2O3的衍射峰,這說明高負載量催化劑反應過程中發生了深度還原。結合催化數據,這可能是導致催化劑快速失活的原因之一。
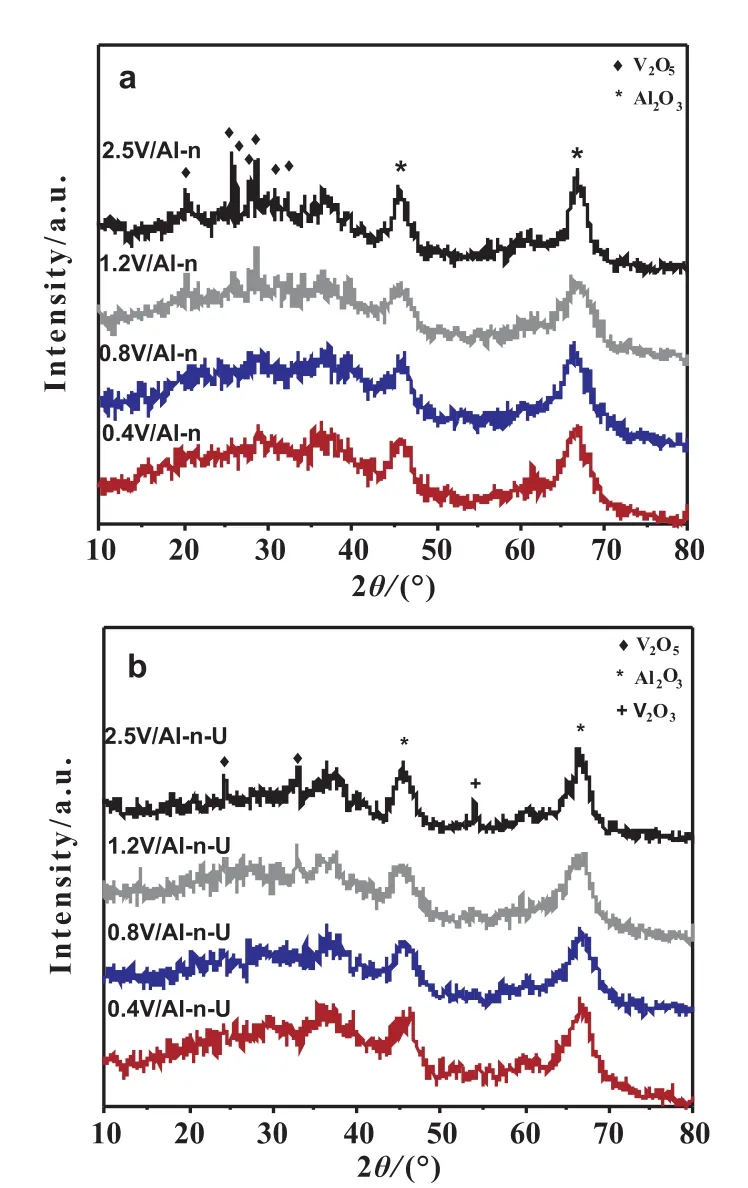
圖4 不同負載量VOx/Al-n催化劑的XRD圖(a)和反應后XRD 圖(b)
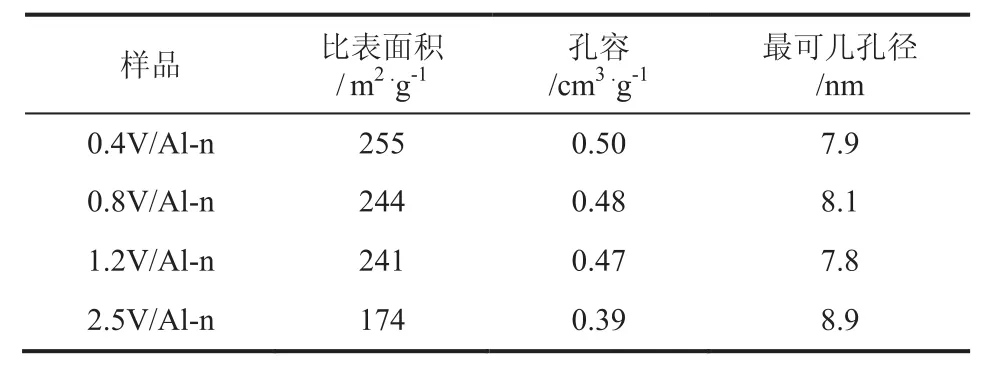
表1 不同負載量VOx/Al-n催化劑的物理化學參數
由表1得知,催化劑的比表面積和孔容隨著釩負載量的增加而減小,負載量<1.2mmol/g時,比表面積緩慢減小;負載量≥1.2mmol/g,比表面積降低幅度增大。當負載量<1.2mmol/g時,釩物種主要呈低聚物均勻的分散在載體表面,比表面積隨釩負載量的增加緩慢下降;當負載量≥1.2mmol/g時,釩物種主要以高聚物或多層釩物種的形式存在,從而比表面積隨釩負載量的增加而急劇降低,這種解釋也與XRD圖結果相一致。
圖5為不同釩負載量催化劑反應12h后積炭量與失活程度關系圖,其中失活程度Loss degree%=Conv1-Conv12/Conv1×100%。當釩負載量<1.2mmol/g時,積炭量隨釩負載量的增加而增加且失活程度增大,造成催化活性降低的直接原因是積炭量的增加;當釩負載量≥1.2mmol/g時,積炭量逐漸降低而失活程度繼續增大,結合H2-TPR以及XRD分析,造成催化劑穩定性急劇降低的原因是釩物種的深度還原(弱氧化劑CO2不能將V3+氧化成V5+)。綜上所述,催化劑失活的主要原因包含:積炭和釩物種深度還原,兩者的主次與釩負載量相關。除此以外,還可以發現積炭量和乙苯轉化率之間有一定的聯系,積炭量隨乙苯轉化率的高低而增減。這是因為產物苯乙烯在形成之后會從催化劑表面脫附下來,或者繼續深度脫氫、聚合形成積炭。脫附下來的苯乙烯極易形成聚苯乙烯,而聚苯乙烯是積炭形成的一種重要前驅體。
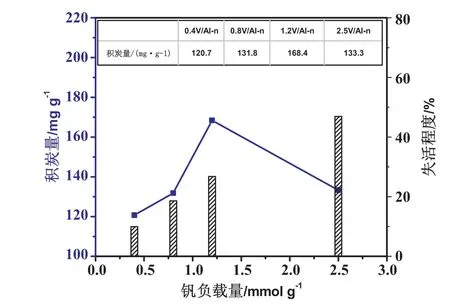
圖5 不同負載量VOx/Al-n催化劑的失活速率與積炭量
2.3 載體對催化性能的影響
圖6a對比了0.8V/Al-n和0.8V/Al-g催化劑乙苯轉化率和苯乙烯選擇性,發現雖然0.8V/Al-g的初始活性高于0.8V/Al-n,但失活迅速。0.8V/Al-n催化劑的乙苯選擇性略低于0.8V/Al-g,但12h后兩者已經變得非常接近。圖6b為0.8V/Al-n和0.8V/Al-g催化劑的H2-TPR,可以發現0.8V/Al-n(480℃)催化劑的還原峰明顯低于0.8V/Al-g(510℃)。圖6c為0.8V/Al-g和0.8V/Al-n催化劑的氮吸附等溫線以及孔徑分布圖,兩催化劑的等溫線都屬于Ⅳ型吸附等溫線。兩者卻擁有不同形狀的滯后環,0.8V/Al-n催化劑滯后環屬于H1型,0.8V/Al-g催化劑的滯后環屬于H4型,分別代表著圓柱形孔和裂縫孔的存在。
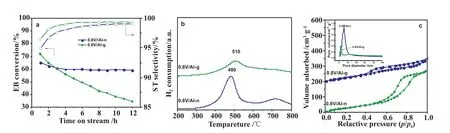
圖6 0.8V/Al-n和0.8V/Al-g催化劑的催化性能(a)、H2-TPR(b)、氮氣吸附脫附等溫線以及孔徑分布圖(c)
表2具體織構參數表明,0.8V/Al-n催化劑的比表面積、最可幾孔徑、孔容明顯大于0.8V/Al-g催化劑,有效的提升了催化劑活性位點的可接近性。0.8V/Al-n催化劑雖然有較大的炭量,但積炭形成速率較緩慢,從而提升催化劑的穩定性。
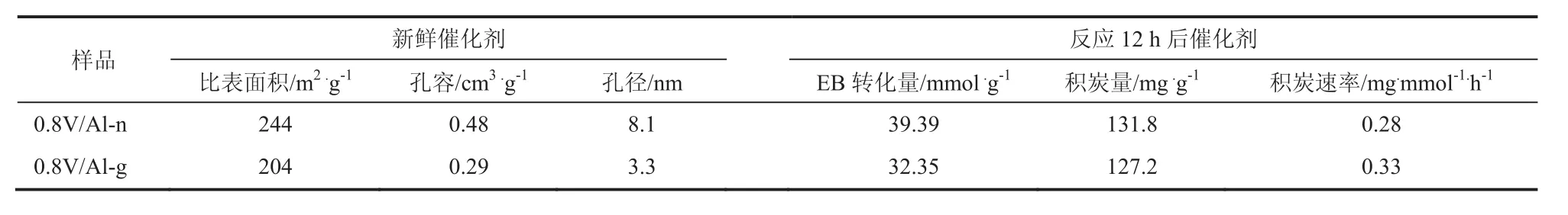
表2 催化劑的織構特性以及積炭情況
3 結論
通過溶膠-凝膠的方法制備的纖維狀納米氧化鋁具有較大的比表面積、孔容、最可幾孔徑,用它作為載體來進行在CO2氣氛下乙苯氧化脫氫制苯乙烯催化反應,從催化結果得出:0.8V/Al-n催化劑表現出較高的乙苯單程轉化率、選擇性以及穩定性,催化性能明顯優于0.8V/Al-g。通過對催化劑失活機制的探究得出催化劑的積炭和釩物種的深度還原協同導致催化劑性能降低。

