不同類型心力衰竭合并心房顫動的臨床特點及心臟結構變化
嚴毓勤,朱雅琴,周龍女,朱健,王海云
(上海交通大學醫學院附屬第九人民醫院,a 心內科,b 急診科,上海 200011)
心力衰竭是多種心血管疾病的嚴重和終末階段,隨著我國人口老齡化的趨勢,心力衰竭患病率處于持續上升階段。心力衰竭和心房顫動互為因果,心力衰竭患者容易出現房顫,促進房顫的發生發展和維持,房顫促進心衰進一步惡化,就會導致心臟功能逐漸下降。本研究分析心衰合并房顫的發病情況及臨床特點,識別心衰并發房顫的危險因素。
1 資料與方法
1.1 一般資料 收集2017年9月至2018年9月期間上海交通大學醫學院附屬第九人民醫院心內科和急診科收治的慢性心力衰竭患者401例,其中男性177例,女性224例;年齡范圍41~94歲,年齡(77.96±9.03)歲;中青年24例(6.0%),老年377例(94.0%);60~74歲老年人71例,75~89歲老年人285例;90歲及以上21例;房顫患者130例,非房顫患者271例。房顫與非房顫組的年齡性別差異無統計學意義,房顫組紐約心臟協會(NYHA)分級Ⅳ明顯多于非房顫組。
1.2 診斷及分組 所有入選的慢性心力衰竭患者均按照Framingham心力衰竭診斷標準:主要標準包括頸靜脈怒張,夜間陣發性呼吸困難甚至端坐呼吸,勞力性呼吸困難;急性肺水腫,肺部聽診聞及啰音,胸腔積液;心臟擴大,第三心音聞及奔馬律;頸靜脈怒張,肝臟腫大,踝部水腫;次要標準包括夜間咳嗽,心動過速(≥120 次/分),使用利尿劑等治療后水腫消退或體重減輕4.5 kg。同時具備任意2個主要標準或1個主要標準加2個次要標準,即可診斷。根據NYHA制定的診斷標準,將患者分為NYHA Ⅱ級組,NYHA Ⅲ級組,NYHA Ⅳ級組。用M型心臟超聲檢查評估患者心臟結構改變,左心房內徑(LA)、舒張期后壁厚度(PWT)、舒張期末室間隔厚度(IVST)、左心室舒張末內徑(LVEDD)作為心臟結構指標,以左室射血分數(LVEF)作為心臟收縮功能指標。根據心房顫動的診斷標準將患者分為心房顫動組和非心房顫動組。
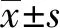
2 結果
2.1 不同病因和不同類型的慢性心力衰竭發生房顫的比例 幾乎所有的心血管疾病最終都會導致心力衰竭的發生,冠心病、心肌梗死、心肌病、高血壓、心臟瓣膜病、心律失常、心肌炎等任何原因引起的心肌損傷,均可造成心肌結構和功能的變化,最后導致心力衰竭的發生。表1列出了心衰的病因分布,其中高血壓和冠心病占主要原因,而高血壓引起房顫的發病率遠高于其他病因。表2比較了不同類型心衰和不同合并癥心衰發生房顫的比例。其中,舒張性心衰明顯比收縮性心衰更容易發生房顫(χ2=3.948,P<0.05),而急性心衰與慢性心衰發生房顫的比例差異無統計學意義;心衰的合并癥的個數與房顫無關,合并糖尿病、腎功能不全不會增加房顫的發生率,而心衰合并高血壓更容易并發房顫。

表1 兩組患者心力衰竭的病因分布[例(%)]
注:兩組病因總計數比較,χ2=38.704,P<0.001

表2 兩組患者心力衰竭合并房顫和非房顫的臨床特點比較[例(%)]
2.2 心力衰竭合并房顫與非房顫患者的心臟結構比較 根據超聲心動圖診斷標準,對比心衰房顫組和非房顫組的心臟結構改變,統計結果顯示,房顫組左心房內徑明顯增大(P<0.01),兩組患者的左心室內徑、左室射血分數、左室厚度方面差異無統計學意義。見表3。
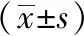
表3 房顫與非房顫心力衰竭患者超聲心動圖參數比較
注:LA為左心房內徑;PWT為舒張期后壁厚度;IVST為舒張期末室間隔厚度;LVEDD為左心室舒張末內徑;LVEF為左室射血分數;下表同
2.3 心力衰竭合并房顫單因素和多因素logistic回歸分析 以是否發生心房顫動為因變量,以高血壓、冠心病、腎功能不全、糖尿病、左室肥厚、左房內徑、左室內徑、射血分數為自變量進行單因素和多因素logistic回歸分析。統計結果顯示左房內徑為心衰合并房顫的危險因素(P<0.01),見表4。

表4 心力衰竭合并房顫單因素和多因素logistic回歸分析
3 討論
心力衰竭是一種復雜的臨床綜合征,其發病率高,死亡率高,嚴重威脅人類健康和生命安危。心力衰竭與心房顫動有共同的危險因素,二者相互促進、互為因果。心衰會促進房顫的發生發展,與心衰患者心臟結構功能改變導致心肌變性、心肌重構及兒茶酚胺增加導致心肌電活動不穩定有關[1]。本研究發現合并心房顫動的心衰患者心功能IV級的比例明顯高于非房顫患者。
心力衰竭的病因有很多,本研究發現高血壓和冠心病占主要原因,而合并高血壓更容易發生房顫。高血壓導致的心房基質異常在不同的動物模型中已經證實,包括心房纖維化、傳導減慢、傳導異質性增加、連接蛋白43表達減少等,表明高血壓可能早期誘發和進行性導致左房結構和功能變化,進而引起各種電生理變化導致房顫的發生[2-3]。
應用超聲心動圖射血分數指標來評估心力衰竭,根據射血分數保留和射血分數下降將心力衰竭分為舒張性心力衰竭和收縮性心力衰竭。舒張性心衰發病率和死亡率較高,臨床常易漏診和誤診,失去最佳治療時機。本研究中,有一半以上心衰患者LVEF>50%,且舒張性心衰發生房顫的比例明顯高于收縮性心衰。這與國內外研究結果相一致,即房顫在收縮功能正常的心衰患者中更為普遍,舒張功能不全可能為主要病因[4-5]。另有研究表明,房顫是心力衰竭包括舒張性心力衰竭死亡增加的獨立預測因子[6]。房顫與舒張功能不全存在共同的病理機制,包括超微結構、電生理特性以及神經內分泌等,這些作用互相促進,形成惡性循環。
目前有關房顫與左房內徑的相關性,國內外已有大量研究證實:黃學斌等研究學者[7]發現左心房內徑為心房顫動復發的預測因子,左心房內徑每增加5 mm,發生房顫的相對危險度增加1.74。心房重構是房顫發病重要的病理生理機制之一。根據Frank-starling機制不難理解,長期心衰時心臟收縮或舒張功能障礙導致心室前負荷增加,左心室容積及壓力升高,相應的左房壓力增高,左心房失代償性擴大,心房肌纖維化和折返環增多,促進房顫的發生和維持。本研究結果顯示心衰患者中房顫組左房內徑明顯大于非房顫組,并且經logistic回歸分析,顯示左心房內徑為心力衰竭合并心房顫動的獨立危險因素。此結果與美國此類研究[8]結果一致:左房擴大與房顫的發生獨立相關。另外,本研究還發現心衰患者中,房顫組患者較非房顫組左室內徑有減小趨勢,射血分數有升高趨勢,但差異無統計學意義,這與傳統的觀點即慢性心衰患者發生房顫后心功能惡化、左室內徑增大、射血分數減低不符,考慮與樣本量較少有關。
總之,心衰與房顫并存的患者,死亡率高,遠期預后差。本研究發現房顫在射血分數保留的心衰患者中更為普遍;在眾多心衰的危險因素中,合并高血壓更容易發生房顫;左心房內徑是心力衰竭合并心房顫動的獨立危險因素,在臨床上應重視心衰患者心律的評估,及早識別心衰合并房顫的危險因素,并根據患者的癥狀和病情,予以恰當的藥物治療和非藥物治療,從而減少心衰患者房顫發病率,降低患者死亡率,提升患者生活質量。

