基因工程抗體在微囊藻毒素檢測分析中的應用研究
徐重新,劉 媛,李建宏,劉賢金*
(1.江蘇省農業科學院 農產品質量安全與營養研究所,省部共建國家重點實驗室培育基地——江蘇省食品質量安全重點實驗室,江蘇 南京 210014;2.南京師范大學 生命科學學院,江蘇 南京 210023)
微囊藻毒素(Microcystin,MC)是由微囊藻(Microcystis)、魚腥藻(Anabaena)、束絲藻(Aphanizomenon)、擬柱胞藻(Cylindrospermopsis)以及顫藻(Oscillatoria)等藍藻在水華過程中產生的一種由環狀七肽組成的小分子劇毒致癌性生物毒素,普遍存在于富營養化水體中,是威脅水資源安全的最主要危害因素之一[1]。目前,被發現和鑒定的微囊藻毒素亞型已經超過200種,其分子量多在1 000 Da左右,其中LR是最常見、分布最廣也是毒性最強、危害最大的一種亞型[2-3]。微囊藻毒素-LR(MC-LR)是一種典型的肝毒素,通過靶向抑制蛋白磷酸酶1 和2A的活性,引起細胞凋亡,誘發癌變,導致肝功能衰竭壞死;同時還對腎臟、心臟、免疫系統和生殖系統等組織具有較強的生物毒性[4-7]。微囊藻毒素具有水溶性極好、化學性質穩定、耐高溫、不易變性等特點,且能夠通過生態系統和食物鏈循環在水體、土壤、水產品和農作物中蓄積,從而危害人類及動物健康[1-2,8-9]。MC-LR現已經被國際癌癥研究署(International Agency for Research on Cancer,IARC)列為2B類致癌物質,國際衛生組織(World Health Organization,WHO)將其在飲用水中的最大殘留限量標準(Maximum residue limit standard,MRLs)設定為1.0 μg/L,且規定每日允許攝入量(Acceptable daily intake,ADI)不得高于0.04 μg/(kg bw·d)[10-11]。因此,為確保飲用水資源和農產品(特別是食用農產品)質量安全,建立可用于快速高靈敏度分析微囊藻毒素殘留的檢測方法,對保障人和動物的健康極其必要。
目前,可用于微囊藻毒素分析的檢測方法眾多,主要可分為以下幾種:基于動物毒理實驗的生物測定法、基于毒素物理化學性質的儀器分析法(如高效液相色譜法(HPLC)、高效液相色譜-串聯質譜法(LC-MS)、氣相色譜-串聯質譜法(GC-MS)和基質輔助激光解析串聯飛行時間質譜法(MDLDI-TOF MS)等)、基于“抗體-抗原”或蛋白質酶學識別原理的生物化學檢測法(如免疫學分析法(Immunoassay)和蛋白磷酸酶抑制法(PPIA)),以及基于毒素基因的分子生物學檢測方法(如PCR檢測法、實時定量PCR(qPCR)檢測方法和基因芯片技術)等[12-13]。其中,以酶聯免疫吸附法(Enzyme linked immunosorbent assay,ELISA)為代表的免疫學分析法因具有反應快速靈敏、抗原特異性強、樣品處理簡單、操作和使用方便、適用性廣等優點,具有廣闊的應用價值和商業前景,已成為當今小分子生物毒素快速檢測研究的熱點[14-15]。本文從當前熱門的基因工程抗體創制技術入手,著重梳理了國內外基因工程抗體在微囊藻毒素檢測應用上的最新研究狀況,并就基因工程抗體的發展及應用前景進行探討和展望,旨在為推進基因工程抗體在微囊藻毒素檢測上的應用提供有價值的參考資料和輔助建議。
1 微囊藻毒素產生的主要因素
微囊藻毒素作為藍藻水華時產生的一種危害最大的有毒次生代謝產物,其產生因素不僅跟產毒藻類內在有關基因的表達及藻細胞特殊的生理生態特征有關,還受到引起藍藻水華外在自然因素的誘導和調控。關鍵的內在因素:目前普遍認為產毒藻類均含有mcy家族基因且主導了微囊藻毒素肽鏈的復雜轉錄合成過程,其中mcyG、mcyJ、mcyD、mcyE、mcyF、mcyA、mcyI、mcyB、mcyC和mcyH等基因型先后協同參與微囊藻毒素關鍵多肽的轉錄合成及修飾,并在聚酮合酶(Polyketide synthase,PKS)和非核糖體合酶(Non-ribosomal peptide synthase,NRSP)等特殊酶的共同作用下,利用氨基酸或者化合物,繞開核糖體,最終經非核糖體合成途徑完成微囊藻毒素的合成[16];此外,產毒藻類具有的獨特生理生態特性,也是維系和促進微囊藻毒素產生的重要內在因素,如產毒藻類普遍存在偽空泡(氣囊)和較厚的膠質鞘等結構,以及高效的CO2吸收、氮固定能力和適應低光強、防曬等特性[17-19]。主要的外在因素:有利的綜合環境因子是誘導和刺激藍藻水華從而釋放微囊藻毒素的必要條件,其中氮磷營養鹽的富營養化(N>0.5 mg/L,P>0.02 mg/L)和恰當的配比(N/P=16~29)是最關鍵的催化誘因,適合的水體溫度(25~35 ℃)是水華發生的主要孵育溫床,此外適宜的水文(水力滯留時間>2周)和氣象(風速<3 m/s)條件、光照強度和日照時間,以及微量元素等都是藍藻水華發生的重要環境因素[17,20-21]。
2 微囊藻毒素的致毒機理及主要危害風險
微囊藻毒素是一類具有共性環狀七肽結構的小分子生物毒素。在目前已經發現和鑒定的近200種亞型中,MC-LR、MC-RR和MC-YR 3種亞型是藍藻水華水體中最常見也是毒性最強的微囊藻毒素類型,其中又以MC-LR亞型在環境中最普遍、毒性最強、危害最大也就關注最多、研究得最透徹;MC-LA和MC-WR毒性中等,而其余亞型則較為少見且毒性相對較弱(表1)[22-24]。以MC-LR亞型為典型代表的微囊藻毒素的最大危害風險是嚴重損傷動物肝臟,同時對動物免疫和神經系統以及腸、胃、腎、腦等組織或器官具有多重損傷,甚至能夠抑制多種微生物生長,打破環境微生態群落平衡。在細胞水平上,大劑量微囊藻毒素暴露在細胞表面,能提高細胞乳酸脫氫酶(Lactate dehydrogenase,LDH)滲出率,短時間即可破壞細胞膜的穩定性和完整性,引起細胞形變、失活,導致壞死[5];進入胞內后,微囊藻毒素通過靶向抑制蛋白磷酸酶1 和2A的活性,使骨架蛋白過磷酸化,引起變性,擾亂細胞骨架系統[6];同時,微囊藻毒素在胞內還能引發活性氧自由基(Reactive oxygen species,ROS)快速產生,引起系列氧化應激級聯反應,從而擾亂信號傳導,影響胞內細胞器正常功能,導致細胞凋亡或增殖[25]。在基因水平上,微囊藻毒素及其在胞內誘導產生的某些衍生物(如ROS)均能在一定程度上誘導DNA發生不可逆突變,主要體現在改變細胞核形態、破壞DNA結構和抑制DNA修復等[26-27],此外還有研究顯示微囊藻毒素能改變致癌基因和腫瘤抑制基因的表達等[28-29]。

表1 微囊藻毒素結構通式、主要亞型及其危害風險Table 1 Chemical structure,main subtypes and hazard risk of microcystin
3 基因工程抗體及其創制技術
基因工程抗體是相對于傳統動物免疫產生的多/單克隆抗體而言的,伴隨現代基因工程和分子改造技術發展而來的具有抗體功能的人工生物肽鏈或多肽。目前,報道可查的基因工程抗體類型主要有抗原結合片段(Fragment of antigen binding,Fab)、單鏈抗體(Single-chain variable fragment,scFv)、單域抗體(Single-domain antibody,sdAb)以及具有模擬抗體功能的特殊小分子多肽(Polypeptide)等(表2)。其中,單鏈抗體是目前研究最多、應用最廣的基因工程抗體,它由抗體的重鏈(VH)和輕鏈(VL)經特殊設計的Linker序列拼接而成,具有較為完整的抗體功能和生物活性,現已在生物醫藥、生物診斷和免疫檢測等領域具有較為成熟的應用[15,30];同時,單域抗體中的駝源納米抗體(VHH)因其天然特殊的分子結構特征,具有穩定性和穿透性強、可容性好、免疫原性低以及更易表達等獨特優勢,已日趨成為基因工程抗體創制的新熱點[31-32]。基因工程抗體一般借助抗體展示系統(如噬菌體、酵母、核糖體及細菌等(表2))形成抗體庫,然后通過固相化包被抗原,經多輪“投入-吸附-洗脫-擴增”步驟從庫中靶向淘篩具有抗原特異性的基因工程抗體[33];也有將經抗原免疫制備的單克隆抗體重輕鏈基因反轉錄拼接成為完整的單鏈抗體基因,然后直接進行克隆表達的報道[34]。噬菌體表面展示系統是當前基因工程抗體庫構建和應用領域研究最早、技術最為成熟和應用最廣的可用于基因工程抗體展示的系統[35-36],目前已經商品化的噬菌體基因工程抗體庫有英國劍橋大學蛋白質工程中心研發的人源化的Tomlinson(I+J)單鏈抗體庫和人源重鏈半合成的Domain antibody 單域抗體庫,以及NEB 公司推出的隨機十二肽庫(ph.D.-12)和七肽庫(ph.D.-7)等[37],此外還有眾多鼠源、兔源、雞源以及駝源噬菌體基因工程抗體庫構建或應用的報道[15,38-40]。

表2 基因工程抗體主要形式及其常用展示系統Table 2 Main forms and display systems of genetically engineered antibodies
4 基因工程抗體在微囊藻毒素檢測上的應用
基于噬菌體表面展示基因工程抗體庫及配套的抗原特異性抗體高通量淘篩方法,是快速靶向獲得微囊藻毒素基因工程抗體的最主要手段。本文作者借助ISI Web of Science網站(http://isiknowledge.com/)和中國知網(http://www.cnki.net/)數據庫搜索了2000年以來國內外有關微囊藻毒素基因工程抗體創制及應用研究的文獻報道,共統計論文總數接近20篇,涉及的基因工程抗體均為噬菌體表面展示形式,其中單鏈抗體占絕對多數,其次是納米抗體,此外還有零星小分子多肽抗體的報道(表3)。McElhine等[41]率先將微囊藻毒素偶聯到牛血清蛋白(BSA)上形成MC-BSA作為包被抗原,然后通過富集篩選,從人源半合成的單鏈抗體庫(Tomlinson I)中成功獲得了具有MC-LR識別能力的單鏈抗體,并建立了微囊藻毒素的間接競爭酶聯免疫檢測方法(Indirect competitive enzyme-linked immunosorbent assay,IC-ELISA),其半抑制濃度(Half-maximum inhibition,IC50)為4 μg/mL;Zhao等[42]將微囊藻毒素與生物素偶聯并作為包被抗原,從隨機12肽庫中篩選到了多個具有MC-LR的多肽抗體,并建立了間接非競爭酶聯免疫檢測方法(Indirect non-competitive enzyme-linked immunosorbent assay,INC-ELISA);Lawton等[43]則利用單鏈抗體建立了針對MC-LR快速檢測的側流免疫分析方法(Lateral flow immunoassay,LF-IA),其最低檢測靈敏度(Limit of detection,LOD)達到了0.1 μg/L。此外,本實驗團隊成員劉媛等[44]利用從鼠源合成庫噬菌體抗體庫中篩選到的單鏈抗體,建立了針對MC-LR的時間分辨熒光免疫分析法(Time-resolved fluoroimmunoassay,TRFIA),最低檢測靈敏度達13 ng/mL;Xu等[39]以微囊藻毒素和血藍蛋白(Keyhole limpet hemocyanin,KLH)的偶聯物作為包被抗原,從駝源天然納米抗體庫中成功篩選到了高靈敏識別MC-LR的納米抗體,建立的IC-ELISA顯示,其IC50和LOD值分別達到了0.87 μg/L和0.06 μg/L,且其對MC-RR、MC-YR、MC-LW和MC-WR均具有一定的交叉識別能力。
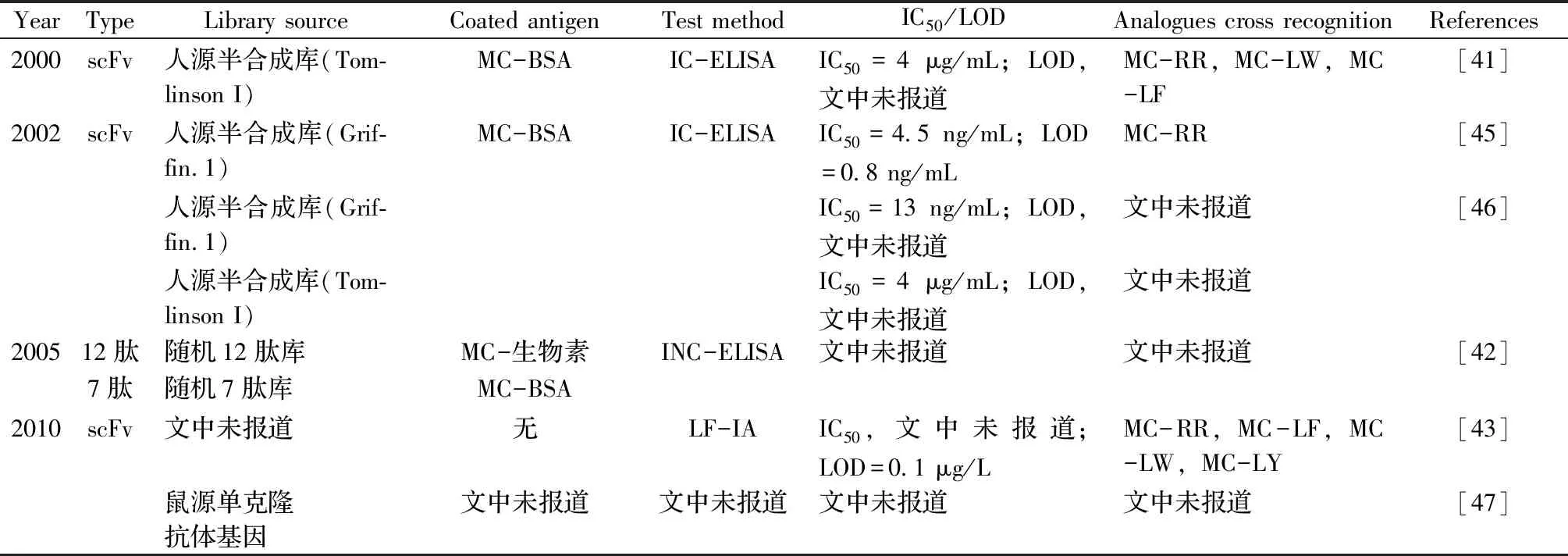
表3 基因工程抗體在微囊藻毒素-LR免疫檢測上的研究報道Table 3 The reports of genetically engineered antibodies used for MC-LR determination
(續表3)

YearTypeLibrary sourceCoated antigenTest methodIC50/LODAnalogues cross recognitionReferences2012scFv鼠源合成庫MC-生物素-磁珠TRFIAIC50=435 ng/mL;LOD=13 ng/mL文中未報道 [44]2013scFv鼠源合成庫MC-生物素-磁珠TRFIAIC50=2.1 ng/mL;LOD,未見報道文中未報道 [48]2014scFv人源半合成庫(Grif-fin.1)MC-OVAIC-ELISAIC50=2.97 μg/mL;LOD=0.25 μg/mL文中未報道[49]2015scFv鼠源免疫抗體庫MC-OVAIB-ELISAIC50=4.8 ng/mL;LOD=0.19 ng/mLMC-LW,MC-RR,MC-YR,MC-LA,MC-LF [50]2016scFv鼠源單克隆抗體基因MC-OVAIC-CLISAIC50=0.81 μg/L;LOD=0.13 μg/LMC-RR,MC-YR,MC-LW [34]文中未報道MC-鏈親和素INC-TRFIAIC50,文中未報道;LOD=0.026 μg/LMC-RR,MC-YR,MC-LA,MC-LY,MC-LF,MC-LW,MC-WR [51]2017scFv文中未報道MC-鏈親和素INC-ELISAIC50,文中未報道;LOD=0.2 μg/LMC-RR,MC-YR,MC-LA,MC-LY,MC-LF,MC-LW,MC-WR [52]VHH駝源免疫抗體庫MC-BSA IC-ELISAIC50=0.28 μg/L;LOD=0.05 μg/LMC-RR,MC-YR [53]2018VHH駝源天然抗體庫MC-KLHIC-ELISAIC50=0.87 μg/L;LOD=0.06 μg/LMC-RR,MC-YR,MC-LW,MC-WR [39]
5 結語與展望
微囊藻毒素污染及其引起的安全危害風險是世界性問題,備受國際社會關注,因此研發一種快速、簡單、靈敏的可用于微囊藻毒素監測的檢測方法及其產品,不僅具有重要的社會和科學意義,同時還具有廣闊的市場前景,蘊含著巨大的商業價值。基于“抗體-抗原”識別的免疫學檢測方法,特別是商品化的快速檢測試劑盒(如檢測試紙),因其低成本、高靈敏、操作簡單、實用性強、適用性廣等優勢,在分子診斷和有毒有害物檢測分析領域備受科研工作者、政府監管部門以及廣大普通消費者青睞。基因工程抗體作為抗體創制領域最新研究的熱點,擺脫了創制抗體需由動物免疫產生的制約,通過依托抗體表面展示技術形成大容量和多樣性強的抗體庫,再經抗原特異性高通量靶向篩選,獲得抗體及其基因,實現了基因工程抗體的可人工多系統克隆表達,甚至還可在基因水平上分析和改造抗體特性,應用前景勢不可擋[15,54];但是,作為新興的抗體類型,基因工程抗體及其創制技術并沒有像傳統多克隆抗體和單克隆抗體那樣發展到足夠成熟,仍然普遍存在篩選隨機性強、抗原親和力不夠高、抗體穩定性較差以及半衰期短等問題,嚴重限制了其應用[55-56]。截至目前,針對微囊藻毒素檢測的基因工程抗體創制研究已接近20年,基因工程抗體類型涵蓋單鏈抗體、多肽抗體以及納米抗體,庫源涉及人源、鼠源、駝源以及隨機合成多肽等,但這些研究僅停留或受限制在實驗室內,尚屬于初步探索階段,均未轉化成為可推廣應用的商品化試劑盒產品。
為推進基因工程抗體及其創制技術在微囊藻毒素檢測上的應用,解決基因工程抗體在活性和穩定性上的不足是首要問題。首先需要改進傳統篩選方法:采用多次交替多種微囊藻毒素偶聯載體(如MC-BSA/OVA/KLH/生物素/磁珠等)作為富集、分離及鑒定等過程的包被抗原,充分規避可能由大分子載體導致的假陽性現象干擾,是從抗體庫獲取微囊藻毒素高活性基因工程抗體較為簡單和可行的篩選方法[39];其次構建免疫抗體庫:通過微囊藻毒素免疫動物(如鼠、兔、羊駝等),刺激動物脾臟等免疫系統特異性富集針對微囊藻毒素的抗體基因大量表達,然后構建免疫抗體庫用于庫篩選,以期大幅提高篩選獲得微囊藻毒素高活性基因工程抗體的概率和效率,該方法已有多種毒素高活性基因工程抗體成功創制的報道[15,57];再次是采用分子改造技術進行親和成熟:借助生物信息學手段輔助預測和分析基因工程抗體與毒素蛋白結合的熱點區域,進行定點突變、DNA改組以及鏈置換等改造,均是大幅改進母本基因工程抗體親和力活性以及進行特性修飾的常見有效方法[58-59]。最后是借助標記特殊發光基團:在抗體-抗原親和力無法改進的條件下,對抗體進行特殊發光基團(如Sm3+、Eu3+)標記,建立的免疫學檢測方法在特殊儀器中對抗原的檢測靈敏度可提高成百上千倍,是提高小分子生物毒素檢測靈敏度較為常見的手段[60]。

