基于手持技術的醋酸電離平衡常數測定
周海珠
【內容摘要】隨著社會的高速發展,信息技術融入各行各業,教育行業也在不斷地與信息技術進行融合。手持技術作為現代科學技術的產物,因其擁有強大的技術支持、便攜、靈敏等特點,備受教育領域的青睞。手持技術儀器有溫度、電導率、pH等多種傳感器,可以精確的測量物理、化學、生物中相關量的變化,有利于學生對抽象知識的理解。手持技術是現代科學技術與教育結合的產物,它的使用可以提高教學效率,特別對于定量實驗的研究提供了強大的技術支持。我們實驗小組通過手持技術測定了同一溫度下不同濃度的醋酸溶液的電離平衡常數,得出在相同溫度下不同濃度的醋酸溶液的電離平衡常數基本上恒定不變。
【關鍵詞】手持技術 PH傳感器 醋酸溶液 電離平衡常數Ka
隨著科技的發展,酸、堿、鹽之間的離子反應在許多領域都有廣泛的應用。例如,生命體內的運輸系統以水溶液為主,因此離子反應也是了解生命過程的基礎。在實驗室內或工業反應器內,人們經常利用酸、堿和鹽的離子反應來進行雜質的檢出與分離和制造新的化合物。例如,利用離子反應制造納米材料的方法已得到普遍應用。自治理水體污染時,可利用離子反應來處理水中存在的微量重金屬元素或核燃料廢料。而我們所要研究的醋酸電離平衡常數測定只是化學離子平衡中的冰山一角。我們實驗的內容是通過手持技術使用PH傳感器測量同一條件下不同濃度的弱電解質醋酸的PH值,利用數據采集器和計算機算出對應的電離平衡常數Ka值。
一、實驗原理
在醋酸CH3COOH溶液中,存在醋酸和水的電離平衡,它們的電離平衡式為:CH3COOH=H++CH3COO-;H2O=H++OH-。
酸性溶液中,水的電離非常小,所以在醋酸溶液中H+和CH3COO-的離子濃度近似相等,利用公式Ka=[H+][CH3COO-]/[CH3COOH],可計算CH3COOH電離平衡常數Ka。
二、實驗儀器和試劑
實驗儀器:朗威DISLab6.0數據采集器、PH傳感器(含電極)、計算機、50ml燒杯(若干個),濾紙。
實驗試劑:0.01mol/L CH3COOH溶液、0.05mol/L CH3COOH溶液、0.10mol/L CH3COOH溶液、蒸餾水。
三、實驗過程和數據分析
步驟1:配制0.01mol/L CH3COOH溶液、0.05mol/L CH3COOH溶液、0.10mol/L CH3COOH溶液。
步驟2:連接計算機、數據采集器及PH傳感器。然后打開計算機,進入V6.0實驗軟件系統,點擊“通用軟件”,系統自動識別所接入的傳感器,并顯示PH值窗口。
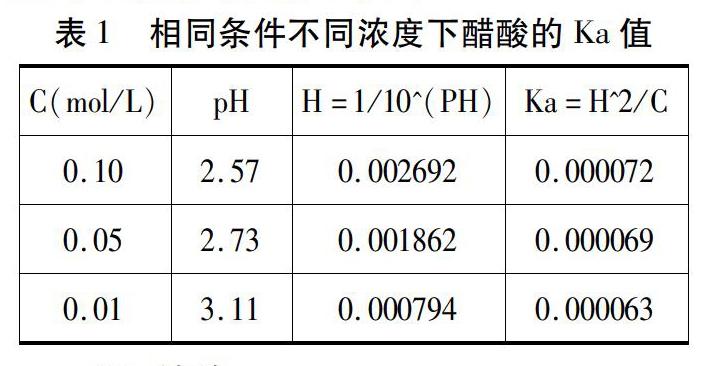
步驟3:打開“計算表格”,添加變量“C1”代表CH3COOH溶液的濃度,自定義公式“H1=1/10^(PH1)”代表氫離子濃度;自定義公式“Ka1=H1^2/C”代表乙酸電離平衡常數,選擇“平鋪窗口”。
步驟4:用蒸餾水淋洗PH傳感器電極,并用濾紙吸干附著在電極上的水。
步驟5:向50ml燒杯中加入約20ml 0.01mol/LCH3COOH,同時將PH傳感器電極放入燒杯中,使電極玻璃泡完全浸入液面以下。待PH值示數穩定后(電極的響應時間約30s),系統將自動顯示CH3COOH的PH1值。
步驟6:點擊“記錄”后,將相應的濃度(0.01mol/L)輸入表格,電腦自動計算出0.01mol/LCH3COOH的氫離子濃度及對應的電離平衡常數Ka1。
步驟7:依次向新燒杯中加入0.05mol/L CH3COOH溶液、0.10mol/L CH3COOH溶液。重復實驗步驟3到步驟6即可得到相應濃度CH3COOH溶液的電離平衡常數(數據見表1)
四、結論
通過實驗測定結果顯示,在一定溫度下,當醋酸溶液的物質的量濃度較小時,不同濃度下的pH和氫離子濃度變化較為明顯,但其電離平衡常數幾乎恒定不變。
五、實驗注意事項
(1)本實驗中溶液濃度的配制是否準確將極大的影響測定結果,因此在配制溶液時一定要保證濃度的準確性。
(2)每次測定不同溶液時都要用蒸餾水淋洗pH傳感器電極,并用濾紙吸干附著在電極上的水。
(3)在實驗步驟三中,添加變量c、自定義公式“H=1/10^(PH)”和自定義公式“Ka=H^2/C”時,不同濃度下的變量c、H、Ka應用1、2、3等區分開來。
(4)讀pH值時,應等待pH值示數穩定后才能記錄數值(電極的響應時間約30s)。
【參考文獻】
[1]朗威數字化信息系統實驗室化學生命科學用戶手冊[M].
[2]張靜. 基于手持技術的中學化學教學案例及實踐研究[J],2014.
[3]黃穎潔. 基于手持技術的“離子反應”課堂教學研究[J]. 中國現代教育裝備,2014,(14): 34-35.
(作者單位:珠海市第四中學)

