沙門氏菌類活疫苗活菌計數參考疫苗的研究
王秀麗,張媛,李紅霞,袁露,李愛玲,曹翠萍,劉博,辛凌翔,彭國瑞,李建,蔣玉文*
(1.中國獸醫藥品監察所,北京 100081;2. 齊魯動物保健品有限公司,濟南 250100;3. 遼寧益康生物股份有限公司,遼寧遼陽 111000)
沙門氏菌能感染多種動物,大部分沙門氏菌具有較強的致病性,成為肉類產品的主要污染源[1]。二〇一五版《中國獸藥典》中收錄的沙門氏菌類活疫苗有仔豬副傷寒活疫苗(C500株)、沙門氏菌馬流產活疫苗、牦牛副傷寒活疫苗、牛副傷寒滅活疫苗等[2]。活菌計數是該類疫苗質量標準的重要參數,對于評價疫苗的安全性和免疫效力有重要意義;該類疫苗的效力檢驗(免疫攻毒法)也需要估計測毒及攻毒菌數。活菌計數受到多種因素影響,如培養基質量、培養條件、平板表面濕度、檢驗員的主觀差異等,導致按照標準操作規程計數的結果不一致。在近幾年的檢驗過程中,多次出現初次檢驗結果不符合規定,更換培養基或檢驗員重檢后檢驗結果符合規定的情況,因目前沒有活菌計數的參照物,對培養基的促生長能力及檢驗員的計數結果無科學評價的方法,重復檢驗降低工作效率,浪費實驗材料。本研究試圖研制沙門氏菌類疫苗活菌計數的參考疫苗,以期更加科學地評價沙門氏菌類疫苗活菌計數的結果。
1 材料與方法
1.1 參考疫苗候選物的制備及分發 按照《中華人民共和國獸用生物制品規程》[3]的方法,制備一批(500瓶)仔豬副傷寒活疫苗(20頭份/瓶),作為參考疫苗候選物。按照現行《中國獸藥典》三部對參考疫苗候選物的性狀、純粹檢驗、活菌計數、真空度測定、剩余水分等參數進行檢驗。從500 瓶參考疫苗候選物中隨機抽取100 瓶,置于隔熱泡沫塑料盒內,并放入生物冰袋,最外層包裝紙箱,快遞至A單位、B單位和C單位,收到樣品后立即置于-70 ℃以下冰箱中保存[4]。
1.2 培養基及耗材 用6批原材料按《中華人民共和國獸用生物制品規程》二〇〇〇年版附錄配制6批普通瓊脂培養基,用上述培養基對隨機抽取的3瓶參考疫苗候選物進行活菌計數,篩選出適宜的培養基原材料。用篩選出的原材料制備普通瓊脂和普通肉湯培養基,用翻口膠塞密封后置于2~8 ℃保存。1 mL、10 mL一次性吸管購買自costar,一次性平皿(直徑90 mm),購買自青島金典生化器材公司。A、B、C三家單位所用的試驗耗材完全一致。
1.3 均一性試驗 隨機抽取10瓶參考疫苗候選物,由2名檢驗員對10瓶參考疫苗候選物同時進行活菌計數,計算每位檢驗員對10瓶參考疫苗計數結果的變異系數,比較2組數據的差異程度。

1.5 運輸穩定性試驗 B單位和C單位分別從100瓶參考疫苗候選物中隨機抽取5 瓶用1.1項下的方式寄到A單位,A單位收到樣品后馬上進行活菌計數,運輸過程均需2 d,分析運輸過程對樣品穩定性的影響。夏季(7月份)和冬季(12月份)分別試驗一次。
1.6 加速破壞試驗 隨機抽取參考疫苗候選物,分別置于2~8 ℃、25 ℃、37 ℃、-20 ℃條件下,2~8 ℃、25 ℃、37 ℃條件下保存的樣品每隔若干天隨機抽取3瓶進行活菌計數、-20 ℃保存的樣品每隔6個月隨機抽取3瓶進行活菌計數,分析樣品在不同儲存條件下的穩定性[7]。
1.7 保存期試驗 將置于-70 ℃以下保存的仔豬副傷寒參考疫苗候選物按1.4項下協作標定的方法每1~2個月取樣并計數,至保存期18個月,對計數結果進行統計分析,每隔6個月對其性狀、真空度、剩余水分測定一次。
1.8 參考疫苗的應用 2016-2018年沙門氏菌類活疫苗活菌計數的檢驗中,加入參考疫苗,每次檢驗隨機抽取3瓶參考疫苗,其中至少2瓶參考疫苗計數結果在協作標定賦值范圍內時對照成立,對待檢疫苗進行結果判定。
2 結 果
2.1 參考疫苗候選物的檢驗 參考疫苗候選物性狀為海綿狀疏松團塊,易與瓶壁脫離,加稀釋液后迅速溶解,隨機抽取5瓶疫苗進行純粹檢驗,結果5/5純粹生長,真空度測定結果顯示疫苗呈現白色或粉色或紫色輝光,隨機抽取4瓶疫苗測定剩余水分,結果為2.2%、2.3%、2.6%、2.1%,均小于3.0%,活菌計數結果為3.5×109CFU/頭份。
2.2 培養基的篩選 由2名檢驗員用編號A~F的 6批普通瓊脂培養基對相同的3瓶樣品進行活菌計數。結果顯示,6批普通瓊脂培養基計數結果無差異,2名檢驗員計數結果基本一致(表1)。因此,隨機選1批培養基的原材料配制普通瓊脂培養基300瓶,100 mL/瓶,配制普通肉湯培養基400瓶,100 mL/瓶,均用翻口膠塞封口后置于2~8 ℃保存備用。

表1 參考疫苗用6批普通瓊脂培養基計數結果Tab 1 Test result of the reference vaccines with 6 batches of normal agar mediums
表格中的2個數據分別為兩名檢驗員的檢測結果
2.3 均一性試驗 結果顯示,2名檢驗員對10瓶參考疫苗候選物計數結果的變異系數分別為8.4%和8.2%,均小于10%,說明均一性良好[8],2名檢驗員對同一瓶疫苗計數結果的差異小于5.4%,說明檢驗員之間的計數結果差異不明顯(表2)。

2.5 運輸穩定性試驗 第一次運輸穩定性試驗(夏季,7月份):B單位和C單位寄回的5瓶參考疫苗候選物計數結果的最小值均為3.7×109CFU/頭份,第二次運輸穩定性試驗(冬季,12月份):B單位和C單位寄回的5瓶參考疫苗候選物計數結果的最小值分別為3.6×109CFU/頭份,3.7×109CFU/頭份。本參考疫苗候選物保存期0個月時計數結果為3.5×109CFU/頭份,運輸后計數結果與其一致,說明該參考疫苗候選物在48 h內的運輸穩定性良好(表3)。

表2 均一性試驗結果Tab 2 The uniformity test result

表3 運輸穩定性試驗結果Tab 3 The transport stability test result
表中數據為測定的菌數,單位為109CFU/頭份
2.6 加速破壞試驗 加速破壞試驗結果(表4-表7)顯示:2~8 ℃保存10 d,結果穩定,保存20 d菌數下降17%;25 ℃保存7 d,結果穩定,保存20 d,菌數下降22%;37 ℃保存5 d,結果穩定,保存7 d,菌數下降31%;-20 ℃保存的疫苗18個月內菌數無下降,結果穩定。
2.7 保存期試驗 按協作標定的方法對-70 ℃以下保存18 個月以內的參考疫苗候選物逐月進行活菌計數,剔除結果不滿意的偏離數據,變異系數為6.7%~8.9%,均小于10%,平均數為3.4×109~3.7×109CFU/頭份,中位數為3.4×109~3.75×109CFU/頭份,均在活菌計數可接受的誤差范圍內,且計數結果在18個月內未隨保存時間的延長而降低,保存期為6個月、12個月、18個月時分別隨機抽取參考疫苗候選物檢查性狀、真空度,結果均符合《中國獸藥典》的規定[9],剩余水分均小于3%。

表4 參考疫苗候選物加速破壞試驗(2~8℃)Tab 4 The accelerated damage test of the candidate reference vaccines(2~8℃)
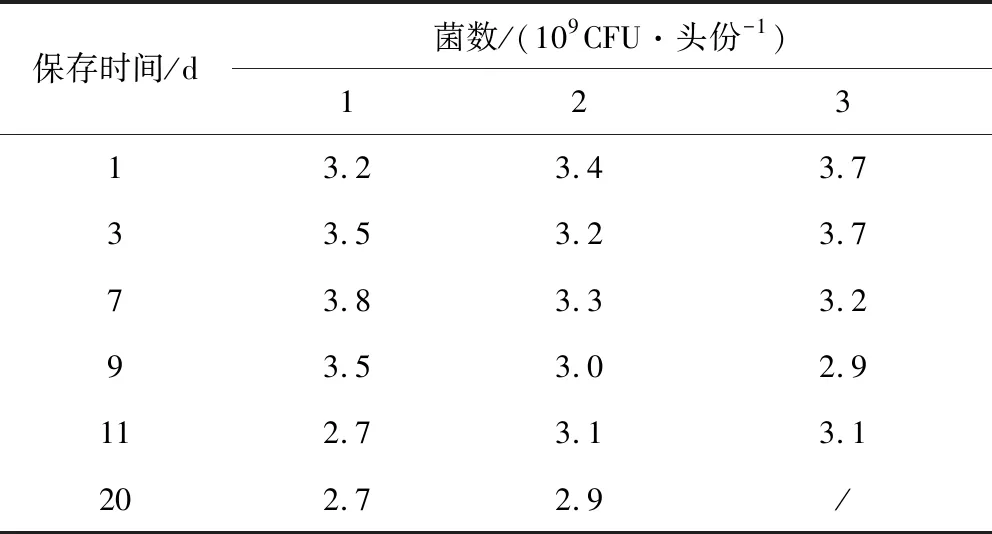
表5 參考疫苗候選物加速穩定性試驗(25℃)Tab 5 The accelerated damage test of the candidate reference vaccines(25℃)
2.8 參考疫苗的應用 本參考疫苗在應用過程中主要存在4種情況:(1)參考疫苗對照成立,待檢疫苗不符合規定,這種情況下更換培養基,由2名檢驗員同時對待檢疫苗進行重檢,檢測結果均與初次檢驗結果一致。(2)待檢疫苗和參考疫苗結果均不符合規定,更換培養基對待檢疫苗和參考疫苗重檢測,參考疫苗結果符合規定,對待檢疫苗進行判定。(3)參考疫苗符合規定,待檢疫苗不符合規定,但二者在37 ℃培養24 h菌落大小不一,繼續延長培養時間仍有新菌落長出,且菌落直徑總體小于本菌在37 ℃培養24 h的大小。(4)待檢疫苗和參考疫苗均符合各自質量標準(表8)。
3 結論與討論
在生物制品的檢驗中增加參考品以更加客觀、科學的評價檢驗結果是未來的一種趨勢,國外以及國內人用生物制品參考品的研究及應用越來越廣泛[10-11]。活菌計數是細菌類活疫苗質量控制最重要的參數之一,直接關系到疫苗的安全性和免疫效力,參考疫苗的研究對于客觀評價疫苗的菌數有極其重要的意義。目前我國尚無任何活菌計數的參考疫苗,也無控制培養基促生長能力的參考疫苗,對影響活菌計數結果的關鍵因素之一培養基的質量無法科學評價,外加其他因素的影響,更無法科學評價活菌計數結果的有效性。活菌計數的參照物在美國細菌類疫苗如多殺性巴氏桿菌和豬丹毒桿菌活疫苗的檢驗中已應用多年[12-13],但其應用和判定不適合中國國情。

表6 參考疫苗候選物加速穩定性試驗(37℃)Tab 6 The accelerated damage test of the candidate reference vaccines(37℃)

表7 參考疫苗候選物加速穩定性試驗(-20℃)Tab 7 The accelerated damage test of the candidate reference vaccines(-20℃)
通過對沙門氏菌類活菌計數參考疫苗的系統研究,制定出參考疫苗的質量標準:性狀、純粹檢驗、真空度測定、剩余水分測定的標準參照《中國獸藥典》;活菌計數標準為隨機抽取3瓶參考疫苗,至少有2瓶計數結果在參考疫苗協作標定賦值范圍內,且在37 ℃培養24 h,菌落大小均勻一致; 均一性檢驗標準為隨機抽取10瓶參考疫苗進行活菌計數,10瓶參考疫苗計數結果的變異系數小于10.0%;運輸穩定性標準為將參考疫苗置于2~15 ℃運輸不超過48 h,活菌數下降應小于10.0%。

表8 參考疫苗的應用情況Tab 8 The preliminary application of the reference vaccine
參考疫苗換批時需對現有的在保存期內的參考疫苗用普通瓊脂進行計數,如果計數結果符合參考疫苗的質量標準,說明普通瓊脂培養基的靈敏度適宜,用該普通瓊脂培養基對新制備的參考疫苗進行檢驗和協作標定,以確保參考疫苗在換批時標準一致[14]。
參考疫苗的應用結果顯示,本參考疫苗既可以應用于控制沙門氏菌類活疫苗活菌計數的過程,又可以用于控制普通瓊脂培養基的質量。控制沙門氏菌類活疫苗活菌計數的過程時,每次檢驗均需使用參考疫苗對試驗結果的有效性進行判定。若一次檢驗中使用同一批普通瓊脂培養基對多批次檢品進行檢驗,則僅需要使用3瓶參考疫苗對試驗結果的有效性進行判定。若一次檢驗中使用了不同批次的普通瓊脂培養基,則每批次普通瓊脂培養基均需用3瓶參考疫苗對試驗結果進行有效性判定。當3瓶參考疫苗中至少2瓶計數結果在參考疫苗質量標準規定的范圍內,且(37±0.5) ℃培養18~24 h菌落大小均勻一致時,判定試驗結果有效。此時將每批待檢疫苗3瓶樣品中含有活菌數的最小值計為檢驗結果,根據制品質量標準進行判定。用于普通瓊脂培養基質量控制時,每批普通瓊脂培養基用3瓶參考疫苗進行檢驗,當不少于2瓶參考疫苗計數結果在參考疫苗協作標定范圍內,且參考疫苗在(37±0.5)℃培養18~24 h,菌落大小均勻一致時,判定培養基促生長能力符合規定。若參考疫苗計數結果高于參考疫苗協作標定的賦值范圍,提示普通瓊脂培養基的促生長能力偏高,若低于參考疫苗協作標定的賦值范圍,提示普通瓊脂培養基的促生長能力偏高。因此應在普通瓊脂培養基質量標準的控制中添加促生長能力檢驗參數,符合規定的培養基用于檢驗,可以避免不必要的重復工作。若參考疫苗在普通瓊脂培養基的質量控制中應用后還可以降低普通瓊脂培養基促生長能力的批間差異,在效力檢驗(攻毒保護試驗)估算菌數時即使更換培養基,對結果影響不大,保證試驗的順利進行。

