CT引導下碘-125粒子植入治療非小細胞肺癌并椎體轉(zhuǎn)移癌的安全性與有效性
付傳發(fā)
(重慶市沙坪壩區(qū)人民醫(yī)院, 重慶, 400030)
非小細胞肺癌(NSCLC)合并椎體轉(zhuǎn)移癌可導致頑固性疼痛、脊髓或神經(jīng)根損傷、脊柱不穩(wěn)等癥狀, 嚴重影響患者生活質(zhì)量[1-2]。碘-125(125Ⅰ)粒子植入治療是指將微型放射性核素直接植入腫瘤組織內(nèi)或受浸潤組織中,以持續(xù)的、低能量的γ射線促使粒子釋放的能量被腫瘤組織充分吸收,在肺癌的臨床治療中發(fā)揮了獨特優(yōu)勢[3-4]。本研究探討CT引導下125Ⅰ粒子植入治療NSCLC合并椎體轉(zhuǎn)移癌的臨床療效與安全性,現(xiàn)報告如下。
1 資料與方法
1.1 一般資料
選取2012年8月—2016年9月本院接受125Ⅰ粒子植入治療的NSCLC合并椎體轉(zhuǎn)移癌患者80例,按治療方法分為觀察組[125Ⅰ粒子植入聯(lián)合經(jīng)皮椎體成形術(PVP)]與對照組(常規(guī)化療聯(lián)合PVP),每組40例。觀察組男22例,女18例,年齡41~72歲,平均(56.50±8.47)歲; 病理組織學分型為鱗癌20例,腺癌12例,鱗腺癌8例; 臨床分期(國際抗癌聯(lián)盟分期標準[5])為Ⅱ期11例, ⅢA期23例, ⅢB期6例,合并復發(fā)8例; 脊柱功能(Frankel分級法)C級8例, D級24例, E級8例。對照組男25例,女15例,年齡40~74歲,平均(57.01±8.58)歲; 鱗癌22例,腺癌11例,鱗腺癌7例; 臨床分期為Ⅱ期10例, ⅢA期23例, ⅢB期7例,合并復發(fā)7例; Frankel分級C級10例, D級23例, E級7例。2組性別、年齡、組織學分型、臨床分期、復發(fā)及脊柱功能等級等一般資料無顯著差異(P>0.05), 具可比性。
納入標準: ① 符合非小細胞肺癌診斷標準[6]; ② 經(jīng)影像學檢查明確伴椎體轉(zhuǎn)移[7](CT或MRI或PET-CT等); ③ 治療前卡氏評分(KPS)>70分; ④ 首次接受125Ⅰ粒子植入治療; ⑤ 復發(fā)患者,且納入本研究前1個月無化療史; ⑥ 患者及家屬意愿選取治療方案,均自愿簽署知情同意書。排除標準: ① 預期生存時間不足3個月; ② 相關治療禁忌,如心、肝、腎等重要臟器不耐受、凝血功能障礙等; ③ 合并椎體轉(zhuǎn)移癌以外的其他癌癥; ④ 局部皮損、隨訪脫落患者。
1.2 治療方法
對照組先行PVP治療,術前采用CT(美國GE,LIGHT SPEED VCT 64排螺旋CT儀)對定位點進行三維重建,確認定位點后在X線正側(cè)位透視下進針。確認穿刺針沿椎弓根進入病變椎體后,將調(diào)配好的骨水泥注入病變椎體,側(cè)面透視下檢測骨水泥走向,通過調(diào)整穿刺針斜面方向使骨水泥填充趨于良好,確認椎體內(nèi)骨水泥無滲漏后可拔除穿刺針管。術后按PVP臨床護理路徑進行護理干預,并于術后第3天給予吉西他濱(北京協(xié)和藥廠,批準文號H20103522, 規(guī)格1 g)聯(lián)合順鉑(云南個舊生物藥業(yè)有限公司,批準文號H53021678, 規(guī)格30 mg)化療,由醫(yī)師結合患者病情制定個體化治療方案,并參照《NCCN非小細胞肺癌指南更新(2011年第3版)》化療2個周期。
觀察組PVP及125Ⅰ粒子植入治療均于同一手術中完成,其中放射性粒子治療計劃系統(tǒng)(TPS)購自北京科霖眾公司,125Ⅰ粒子(顆粒直徑0.8 mm, 長4.5 mm, 外殼為鈦合金,內(nèi)含吸附有125Ⅰ粒子的鈀絲,放射性活度為0.7 mCi/粒,穿透能力為1.7~2.0 cm, 半衰期60.1 d)由上海欣科公司提供。先行CT掃描定位病灶、病灶形態(tài)、與周圍組織的關聯(lián)性,采用放射治療計劃系統(tǒng)(TPS)導入CT掃描圖像,并勾畫大體腫瘤體積(GTV), 由多學科團隊協(xié)作(MDT)小組(醫(yī)學影像科、腫瘤放療科、胸外科主治醫(yī)師組成)制定治療計劃,包括臨床靶區(qū)、周邊劑量。術前常規(guī)鋪設消毒巾,麻醉方式為局部麻醉,全程給予心電監(jiān)護,指導患者進行體位擺放。采用18 G穿刺施源針(日本八光)插入靶區(qū),依據(jù)標記的皮表穿刺點行多針穿刺,再次采用CT掃描定位穿刺針,并確認穿刺位置無誤后植入粒子; 對椎體病灶也依據(jù)術前CT定位,在正位透視下于棘突旁3 cm處采用椎弓根入路方式將針尖置于椎弓根“牛眼征”之內(nèi),確認穿刺針經(jīng)骨皮質(zhì)進入椎體后便可植入125Ⅰ粒子,當正位透視提示穿刺針尖越過椎弓根內(nèi)緣時改為斜面穿刺針,可通過調(diào)整針尖方向使125Ⅰ粒子分布更準確。粒子分布方式可由操作者視患者具體病情確定,包括垂直相互平行分布、均勻分布粒法等,植入粒子間隔距離為15~20 mm, 邊退針邊植入粒子,劑量參照處方劑量(8 000~11 000 cGy), 植入結束后再次行CT掃描并采用工作站進行三維圖像重建,以確認粒子分布與治療計劃是否相符及粒子植入后有無氣胸、胸腔積血等并發(fā)癥。確認無誤后行PVP手術,手術方式參考對照組。術后對125Ⅰ粒子行常規(guī)定量及定位監(jiān)測,住院觀察2 d, 并給予抗感染、止血等常規(guī)治療。
1.3 評價標準
① 有效性評價。于對照組療程結束后,綜合CT復查瘤體大小情況以及WHO實體瘤療效評價標準[8][分為完全緩解(CR)、部分緩解(PR)、疾病穩(wěn)定(SD)、疾病進展(PD), 客觀緩解率(ORR)=(CR+PR)/總例數(shù)×100%,臨床獲益率(CBR)=(CR+PR+SD)/總例數(shù)×100%]進行評價,并參照WHO制定的疼痛療效評定標準[9][分為完全緩解、部分緩解、輕微緩解、無效,臨床緩解率=(完全緩解+部分緩解)/總例數(shù)×100%]對疼痛緩解情況進行評價。② PVP手術效果評價。于術前、術后測量病變椎體前緣、椎體中線及椎體后緣高度的變化。③ 骨代謝指標。于治療前、治療后采用酶聯(lián)免疫吸附法測定Ⅰ型膠原吡啶交聯(lián)終肽(ICTP)、骨特異性堿性磷酸酶(BALP)水平。④ 血清腫瘤循環(huán)細胞(CTCs)陽性表達情況。采用富集法測定外周血中CTCs細胞含量,并以1個CTCs/7.5 mL為陽性閥值,評價2組治療前后CTCs陽性率。⑤ 安全性評價參照WHO亞急性毒性反應分級標準[10]及放射治療協(xié)作組/歐洲癌癥研究與治療組織(RTOG/EORT)放射性損傷評級標準[11]評定。
1.4 術后隨訪
所有患者持續(xù)隨訪追蹤12個月,以死亡為隨訪終點時間,囑患者治療結束后1個月行CT復查,此后CT復查頻率為每3個月1次,全身骨掃描復查頻率每6個月1次,統(tǒng)計不良反應發(fā)生率。
1.5 統(tǒng)計學分析
2 結 果
2.1 2組治療效果比較
觀察組完全緩解率、部分緩解率、客觀緩解率、臨床獲益率依次為40.00%、55.00%、95.00%、100.00%, 顯著高于對照組的2.50%、30.00%、32.50%、75.00% (P<0.05), 見表1。
2.2 2組疼痛緩解情況比較
觀察組疼痛完全緩解率、無效率以及臨床緩解率均顯著優(yōu)于對照組(P<0.05), 見表2。

表1 2組治療效果比較[n(%)]
與對照組比較, *P<0.05。

表2 2組疼痛緩解情況比較[n(%)]
與對照組比較, *P<0.05。
2.3 2組治療前后病變椎體前緣高度、椎體中線、椎體后緣變化情況比較
治療前, 2組病變椎體前緣、椎體中線及椎體后緣高度對比無顯著差異(P>0.05); 治療后, 2組病變椎體前緣、椎體中線及椎體后緣高度均顯著改善(P<0.05), 但2組組間比較差異均無統(tǒng)計學意義(P>0.05), 見表3。
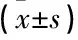
表3 2組治療前后病變椎體前緣高度、椎體中線、椎體后緣變化情況比較 mm
與治療前比較, *P<0.05。
2.4 2組治療前后骨代謝指標水平比較
治療前, 2組骨代謝指標ICTP、BALP水平比較無顯著差異(P>0.05); 治療后, 2組ICTP、BALP水平均顯著下降,且觀察組顯著低于對照組(P<0.05), 見表4。
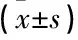
表4 2組治療前后骨代謝指標水平比較
ICTP: Ⅰ型膠原吡啶交聯(lián)終肽; BALP: 骨特異性堿性磷酸酶。
與治療前比較, *P<0.05; 與對照組比較, #P<0.05。
2.5 2組治療前后CTCs陽性表達情況比較
以1個CTCs/7.5 mL為陽性閥值,治療前2組CTCs陽性例數(shù)無顯著差異(P>0.05); 治療后, 2組CTCs陽性表達率均顯著下降,且觀察組陽性表達率顯著低于對照組(P<0.05), 見表5。

表5 2組治療前后CTCs陽性表達情況比較[n(%)]
CTCs: 血清腫瘤循環(huán)細胞。與治療前比較, *P<0.05;
與對照組比較, #P<0.05。
2.6 2組安全性比較
觀察組單個病例粒子植入個數(shù)為15~51顆,平均(36.17±8.35)顆,放射粒子平均活度為(0.72±0.10) mCi, 平均靶區(qū)接受劑量(D90)為(115.17±12.33) Cy, 術中未發(fā)生任何放射性損傷、脊髓損傷病例,僅出現(xiàn)3例少量氣胸(肺組織壓縮30%以下)及4例痰中帶血,術后48 h內(nèi)自行好轉(zhuǎn),術后1個月復查時僅發(fā)生1例白細胞減少,經(jīng)對癥干預后緩解,不良反應發(fā)生率僅為20.00%(8/40)。對照組不良反應主要表現(xiàn)為粒細胞、血小板減少、骨髓抑制及肝毒性、皮疹、惡心及嘔吐,發(fā)生率依次為42.50%、45.00%、65.00%、50.00%、15.00%、45.00%, 經(jīng)匯總對照組產(chǎn)生不良反應患者比例高達70.00%(28/40), 顯著高于觀察組的20.00%(P<0.05)。見表6。

表6 對照組不良反應發(fā)生情況[n(%)]
3 討 論
張瑋芳等[12]研究顯示,采用CT引導下125Ⅰ粒子植入治療肺癌的完全緩解率為90.70%。黃海等[13]報道,較常規(guī)化療而言, CT引導下125Ⅰ粒子植入治療在安全性、有效性上更具優(yōu)勢。125Ⅰ粒子穿透能力為1.7~2.0 cm, 醫(yī)者可通過對粒子放置位置的調(diào)整使放射劑量有效覆蓋腫瘤組織及其受浸潤組織,合理安排腫瘤組織及其周圍亞臨床區(qū)域的放射劑量,不增加脊髓及其毗鄰組織的放射性損傷,后期隨著瘤體體積縮小,粒子間距也隨之縮短,更有利于加強局部控制效果[14]。本研究中125Ⅰ粒子半衰期為60.4 d, 其釋放的放射劑量可供給1年內(nèi)殺傷腫瘤所需的95%的放射劑量,通過持續(xù)、長時程、低能力射線以達到破壞腫瘤細胞核內(nèi)DNA合成,抑制腫瘤細胞有絲分裂并誘導腫瘤細胞凋亡的目的,使腫瘤細胞周期保持在射線敏感周期,最大程度殺傷腫瘤細胞。而在放射劑量上,通過TPS系統(tǒng)可有效控制放射劑量,避免放射劑量不足難以滿足殺傷腫瘤所需的劑量,也規(guī)避超量引起的放射性損傷[15]。本研究結果顯示,治療后2組病變椎體后緣、中線及前緣高度均顯著改善,提示125Ⅰ粒子植入聯(lián)合椎體成形術安全有效[16]。
近年來,骨吸收、骨形成等骨代謝指標在肺癌骨轉(zhuǎn)移潛在風險預估、診斷及預后評估中的價值已得到充分驗證。ICTP作為三價交叉聯(lián)合參與生化指標,其免疫生化機制在血液中便能完整形成,是反映骨吸收的重要標志物,其水平與破骨細胞表達、骨轉(zhuǎn)移程度呈顯著正相關,也是唯一與癌腫骨痛相關的生化標志指標[17]。BALP不僅是反映骨形成的精確標志物,也與腫瘤組織骨性轉(zhuǎn)移累及范圍、程度顯著正相關[18]。本研究結果顯示, 2組治療后ICTP、BALP均顯著下降,提示兩種方案均能有效抑制非小細胞肺癌并椎體轉(zhuǎn)移癌病灶內(nèi)的骨代謝機制,但觀察組ICTP、BALP下降幅度更為顯著,提示125Ⅰ粒子植入對病灶內(nèi)骨吸收、骨形成機制的抑制作用更為顯著。
非小細胞肺癌并椎體轉(zhuǎn)移癌是預后極差的惡性腫瘤疾病,治療后復發(fā)轉(zhuǎn)移是該類患者死亡的主要因素。臨床研究[19]認為,腫瘤細胞的復發(fā)轉(zhuǎn)移是以血道轉(zhuǎn)移為通路,系多階段、多步驟、多功能相互或共同作用所形成的復雜病理過程,尤其是常規(guī)病理組織、細胞學乃至影像學手段都難以檢測的早期隱匿性轉(zhuǎn)移,是該類患者預后不佳的危險因素,與患者生存率具有顯著相關性。CTCs則系原發(fā)灶腫瘤細胞增加,部分腫瘤細胞可通過對黏附因子分泌的抑制作用使腫瘤細胞與原發(fā)病灶腫瘤組織脫離,破壞周邊宿主結締組織,且125Ⅰ粒子植入等診療操作行為也能使原發(fā)灶腫瘤組織醫(yī)源性擴散至外周血循環(huán),而這些腫瘤細胞最終便通過血液循環(huán)、血管內(nèi)滲、細胞學散播等生物學行為滯留于其他器官組織,形成轉(zhuǎn)移灶。因此,CTCs不僅能預測腫瘤細胞早期隱匿性轉(zhuǎn)移,也是表達腫瘤組織轉(zhuǎn)移的直接證據(jù)[20]。本研究中,治療后2組CTCs陽性表達均顯著下降,但觀察組下降幅度更為顯著,提示125Ⅰ粒子植入操作無醫(yī)源性擴散風險,對早期隱匿性病灶亦有滅殺作用,對抑制術后復發(fā)、轉(zhuǎn)移具重要意義。
綜上所述,針對非小細胞肺癌并椎體轉(zhuǎn)移癌,在PVP基礎上行CT引導下125Ⅰ粒子植入治療的安全性、客觀緩解率、臨床獲益率更佳,對疼痛的改善亦更為顯著,且不影響PVP手術療效,對骨代謝的抑制更為顯著,并能降低術后復發(fā)、轉(zhuǎn)移風險。

