淺談強酸制弱酸的應用范圍
◎趙金蓮
用一種較強的酸可以制備一種較弱的酸,是中學化學較為常見的現象,一般把這條規律總結為“強酸制弱酸”,該規律是復分解反應的一項重要應用。比如在初中化學就已經學習過將醋酸滴到大理石上制得二氧化碳氣體,說明醋酸的酸性大于碳酸,高中也學習了二氧化硫的實驗室制法,用相對較強的硫酸與亞硫酸鈉反應,也說明硫酸的酸性大于亞硫酸。但是隨著學習的深入和在做題的過程中,發現有許多同學對該規律的應用范圍理解不夠,出現了機械套用的現象。
一、問題提出
比如說在人教版化學必修1課本中提到漂白粉或漂粉精中Ca(ClO)2能與空氣中的CO2和水蒸氣發生如下反應:Ca(ClO)2+CO2+H2O=CaCO3↓ +2 HClO。學生很自然地認為碳酸的酸性強于次氯酸,因此認為漂白液中的 NaClO也能與空氣中的CO2和水蒸氣發生反應,類推的化學方程式為:2 NaClO+CO2+H2O=Na2CO3+2 HClO。很明顯這個化學方程式錯誤的,這兩個反應不同的地方在于前者生成了難溶物碳酸鈣沉淀,而后者沒有。學生很疑惑,為什么同樣是酸和鹽反應,為什么前者是碳酸鈣,后者是碳酸氫鈉呢?
二、理論分析
實際上,強酸制弱酸這條規律的提出是根據相對容易電離的酸提供了氫離子與酸性更弱的酸的酸根離子結合而得出的。根據資料得知H2CO3的電離平衡常數為Ka1=4.3×10-7,Ka2=5.6×10-11,HClO的電離平衡常數為Ka1=4.7×10-8,可以推出酸性由強到弱的順序為:H2CO3>HCIO>HCO-3,也就是說碳酸根結合H+的能力大于次氯酸根。
但是次氯酸鈣與CO2的反應中存在兩個平衡:電離平衡和沉淀溶解平衡。如下:
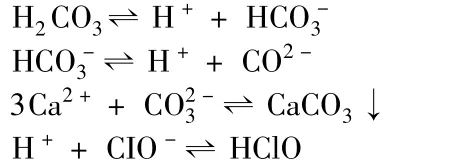
而NaCIO與CO2反應時,其產物中無沉淀物生成,這個反應只存在電離平解,根據酸的電離常數可推出NaCIO+CO2+H2O=NaHCO3+HCIO。溶液中電離出的結合H+的能力大于CIO-,因此產物應為 NaHCO3和 HCIO。
在教學過程中,還遇到一道類似的題,寫出往Na2S溶液中分別通入少量CO2和過量CO2的化學方程式。查閱資料H2S的電離平衡常數為Ka1=1.5×10-7,Ka2=7.1×10-15,可推導出酸性由強到弱的順序為:H2CO3>H2S>HCO-3>HS-。由于該反應沒有生成難溶物,因此只需考慮電離平衡,即可按照“強酸之弱酸”的規律推導:
2 Na2S+CO2(少量)+H2O=Na2CO3+2 NaHS
Na2S+2 CO2(過量)+2 H2O=2 NaHCO3+H2S
三、結論與啟示
從以上舉例均可看出,“強酸制弱酸”的經驗規律有一定的局限性。當該反應中只存在電離平衡時,可以按“強酸制弱酸”的規律進行推導,但當反應中還存在沉淀溶解平衡參與競爭時,就必須先考慮生成難溶物,比如說將H2S通入CuSO4溶液中可以生成強酸H2SO4和不溶于酸的難溶物CuS,正是生成了難溶物CuS從體系中脫離出,否則該反應不可能發生。因此,“強酸制弱酸”的原理并不是萬能的,需要深入理解。

