鱉甲煎丸對AngⅡ-ROS誘導下HSC-LX2細胞中PKC-Pyk2/SRC通路的影響
浙江中醫藥大學 杭州 310053
肝纖維化以肝星狀細胞(hepatic stellate cells,HSC)的活化、增殖為主要特征,是慢性肝炎向肝硬化發展的重要病理過程。HSC的活化受氧化應激(oxidative stress,OS)、血管緊張素Ⅱ(angiotensinⅡ,AngⅡ)等諸多因素的影響,是肝纖維化發生的中心環節[1]。研究表明,生物體內活性氧簇(reactive oxygen species,ROS)引起的OS在肝纖維化形成中扮演了重要角色[2],而蛋白激酶 C(protein kinase C,PKC)在細胞的 OS反應過程中起重要作用[3-5],富含脯氨酸的酪氨酸激酶2(proline-rich tyrosine kinase 2,Pyk2)則參與了 AngⅡ誘導的血管平滑肌細胞蛋白合成,與心臟間質纖維化密切相關[6-7],SRC也被認為是AngⅡ調節細胞內信號的關鍵成員。在血管平滑肌細胞中SRC以ROS依賴的方式被G蛋白激活,并調節諸如Pyk2、兩面神激酶(Janus kinases,JAK)/信號傳導與轉錄激活子(signal transduction and activator of transcription,STAT)等下游信號。這些跡象提示,PKC、Pyk2、SRC很可能也參與了肝纖維化的發生發展。
本課題組前期研究發現,《金匱要略》所載鱉甲煎丸及其改良劑型鱉甲煎口服液能夠通過防止肝細胞變性、壞死;清除肝纖維化誘因;抑制HSC增殖;降低纖維化大鼠血漿中的腎素、AngⅡ、醛固酮活性;減少AngⅡ誘導HSC氧化應激時產生的羥自由基及單線態氧自由基等機制,從而抑制肝纖維化的發生與發展[8-11]。
據此,筆者進一步提出假設,在肝纖維化形成早期階段,AngⅡ誘導ROS作為初始的刺激因素,通過激活有PKC、Pyk2、SRC等諸多因子參與的信號網絡,最終導致HSC增殖,以致形成肝纖維化。鱉甲煎丸能有效抑制肝纖維化的發生、發展,可能與其對該網絡中的關鍵節點的干預有關。本研究采用MTT、熒光探針DCFH-DA、Western blot及血清藥理學等研究方法,觀察鱉甲煎丸含藥血清對AngⅡ誘導的ROS作用下HSC-LX2細胞的增殖情況以及對PKC、Pyk2、SRC蛋白表達情況的影響,以初步探討其干預機制。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物和細胞 清潔級雄性SD大鼠50只,體質量180~200g,購買于上海西普爾必凱實驗動物有限公司[實驗動物生產許可證號:SCXK(滬)2013-2016],飼養于浙江中醫藥大學動物實驗研究中心[實驗動物使用許可證號:SYXK(浙)2013-0184]。5只/籠,25℃恒溫,光照12h/d,普通飼料喂養。人源肝星狀細胞HSC-LX2購于北京北納創聯生物技術研究院。
1.1.2 主要實驗試劑和藥品 活性氧檢測試劑盒、BCA蛋白濃度測定試劑盒均購自Solarbio公司(批號:CA1410、PC0020);二甲基亞砜(dimethyl sulfoxide,DMSO)購自 Vetec 公司(批號:V900090);SDSPAGE凝膠配制試劑盒、二抗羊抗兔、內參β-actin均購自華安生物公司(批號:WK001、HA1001、CT36001);Anti-Pyk2抗體、Anti-SRC 抗體、Anti-PKC alpha+beta 2+gamma抗體均購自Abcam公司(批號:[E354]ab32448、[EPR5496]ab109381、[EPR18104]ab184746);二硫蘇糖醇(DL-dithiothreitol,DTT)購自弗德生物公司(批號:FD0011);RPMI1640培養基購自 HyClone公司(批號:SH30809.01);Beyo ECL plus購自碧云天公司(批號:P0018);胎牛血清購自Diagnovum公司(批號:D154-500mL)。
鱉甲煎丸購自國藥集團中聯藥業有限公司(批號:Z42020772);依那普利購自揚子江藥業集團江蘇制藥股份有限公司(批號:H32026567)。
1.1.3 主要儀器設備 MK-10干式恒溫器購于杭州奧盛儀器有限公司;L500臺式低速自動平衡離心機購于長沙湘儀離心機儀器有限公司;MCO-15AC型二氧化碳培養箱為日本SANYO公司產品;AE200倒置生物顯微鏡購于Motic公司;imark全自動酶標儀為Bio-Rad公司產品;CLiNX掃膜儀購于Science Instruments公司。
1.2 實驗方法
1.2.1 含藥血清的制備 大鼠以隨機數字表法分成5組:鱉甲煎丸高、中、低劑量組,依那普利組及空白組。根據預實驗結果,鱉甲煎丸高、中、低劑量組分別選用60kg成人每日總服用量的20、10、5倍。鱉甲煎丸以0.9%氯化鈉溶液溶解,高、中、低劑量組分別予12g/kg·d、6g/kg·d、3g/kg·d 灌胃給藥,灌胃體積 10mL/kg;依那普利組以10mg/kg·d劑量的依那普利溶液灌胃[11],空白組以等量0.9%氯化鈉溶液灌胃。各組均灌胃2次/d,連續給藥7d。末次給藥1h后,各組大鼠均在無菌條件下經腹腔靜脈取血,4℃、3 000r/min離心20min分離血清,56℃滅活 30min,0.22μm 微孔濾膜過濾,-20℃凍存備用。
1.2.2 MTT法測定鱉甲煎丸含藥血清對細胞增殖的影響 按前期研究方法[9]培養細胞,取對數生長期的HSC-LX2 細胞制成單細胞懸液,以 1×103~1×104個/孔的密度接種于96孔板,每孔終體積為100μL。將細胞分為AngⅡ組、依那普利組、鱉甲煎丸高、中、低劑量組、空白血清組。各組以含10%胎牛血清的RPMI 1640培養基37℃培養24h,使細胞貼壁,向每孔加入新鮮制備的、經濾膜濾過除菌的10-5mol·L-1AngⅡ處理1h,鱉甲煎丸高、中、低劑量組、依那普利組均分別設有4個濃度梯度,分別按5%、10%、15%、20%的終濃度加入相應的含藥血清,空白血清組加入空白組大鼠血清,AngⅡ組加入胎牛血清。各組細胞繼續置于37℃、5%CO2培養箱孵育 24、48、72h 后,每孔加入5mg·mL-1MTT 20μL,37℃培養 4h后,徹底吸棄上清液,向每孔中加入150μL DMSO,置于搖床上振蕩10min,充分溶解藍紫色的甲臜沉淀,570nm波長檢測各孔吸光度值OD,代表細胞的增殖情況。
1.2.3 熒光探針DCFH-DA檢測細胞內ROS含量變化 收集對數生長期的HSC-LX2細胞,制成單細胞懸液,以5×105個/mL的密度接種于24孔板,每孔500μL。培養24h后,將其分為空白對照組(培養液)、AngⅡ組、依那普利組、鱉甲煎丸高、中、低劑量組和空白血清組。除空白對照組外,其余各組均以10-5mol/L AngⅡ處理1h,分別給予胎牛血清、依那普利含藥血清、10%鱉甲煎丸高、中、低劑量含藥血清及空白組大鼠血清。作用24h后,以PBS沖洗3次,去除細胞培養基,加入適當體積的DCFH-DA,DCFH-DA按照1:1000比例以無血清培養基稀釋,終濃度為10μmol·L-1,37℃孵育20min。再以無血清培養基洗滌3次,充分去除未進入細胞內的DCFH-DA。熒光共聚焦顯微鏡觀察HSC-LX2細胞內的ROS,顏色越深,表明ROS生成量越多。
1.2.4 Western blot法檢測PKC-Pyk2/SRC通路中相關蛋白的表達 將細胞分為AngⅡ組、依那普利組、鱉甲煎丸高、中、低劑量組和空白血清組。先用10-5mol·L-1AngⅡ處理24h,然后分別予以各血清作用24h。參照前期研究[9]方法提取各組細胞總蛋白,BCA蛋白定量,制膠。根據蛋白定量結果,上樣、電泳、轉膜。稀釋一抗(PKC 1:1 000、Pyk2 1:500、SRC 1:10 000、β-actin 1:5 000),二抗(羊抗兔 lgG,稀釋比例1:2 000),室溫下搖床孵育2h。脫色、覆膜后利用凝膠成像系統掃描蛋白條帶,以目的蛋白與β-actin蛋白條帶灰度比值表示蛋白表達水平。
1.3 統計學分析 應用 GraphPad Prism 5.0統計軟件進行統計學分析,計量資料以±s表示,兩組間比較用t檢驗,多組間比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 各組HSC-LX2細胞增殖活性比較 實驗結果顯示,各組中AngⅡ組與空白血清組細胞增殖活性無統計學差異(P>0.05)。與AngⅡ組比較,處理24h后,5%鱉甲煎丸高、中劑量組顯著抑制HSC-LX2細胞增殖(P<0.05,P<0.01),10%、15%、20%鱉甲煎丸各劑量組細胞增殖活性差異無統計學意義(P>0.05)。見圖1。處理48h后,與AngⅡ組比較,5%鱉甲煎丸高、中、低劑量組均顯著抑制細胞增殖活性(P<0.05,P<0.05,P<0.01);15%鱉甲煎丸高劑量組可顯著抑制HSCLX2細胞增殖活性(P<0.05);10%、20%鱉甲煎丸各劑量組細胞增殖活性差異無統計學意義(P>0.05)。見圖2。培養72h后,與AngⅡ組比較,5%鱉甲煎丸中劑量組顯著抑制細胞增殖活性(P<0.01),10%、15%、20%鱉甲煎丸各劑量組細胞增殖活性差異無統計學意義(P>0.05)。見圖 3。
2.2 各組HSC-LX2細胞ROS含量比較 采用熒光共聚焦顯微鏡直接觀察HSC-LX2細胞內ROS含量的變化,ROS的表達在HSC-LX2細胞的細胞質中表現為綠色的熒光顆粒,綠色越深,分布越密集,表明ROS含量越高。空白對照組綠色熒光顆粒顏色較淺,分布散在、稀疏;與空白對照組比較,AngⅡ組綠色熒光顆粒顏色加深,分布較密集;依那普利組綠色熒光顆粒明顯少于AngⅡ組,且分布稀疏;鱉甲煎丸高劑量組綠色熒光顆粒密集程度與空白對照組和依那普利組相似,但顏色略淡;鱉甲煎丸中劑量組綠色熒光顆粒略多,且顏色加深;低劑量組,綠色熒光顆粒較明顯,密集程度與AngⅡ組相似;空白血清組綠色熒光顆粒顏色不深,分布較為稀疏。見圖4。說明與空白對照組比較,AngⅡ組ROS含量明顯提高;與AngⅡ組比較,依那普利組、鱉甲煎丸高、中劑量組ROS含量降低,低劑量組的變化不大。
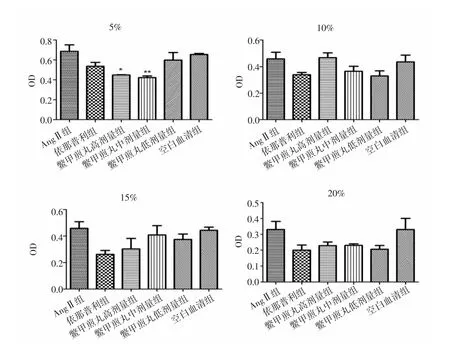
圖1 作用24h后各組HSC-LX2細胞增殖活性比較Fig.1 Comparison of proliferation activity of HSC-LX2 cell in each group after treatment of 24h
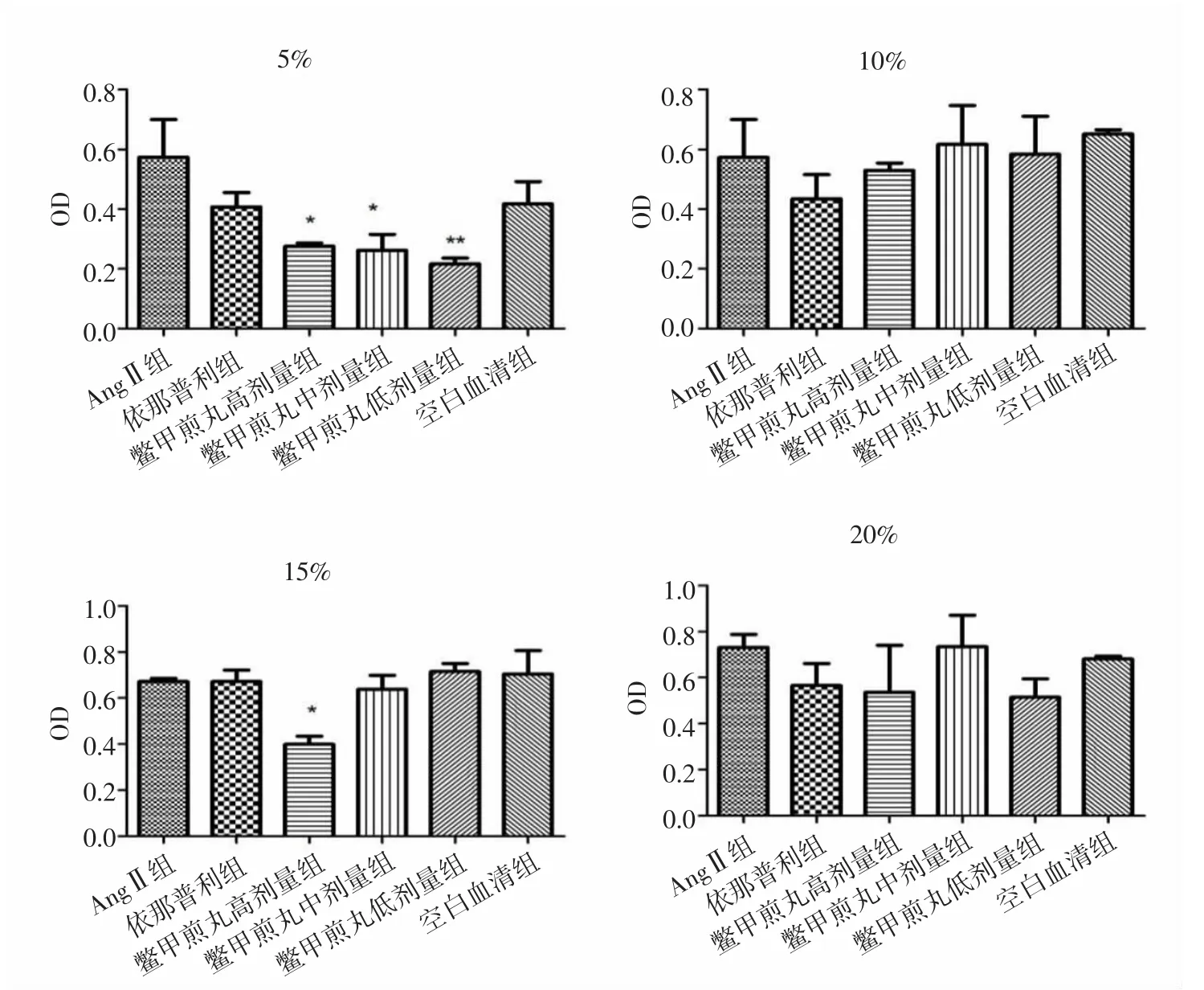
圖2 作用48h各組HSC-LX2細胞增殖活性比較Fig.2 Comparison of proliferation activity of HSC-LX2 cell in each group after treatment of 48h
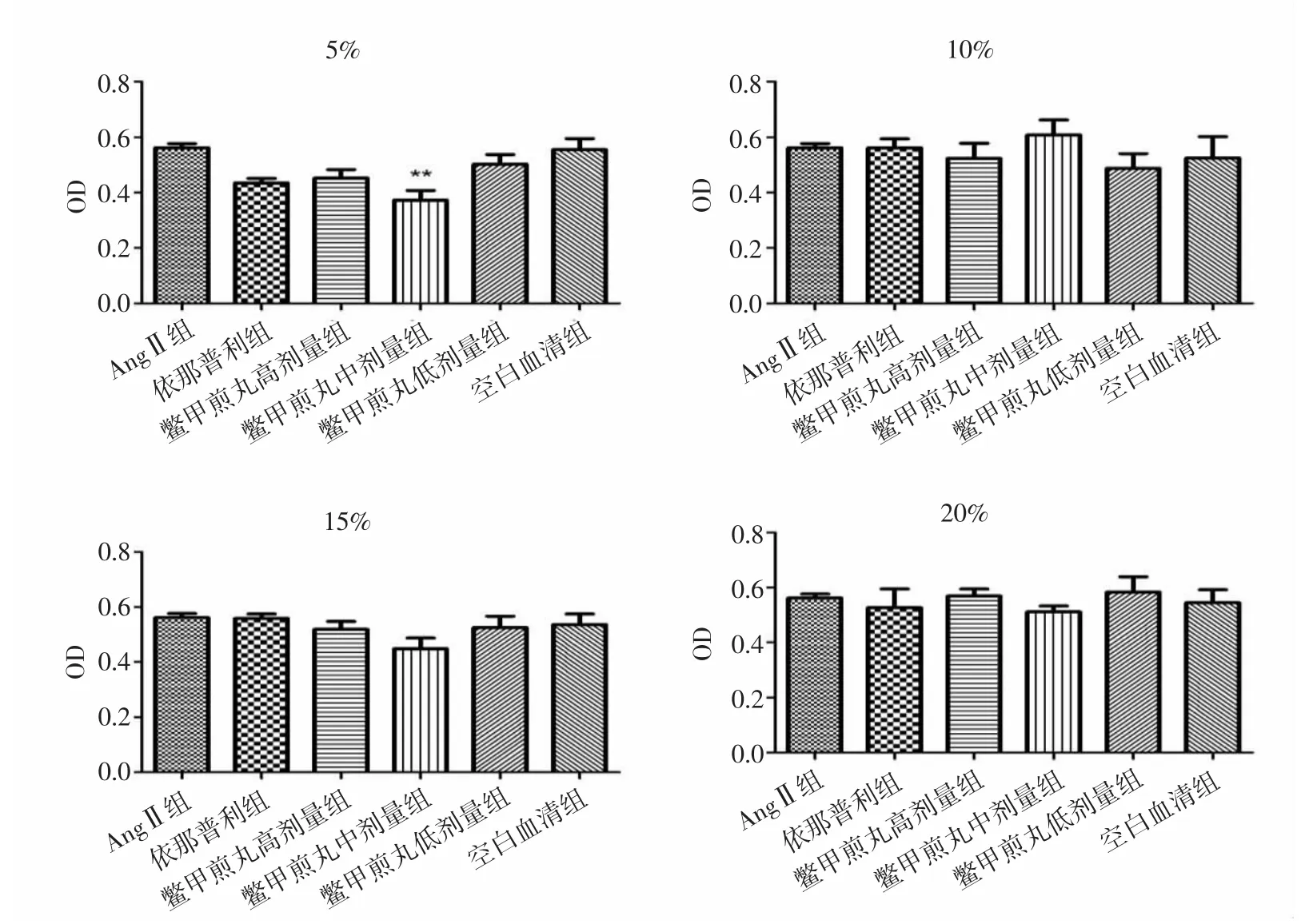
圖3 作用72h后各組HSC-LX2細胞增殖活性比較Fig.3 Comparison of proliferation activity of HSC-LX2 cells in each group after treatment of 72h
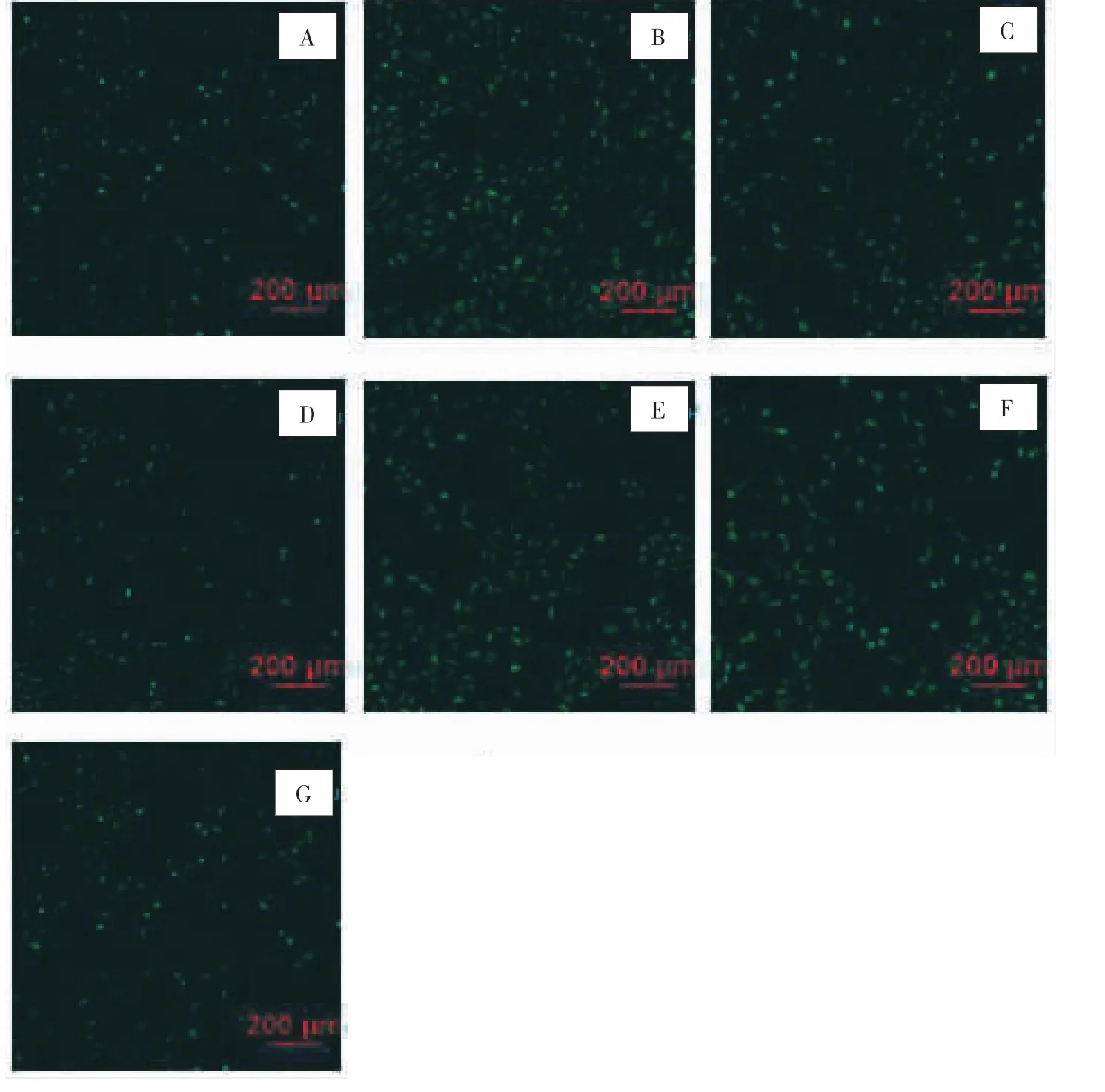
圖4 熒光共聚焦顯微鏡檢測HSC-LX2細胞內ROS含量Fig.4 Fluorescence confocal microscopy to detect ROS content in HSC-LX2 cell
2.3 各組HSC-LX2細胞PKC、Pyk2、SRC蛋白表達比較 與空白血清組比較,鱉甲煎丸高、中、低劑量組PKC 表達減低(P<0.001,P<0.001,P<0.001);與 AngⅡ組比較,鱉甲煎丸高、中、低劑量組PKC表達差異無統計學意義(P>0.05)。與空白血清組比較,鱉甲煎丸中、低劑量組 Pyk2 的表達減低(P<0.01,P<0.001);與 AngⅡ組比較,鱉甲煎丸高、中、低劑量組Pyk2的表達明顯減低(P<0.05,P<0.001,P<0.001)。與空白血清組比較,鱉甲煎丸高、中、低劑量組SRC表達明顯減低(P<0.001,P<0.001,P<0.01);與 AngⅡ組比較,鱉甲煎丸高、中劑量組SRC表達減低(P<0.05,P<0.05)。見圖 5。
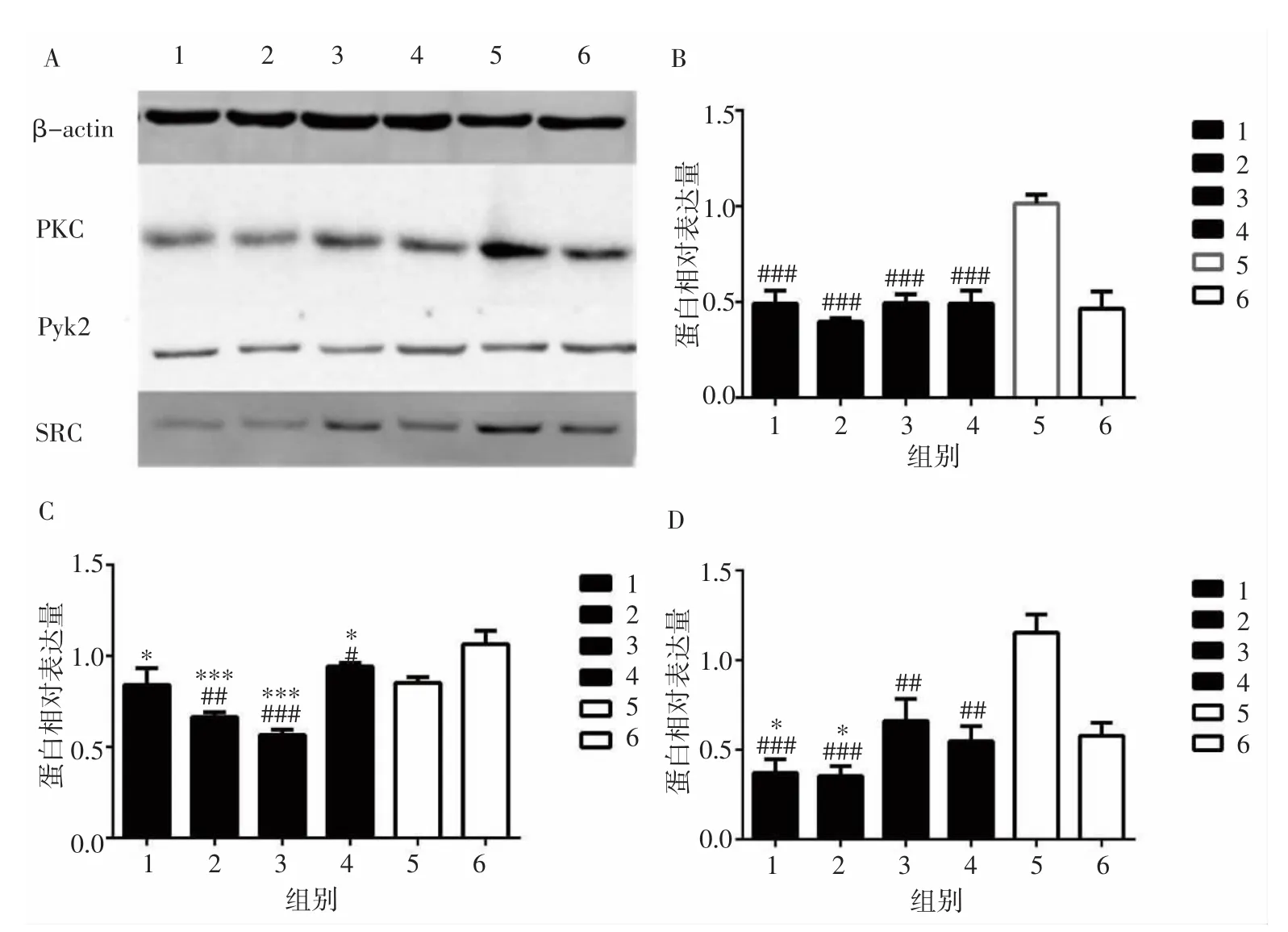
圖5 各組HSC-LX2細胞PKC、Pyk2、SRC蛋白表達比較Fig.5 Comparison of protein expression of PKC,Pyk2 and SRC in each group
3 討論
肝纖維化是多種原因引起的慢性肝損害所致的病理改變,表現為肝內細胞外間質成分異常沉積,并影響肝臟的功能,是慢性肝病發展到肝硬化的必經階段,其病因大致可分為感染性、先天性代謝缺陷、化學毒物性、自身免疫性肝病等。目前認為,HSC的激活是肝纖維化發生的中心環節,抑制HSC的激活和轉化為肌成纖維細胞是抗纖維化研究的熱點。對慢性肝臟疾病動物模型的研究已證實了疾病發展過程中存在著氧化應激作用。還有研究證實,AngⅡ在肝纖維化的發生發展中起著重要的作用,可促進肝纖維化的形成[12]。
為了探索AngⅡ對HSC-LX2細胞產生ROS的影響,筆者采用AngⅡ刺激HSC-LX2細胞,通過熒光共聚焦顯微鏡觀察,結果顯示,與空白對照組比較,AngⅡ組ROS產生明顯增多,經鱉甲煎丸高、中劑量組含藥血清干預后,ROS均不同程度減少。這提示AngⅡ可以誘導HSC-LX2細胞產生ROS,鱉甲煎丸對此具抑制作用。
為了觀察鱉甲煎丸對HSC-LX2細胞增殖活性的影響是否存在時效、量效關系,筆者選用不同濃度(5%、10%、15%、20%)的高、中、低劑量鱉甲煎丸含藥血清,分別干預HSC-LX2細胞24、48、72h,用MTT法觀察細胞增殖。結果顯示,與AngⅡ組比較,5%鱉甲煎丸含藥血清培養24h后,高、中劑量組顯著抑制HSC-LX2細胞增殖;48h后,高、中、低劑量組均能顯著抑制HSC-LX2細胞增殖;72h后,中劑量組有顯著抑制效果。此外,除了15%中劑量鱉甲煎丸含藥血清培養48h后有顯著抑制效果,其余各組、各時間段均無顯著抑制作用。由此可見,5%含藥血清干預48h的增殖抑制作用最明顯,各劑量組之間沒有呈現出量效關系。究其原因主要有以下兩方面:一方面含藥血清制備尚無統一的給藥方案[13],本研究采用不同劑量鱉甲煎丸連續灌胃7d,2次/d的方法,然后取血制備含藥血清。經過大鼠機體的代謝,各劑量組血藥濃度是否仍有明顯差異,尚不確定。另一方面培養液中含藥血清的濃度過高有可能反而降低細胞對藥物的敏感性。從本研究的結果看,5%的含藥血清濃度較為適宜。
AngⅡ能夠刺激HSC-LX2細胞產生ROS并增殖,涉及的環節錯綜復雜。PKC、Pyk2和SRC很可能也參與其中。PKC屬于絲氨酸/蘇氨酸蛋白激酶家族,廣泛存在于機體的組織細胞內,它被多種因素激活后,可通過磷酸化下游蛋白、激活蛋白激酶和誘導幾種核轉錄因子的表達,從而影響細胞的OS反應[3-5]。Western blot結果顯示,AngⅡ組中胎牛血清對PKC表達的抑制較明顯,空白血清組的PKC表達明顯增強。經鱉甲煎丸含藥血清干預后,PKC的表達同樣受到抑制。結合ROS及MTT的結果可知,PKC參與了AngⅡ-ROS誘導HSC-LX2細胞增殖過程,鱉甲煎丸可抑制PKC的表達。
Pyk2是粘著斑激酶FAK家族重要成員之一,參與絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、JAK/STAT、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶 B(protein kinase B,PKB/AKT)等多條信號通路的傳遞,調節著細胞的生長、分化、凋亡和黏附等生理過程。在AngⅡ的刺激下,Pyk2是多種細胞信號途徑的一種上游調節因子,參與了AngⅡ誘導的血管平滑肌細胞蛋白合成,有望成為心臟間質纖維化防治的新靶點[14-15]。本研究結果提示,與空白血清組比較,AngⅡ組Pyk2表達增強,經鱉甲煎丸含藥血清干預后,Pyk2蛋白表達受到抑制。結合ROS及MTT的結果,筆者認為Pyk2也參與了AngⅡ-ROS誘導HSC-LX2細胞增殖過程,可以將其作為防治肝纖維化的潛在靶點,而鱉甲煎丸對其表達具有抑制作用。
SRC被認為是AngⅡ調節胞內信號的關鍵成員。在血管平滑肌細胞中SRC以ROS依賴的方式被G蛋白激活,并調節諸如Pyk2、JAK/STAT等下游信號。在AngⅡ作用下,Pyk2和SRC、PI3K等共同導致了細胞生長及局部黏附。ROS能夠以直接或間接的方式激活SRC,SRC反過來通過一系列的信號通路對ROS具有調節作用,許多研究已經表明SRC能夠呈正反饋地促進ROS的生成[16-17]。本研究結果提示,與AngⅡ組比較,SRC對空白血清組中的大鼠血清更敏感,而鱉甲煎丸含藥血清對SRC表達有顯著的抑制作用。結合ROS及MTT的結果,筆者認為SRC是AngⅡ-ROS誘導HSC-LX2細胞增殖的促進因素,而鱉甲煎丸可抑制其表達。
綜合分析實驗結果,筆者得出以下結論:AngⅡ可以誘導HSC-LX2細胞產生ROS,繼而影響PKC、Pyk2、SRC蛋白的表達,最終促進細胞的增殖。鱉甲煎丸可通過抑制ROS的產生,下調PKC、Pyk2、SRC蛋白的表達,從而抑制HSC-LX2細胞的增殖。PKC、Pyk2、SRC諸蛋白在其中的調控機制,將在后續研究中采用siRNA技術予以探討。

