中藥健脾益肺方對EAAT2表達的影響
李惠珍, 任展能, 李雅青, 楊碧瑩*, 杜寶新
(1.廣州中醫藥大學 第二臨床醫學院, 廣州 510000;2.廣東省中醫院, 廣州 510000)
肌萎縮側索硬化(amyotrophic lateral sclerosis,ALS),又名運動神經元病,是一種破壞性的神經退行性疾病,引起上、下運動神經元損害,運動功能喪失,最終導致患者死亡。目前該疾病病因未明,關于其發病存在較多假說,現階段普遍接受的是谷氨酸介導的興奮性神經毒性;JPYF方是廣東省中醫院腦病四科杜寶新主任團隊研發治療ALS的經驗復方,本課題組數十年的前期臨床研究發現,JPYF方從肺脾論之對ALS患者有改善疾病預后的趨勢,一定程度上延緩疾病進展;前期的基礎研究發現,JPYF方對ALS轉基因小鼠起到延緩體重下降,延緩臨床發病時間,延長生存期,改善運動能力的作用,但均未進一步闡明其分子生物學機制。近30年來,多數學者認為谷氨酸的興奮性毒性是導致神經元退行性變性、死亡的核心內容[1]。谷氨酸是中樞神經系統含量最高、分布最廣、作用最強的興奮性神經遞質,其合成、釋放和回收均依靠谷氨酸轉運體及其相關分子完成谷氨酸-谷氨酰胺這一循環[2]。EAAT2是清除突觸間隙谷氨酸的主力軍,在維持谷氨酸穩態和保護神經元起重要作用。研究發現,EAAT2的下調或功能失調,將引起多種神經變性疾病,如癲癇、AD、ALS等[3]。為進一步探討谷氨酸興奮性毒性在ALS發病機制中的作用,本研究擬通過觀察JPYF方對谷氨酸誘導幼鼠皮層星形膠質細胞EAAT2的表達及對元代脊髓神經元的影響,探討ALS的發病機制及JPYF方的作用機理。
1 材料和方法
1.1 實驗材料
1.1.1 實驗動物
孕14~16 d SPF級SD母鼠(15只),體重290~350 g,由南方醫科大學實驗動物中心提供[SYXK(粵)2013-0094],待產,取新生24 h內幼鼠以提取大腦皮層星形膠質細胞;取胎鼠以提取脊髓神經元。無菌手術在廣東省中醫院科學院動物實驗中心生物安全柜進行[SCXK(粵) 2013-0002]。本實驗由廣東省中醫院動物倫理中心審核動物倫理:倫理編號2017039。
1.1.2 JPYF方組成及凍干粉制備
黃芪30 g,黨參15 g,云苓10 g,白術15 g,五味子10 g,菟絲子10 g,麥冬10 g,陳皮5 g,法夏6 g,制馬錢子0.2 g,甘草6 g等均來自本院中藥房,購于康美藥業。雙蒸水(沒過藥物)浸泡3 h,煮沸1 h,10層紗布過濾,收集濾液;再加雙蒸水(沒過藥渣),煮沸40 min,10層紗布過濾后合并濾液,濾液回旋冷凝濃縮,收集濃縮液,冷凍干燥得凍干粉,以兩劑生藥(222.4 g),制得206.2 g凍干粉;-80℃保存,備用。體外實驗藥液配制:稱取1 g中藥凍干粉加入20 mL無血清DMEM/F12培養基中,配置濃度為50 g/L的母液,震蕩至完全溶解,0.22 μm針頭濾器過濾,4℃保存備用,每次母液使用周期不超過1周。
1.2 主要試劑與儀器
NeurobasalTMMedium培養基、谷氨酰胺、多聚賴氨酸(10888022、25030081、P1399)購自SIGMA;B-27(17504044)購自LIFE;FBS(1600044)購自GIBCO;馬血清(SH30074.03)購自Hyclone;GFAP、EAAT2、ChAT抗體(ab7260、ab41621、ab18736)購自Abcam;NEUN抗體(MAB377)購自Chemicon millipore公司;谷氨酸試劑盒(A074)購自南京建成;培養基A配制:89% DMEM/F12+10% FBS+1%雙抗;培養基B配制:90% DMEM/F12+5% FBS+4%馬血清+1%雙抗;培養基C配制:96.5% NeurobasalTM+2% B27+1%谷氨酰胺+0.5%雙抗。
冷凍干燥機ALPHA2-4/LSC(德國 Martin Christ公司); Countstar 型細胞計數儀 (美國 Inno-Alliance Biotech 公司);多功能酶標儀Victor X5(美國Perkin Elme公司);奧林巴斯光學顯微鏡SZ61(日本Olympus光學工業株式會社);TS-1000 型脫色搖床(其林貝爾儀器制造有限公司)。
1.3 實驗方法
1.3.1 星形膠質細胞、神經元原代分離、提取與培養
取新生24 h內SD幼鼠,斷頭處死,仔細提取大腦皮質組織;胰酶+DNA酶消化20 min,取上清經200目細胞篩過濾,重復3次;收集濾液,離心,懸液;差速貼壁30 min,取上清,重懸后調整密度到1×106/mL,于含有培養基A的培養瓶中培養,每3 d換液。培養至10 d左右將細胞至于37℃恒溫搖床24 h,去除小膠質細胞及其他雜質細胞,收集純化細胞傳代備用。
取胎齡16天的SD孕鼠,麻醉、消毒,立即取出串珠樣子宮放入預冷培養基B中;參考上述步驟取胎鼠脊髓,調節密度1×105/mL,每孔0.1 mL接種到96孔板,每孔7×105接種于6孔板細胞爬片上(取材前一天用50 μmol/mL多聚賴氨酸包被4 h,晾干,PBS洗3次后烘干備用),2 h后補足培養液,4~6 h后更換培養基C;之后每3 d半量換液。
1.3.2 IF法鑒定星形膠質細胞、神經元
收集對數生長期的星形膠質細胞種板于共聚焦培養皿中(或培養至6~7 d的神經元細胞爬片),次日PBS搖洗3次,每次10 min,4%多聚甲醛固定,0.3%曲通室溫通透20 min,搖洗,10%山羊血清室溫封閉60 min;一抗(星形膠質:GFAP (1∶1500);神經元:ChAT(1∶500))4℃過夜;復溫,搖洗后,加入對應種屬二抗(FITC(1∶200)和cy3(1∶300))37℃孵育1 h;DAPI染核5 min,搖洗;風干,滴加熒光淬滅劑,晾干后共聚焦顯微鏡下觀察。
1.3.3 MTT法檢測星形膠質細胞活力
調整星形膠質細胞密度每孔1×104接種于96孔板,24 h后,吸去培養液,加入含JPYF方的培養液A預處理24 h(終濃度0.25、0.5、1 g/L) 分別為B、C、D組, PBS沖洗后處理同A組;谷氨酸(A)組:加入含谷氨酸培養液(250 μmoL/L培養4 h;對照(E)組:正常培養相應時間的星形膠質細胞,每組均6個復孔。藥物作用足夠時間后,去培養液,加入每孔110 μL含5% MTT的培養基,4 h后,吸去培養基加入每孔150 μL DMSO,震蕩混勻10 min,570 nm 波長檢測吸光度A,按照以下公式:細胞存活率=(A加藥組-A空白組) /(A正常組-A空白組) ×100%計算細胞活力。
1.3.4 IF法檢測EAAT2的熒光強度
將星形膠質細胞每孔2萬接種于共聚焦培養皿,48 h后,分組處理同MTT法,藥物作用時間足夠后,進行IF法檢測,(一抗EAAT2 (1∶500)),二抗(cy3(1∶500))。
1.3.5 Western blot法檢測EAAT2蛋白的表達
將星形膠質細胞以每孔5×105接種于6孔板,分組處理同MTT法。藥物作用時間足夠后,吸去原培養液,PBS沖洗2次,每孔加入30 μL裂解液,充分裂解,刮板,收集裂解液,渦旋離心取上清,BCA測蛋白濃度,按每孔40 μg蛋白樣品,加入10%十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)中電泳,轉膜,5%牛奶封閉60 min,洗凈封閉液,加入一抗(1∶1000)4℃過夜。次日加入二抗(1∶2000)孵育60 min。在PVDF膜上加入適量ECL顯影液,用Image Lab顯影成像并進行數據分析。
1.3.6 紫外比色法測定谷氨酸濃度
將星形膠質細胞以每孔5×105接種于6孔板,分組處理同MTT法。藥物作用時間足夠后,收集各組上清培養液;嚴格按照谷氨酸試劑盒操作方法,取各組上清液、雙蒸水、谷氨酸標準應用液各50 μL于96孔板,每組6個復孔,加入按比例配置好的工作液150 μL,混勻,340 nm 波長檢測各孔吸光度A1,每孔加入2 μL配置好的試劑五,充分混勻后,37℃孵育40 min,340 nm 波長檢測各孔吸光度A2;按照以下公式:谷氨酸濃度(μmol/L)=(測定A2值-測定A1值)-(空白A2值-空白A1值)/(標準A2值-標準A1值)-(空白A2值-空白A1值)*標準品濃度(200 μmoL/L)*樣品測試前稀釋倍數。
1.3.7 IF法檢測神經元存活情況
取各組培養基上清作用于培養至6~7 d的神經元,培養4 h后,按IF法檢測各組神經元存活情況。
1.4 統計學方法
采用SPSS 23.0統計學軟件先進行方差分析和齊性檢驗,當滿足正態分布及方差齊性時,采用單因素方差分析;若不滿足采用非參數檢驗。以P<0.05為差異有統計學意義,所有指標至少重復3次。
2 結果
2.1 IF法鑒定原代星形膠質細胞和神經元細胞
傳至第三代的星膠細胞,核呈圓球形常位于中央,胞突豐富,分支長而多,細胞之間聯系緊密;運用GFAP特異性染色,FITC標記成綠色所占DAPI核染比例為96%以上,結果見圖1。
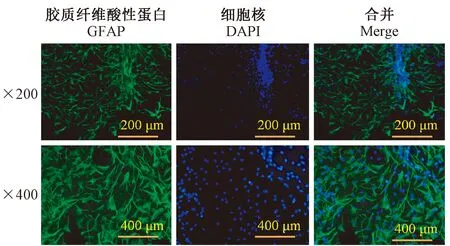
圖1 熒光鏡下觀察、鑒定原代星形膠質細胞(IF, × 200,×400)Figure 1 Observation and identification of primary astrocytes under a fluorescence microscope
培養至6 d的脊髓神經元,細胞數量穩定,核大而圓,胞體飽滿,立體感強,折光性好,突起細長,各細胞之前有聚集生長趨勢,軸突緊密聯系,Cy3標記紅色所占DAPI核染比例為90%以上,結果見圖2。
2.2 MTT法檢測星形膠質細胞活力
與正常組比較,谷氨酸造模組細胞存活率明顯降低(P<0.01),與造模組比較,不同濃度的JPYF方預處理組差異均具有統計學意義(P<0.01),并在0.25~1 g/L濃度范圍內呈濃度依賴,詳見表1、圖3。
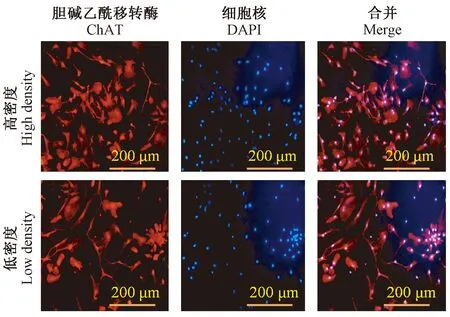
圖2 熒光鏡下觀察、鑒定原代神經元細胞(IF, × 200)Figure 2 Observation and identification of primary neuronal cells under a fluorescence microscope
表1 不同分組星形膠質細胞存活率
注:與正常組比較,bP<0.01;與模型組比較,dP<0.01。
Note. Compared with the normal group,bP<0.01. Compared with the model group,dP<0.01.
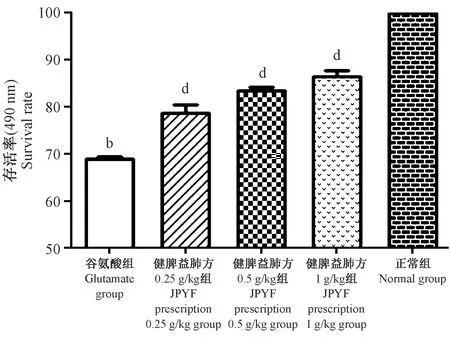
注:與正常組比較,bP<0.01;與模型組比較, dP<0.01。圖3 谷氨酸對星形膠質細胞活力的影響Note.Compared with the normal group, bP<0.01. Compared with the model group, dP<0.01.Figure 3 Effect of glutamate on the astrocyte viability
2.3 EAAT2蛋白表達情況
2.3.1 IF法檢測EAAT2蛋白熒光強度
與造模組比較,不同濃度JPYF方預處理組蛋白熒光強度比差異均具有統計學意義(P<0.05,P<0.01),提示JPYF方可增加EAAT2蛋白的表達。詳見表2,圖4。
2.3.2 Western blot法檢測EAAT2蛋白表達
JPYF方預處理24 h,谷氨酸作用4 h后,對照組EAAT2蛋白有一定基礎表達,JPYF方組從0.25 g/L開始,隨著濃度增加,EAAT2蛋白表達依次提高,差異均具有統計學意義(P<0.01),提示JPYF方可提高EAAT2蛋白水平。詳見圖5、圖6。
2.4 各組星形膠質細胞培養基上清谷氨酸濃度測定
與谷氨酸組比較, JPYF方預處理組上清谷氨酸濃度隨JPYF方濃度增高而下降,差異具有統計學意義(P<0.05,P<0.01),但均高于正常組。詳見表3、圖7。
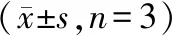
表2 IF法檢測EAAT2蛋白熒光強度
注:與正常組比較,bP<0.01;與模型組比較,dP<0.01。
Note. Compared with the normal group,bP<0.01. Compared with the model group,dP<0.01.

圖4 熒光鏡下觀察各組EAAT2蛋白表達Figure 4 Expression of EAAT2 protein in each group was observed under a fluorescence microscope
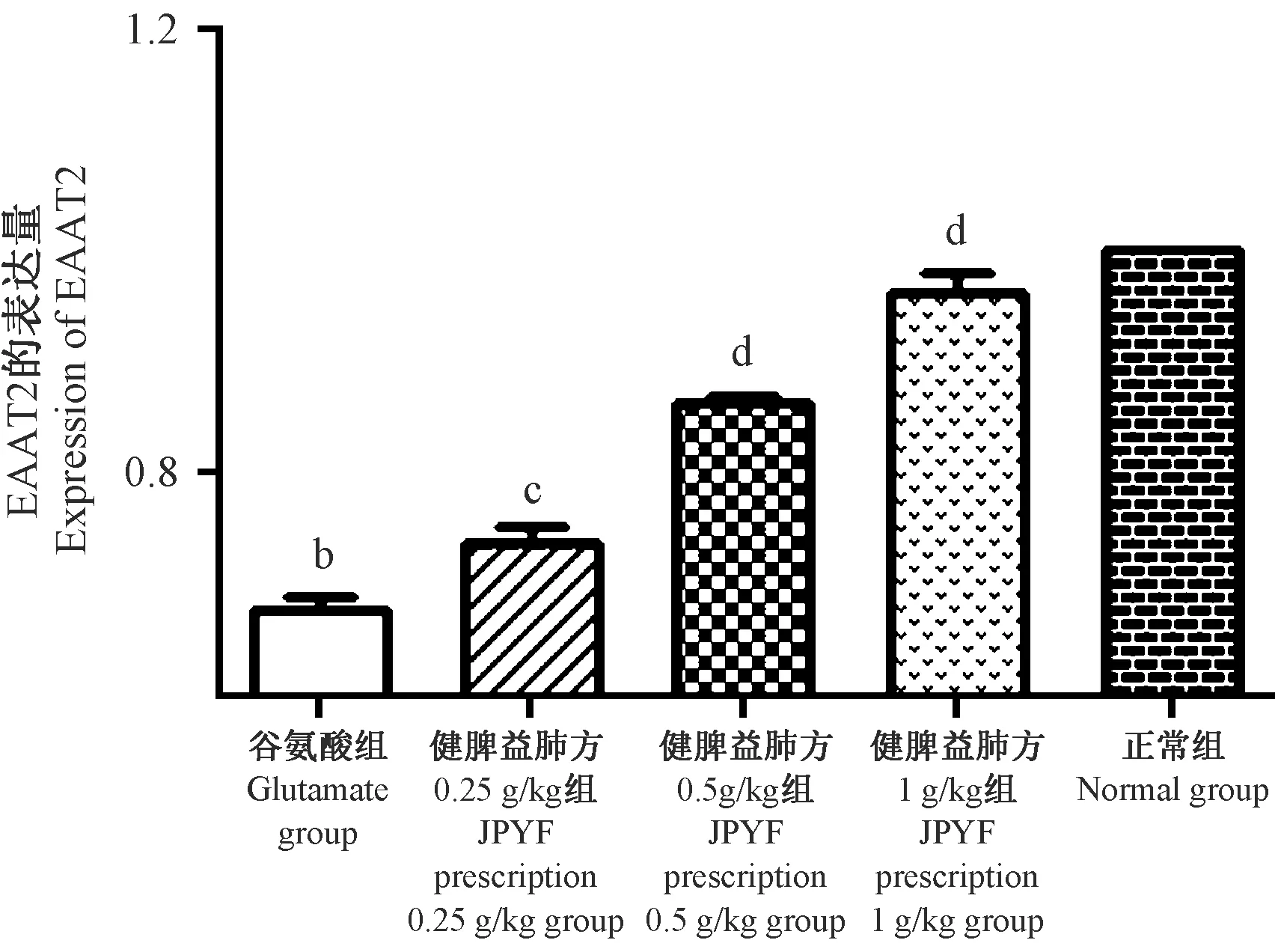
注:與正常組比較,bP<0.01;與模型組比較,cP<0.05, dP<0.01。圖5 Western blot法檢測EAAT2蛋白表達水平Note. Compared with the normal group,bP<0.01.Compared with the model group,cP<0.05, dP<0.01.Figure 5 Determination of EAAT2 protein expression levels by Western blotting
2.5 各組星形膠質細胞培養基上清對原代脊髓神經元細胞的影響
與造模組比較,不同濃度JPYF方預處理組神經元存活個數差異均具有統計學意義(P<0.05,P<0.01),提示健脾益肺方可提高EAAT2活性及蛋白水平,降低細胞外液谷氨酸含量,減少谷氨酸興奮性毒性,從而保護神經元。詳見表4、圖8。
3 討論
本課題組結合自身臨床經驗及查閱ALS相關古籍發現該病以肺脾兩虛為主者居多,中醫認為“脾主肌肉,主四肢”,“肺主氣,司呼吸”, 脾為肺之母,肺為脾之子,故參考《脾胃論》補中益氣湯和《備急千金要方》補肺湯自擬治療ALS的經驗方;JPYF方以黃芪、黨參為君,補益肺脾之氣緩解臨床出現肢體肌無力、肌萎縮,氣短的患者,臣以白術、茯苓、麥冬補脾氣而生肺氣;佐以健脾理氣化痰之陳皮、
圖6 星形膠質細胞EAAT2蛋白的表達Figure 6 Expression of EAAT2 protein in the astrocytes
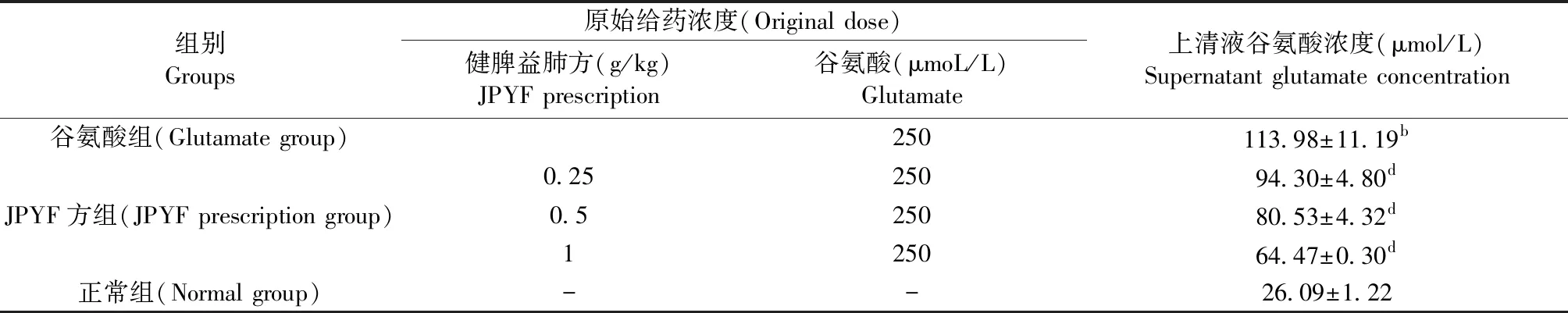
組別Groups 原始給藥濃度(Original dose)健脾益肺方(g/kg) JPYF prescription谷氨酸(μmoL/L)Glutamate 上清液谷氨酸濃度(μmol/L)Supernatant glutamate concentration 谷氨酸組(Glutamate group)250113.98±11.19b0.2525094.30±4.80dJPYF方組(JPYF prescription group)0.525080.53±4.32d125064.47±0.30d正常組(Normal group)--26.09±1.22
注:與正常組比較,bP<0.01;與模型組比較,dP<0.01。
Note.Compared with the normal group,bP<0.01. Compared with the model group,dP<0.01.
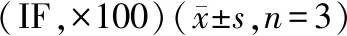
表4 熒光鏡下觀察不同原始給藥濃度組上清液對脊髓神經元細胞影響
注:與正常組比較,bP<0.01;與模型組比較,cP<0.05,dP<0.01。
Note.Compared with the normal group,bP<0.01. Compared with the model group,cP<0.05,dP<0.01.
法夏,使補而不膩,射干、杏仁宣肺利咽、開音散結,馬錢子健脾益氣,強肌,諸藥合用,已達健脾補肺強肌之效,前期臨床及基礎研究多有見效[4-6];現代研究證明,中藥可減輕谷氨酸興奮性毒性,黃芪可明顯改善谷氨酸損傷后細胞的活性[7],黃芪益母草注射液、人參皂甙R均可減輕神經興奮毒性[8-9]。
肌萎縮側索硬化是一種主要累及上、下運動神經元的進行性致死性神經變性疾病,病變主要損害脊髓前角細胞、腦干運動神經元,臨床表現為進行性加重的肌萎縮、無力,80%~90%的患者于發病后3~5年因呼吸衰竭死亡[10]。目前該病發病機制尚不清楚,有學者發現ALS 患者血漿和腦脊液中谷氨酸水平較正常人高[1],在 ALS 模型小鼠的脊髓中也發現谷氨酸水平升高的情況[11],認為ALS的發病與谷氨酸興奮性毒性密切相關。谷氨酸是中樞神經系統中主要的興奮性神經遞質,胞外谷氨酸的代謝再循環只能依靠谷氨酸轉運體(EAATs)來完成,EAATs分子的作用是通過再攝取來調節胞外谷氨酸的濃度,并因此保持胞外靜息狀態1~3 μmol/L的谷氨酸濃度[12]。EAAT2 是腦內興奮性氨基酸轉運體中最主要的轉運蛋白,負責中樞神經系統90%的谷氨酸再攝取,其表達主要在星形膠質細胞胞膜上[13]。研究發現通過翻譯活化提高EAAT2表達,可以保護培養的神經元免受谷氨酸介導的興奮毒性損傷和死亡,延遲ALS動物模型運動功能的下降和延長其壽命[14]。Rothstein等表示在ALS患者的尸解中谷氨酸鹽的功能性運輸減少和EAAT2免疫反應性降低[15-16],并且轉基因小鼠中EAAT2的消耗會直接導致神經元死亡[17]。Chen等組合編碼EAAT2、GDH2和NRF2的慢病毒三者協同作用可延緩ALS轉基因小鼠的疾病發展及改善小鼠運動功能和神經科量表評分[18]。
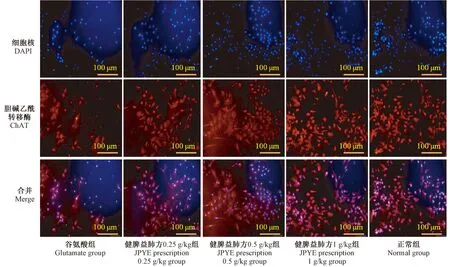
圖8 上清液處理后脊髓神經元存活情況Figure 8 Survival of the spinal cord neurons after supernatant treatment
因此,本課題組不斷從轉運體的角度研究能夠調節谷氨酸水平的方藥,提高谷氨酸轉運體的表達并維持其功能,從而有利于神經元的保護。通過建立谷氨酸誘導的體外星形膠質細胞損傷模型探索JPYF方對谷氨酸轉運蛋白-2(EAAT2)表達的影響及可能機制。結果發現,JPYF方在一定范圍內可顯著保護星形膠質細胞,提高谷氨酸轉運蛋白2的表達,降低細胞外液谷氨酸濃度,減少神經元損害;然而,在實驗中發現,在誘導體外星形膠質細胞損傷模型時,給予人體正常胞外水平的谷氨酸濃度并不能成功建立星形膠質細胞損害模型,與正常組比較,細胞存活情況、形態及EAAT2的表達與正常組比較均無顯著差異,這與相關文獻報道提示突觸傳遞過程中,囊泡釋放的Glu可使突觸間隙的濃度由靜息的1 μmoL/L升高到1.1 mmol/L,而維持在此峰值的時間僅約為1.2 ms相符合[19];故研究人員篩選出適合本課題組實驗的最佳給藥時間4 h及濃度250 μmoL/L;星形膠質細胞和神經元細胞均表達攝取谷氨酸的載體,星形膠質細胞的攝取是清除突觸間隙谷氨酸的主要途徑,只有當谷氨酸溢出時,神經元的谷氨酸載體才發揮作用,引起谷氨酸興奮性毒性;本課題組在檢測培養基上清谷氨酸濃度時發現正常組谷氨酸濃度高于體內正常胞外靜息狀態水平,這可能與基礎培養基谷氨酸水平含量相關,而該濃度仍在溢出濃度之內。
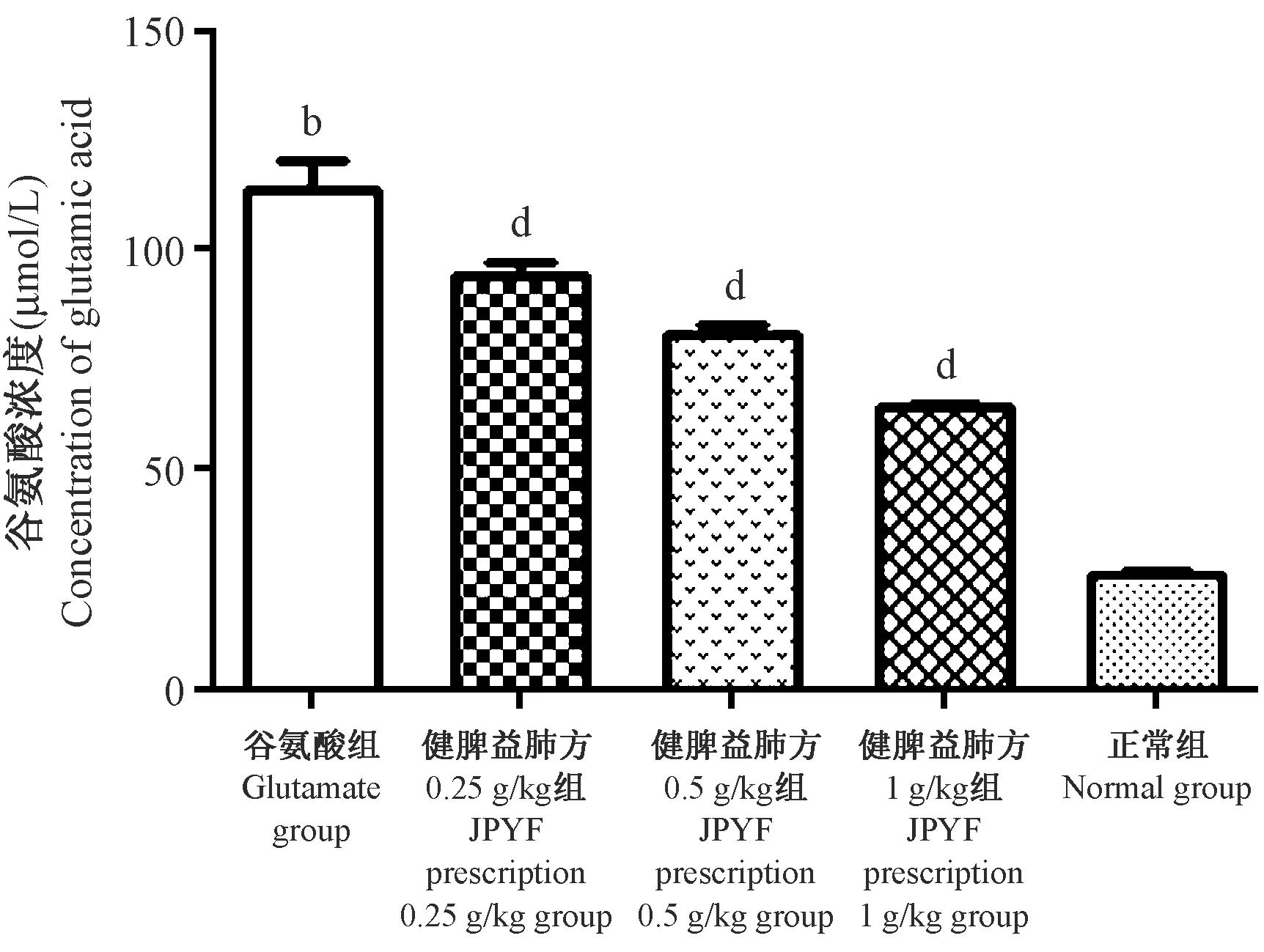
圖7 紫外比色法檢測各組培養基上清谷氨酸濃度Figure 7 Concentrations of glutamic acid in each medium determined by UV colorimetric assay
綜上所述,JPYF方(0.25~1 g/L)呈濃度依賴的增加谷氨酸誘導的星形膠質細胞膜上EAAT2蛋白水平,降低谷氨酸濃度,保護培養的神經元免受谷氨酸介導的興奮毒性損傷和死亡。在今后的實驗研究中,本課題組將會深入探索健脾益肺方對ALS的作用機制,期望研究成果為臨床應用提供理論與實驗基礎,為ALS患者的綜合治療提供新的選擇。

