111In標記的博來霉素復合物用于鑒別裸鼠高級和低級別膠質瘤的實驗研究
王明霜, 唐 禹, 陳 躍, 馮 悅, 趙 巖, 陳 琳
(1.西南醫科大學附屬醫院核醫學科,核醫學與分子影像四川省重點實驗室,瀘州 646000 ; 2.四川大學原子核科學技術研究所,成都 610000)
膠質瘤是最常見的原發性腦腫瘤,占腦中所有惡性腫瘤的80%。 在美國,神經膠質瘤的平均發病率為每10萬人6.61(6.57%~6.6%)和2003年至2011年[1]。 膠質瘤起源于腦膠質細胞,根據其細胞類型根據組織學表現和生物分子狀態進行分類,最常見于星形細胞瘤或少突神經膠質瘤,并根據其等級,低級(I-II級)或高級(III -IV級)[2]。成人低級別膠質瘤的10年生存率約為43%[3]。據報道,少突膠質細胞瘤與星形細胞瘤相比具有相對更有利的結果。與I級和II級膠質瘤相比,III級膠質瘤預后明顯更差[4]。最常見的顱內腫瘤,即IV級膠質瘤,也稱為膠質母細胞瘤,中位生存期為15個月[5]。準確評估腫瘤分級和類型對于最佳治療計劃至關重要。腫瘤的診斷,分類和分級是建立在活檢或切除,與相當大的風險相關,包括死亡,特別是在大腦的中央區域[6]。此外,活組織檢查或亞全切除術的診斷可能受到樣本不具代表性的限制,導致腫瘤分級的下降[7],甚至可能會誤導治療計劃,采取更保守的策略。 此外,不能手術或不愿接受手術或腫瘤位于雄辯區域的患者可能不適合進行外科手術,即使他們有資格接受包括化療和/或放療在內的輔助治療。
因此,即使目前沒有理想的成像技術,也非常需要術前對腦腫瘤進行分級的替代方法,其中PET顯像作為合理的替代方案。本研究合成111In-博來霉素復合物(111In-labeled bleomycin complex,111In-BLMC),并用作SPECT掃描的追蹤劑,觀察高級別和低級別膠質瘤的差異,現將方法和結果報告如下:
1 材料和方法
1.1 實驗材料
SPF 級3月齡雄性 SD 大鼠 34 只,,由西南醫科大學實驗動物中心[SCXK(川)2013-17],飼養于西南醫科大學實驗動物中心實驗室[SYXK(川)2013-181]。實驗前在實驗室飼養1周適應新環境。對大鼠進行分組:實驗組 22 只,對照組12只。
SHG44細胞和U251細胞膠質瘤細胞株購自于中國科學院上海細胞庫;其他物品均由西南醫科大學實驗動物中心提供。111In-BLMC是由13個色譜不同的亞基組成,并由西南醫科大學附屬醫院提供。用于放射標記前,111In-BLMC溶于生理鹽水,配制成2 mg/mL,并通過緩沖液調成pH值為7.35~7.45。該研究得到了西南醫科大學附屬醫院倫理委員會同意并執行,并有簽訂知情同意書。
1.2 實驗方法
1.2.1 細胞培養
SHG44細胞和U251細胞膠質瘤細胞于1640培養基(添加10% 胎牛血清)培養。依據培養瓶細胞代謝產物及細胞密度給予換液及傳代。接種細胞前,用0.25%胰酶消化并吹散細胞,吸出消化液,并加入含1% 瓊脂糖的無血清1640培養基為細胞懸浮, 細胞懸液終濃度為1×106/mL。
1.2.2 裸鼠成瘤實驗
選擇裸鼠腋下接種,接種前用0.5%碘伏對進針部位進行消毒。實驗組裸鼠接種的細胞懸液為SHG44膠質瘤細胞,對照組接種的細胞懸液為U251細胞。穿刺注射器排除空氣,吸入0.2 mL細胞懸液,從進針部位向前穿刺大約1 cm,進行皮下注射。并每日測量一次裸鼠的腫瘤的體積,每次每只小鼠測量兩次取平均值,并做詳細記錄,實驗周期為首次治療劑量給藥后的第16天,實驗結束后處死所有的腫瘤小鼠,取出腫瘤組織進行稱重,按組記錄,取平均值。實驗結束后,每組隨機抽取小鼠3只(包括實驗組、對照組),進行病理切片顯微鏡觀察。
1.2.3 顯像方法
在進行掃描前,要求裸鼠禁食至少6 h以上。注射111In-BLMC前囑咐所有服用加入過氯酸鉀100 mg的飲用水。通過尾靜脈注射111In-BLMC后,進行22幀動態序列(6×10 s,4×15 s,2×30 s,2×60 s,2×150 s和6×300 s),然后重建2個靜態FET PET幀整個腦在10~30 min(FET10-30)和20~40 min(FET20-40)。對于所有圖像,應用默認隨機,散射和死區時間校正以及基于低劑量CT的衰減校正。
1.2.4 圖像結果處理
腦實質出現放射性物質可定義為異常放射性濃聚,除腦室內脈絡膜外。選擇腫瘤部位放射性濃聚最明顯的橫斷面斷層圖像,確定ROI。并采用鏡影技術,在對側相同部位勾畫相同形狀和大小的區域。分別對早期相和延遲相顯像進行半定量分析。在OM線橫斷面上取1幀腫瘤放射性濃聚最明顯的圖像,確定腫瘤ROI并將對側鏡面部位定為本底,以L/N分別計算111In-BLMC早期和延遲相攝取指數,并計算滯留指數(RI)。RI=延遲攝取指數/早期攝取指數。
1.3 統計學方法
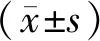
2 結果
2.1 基本資料
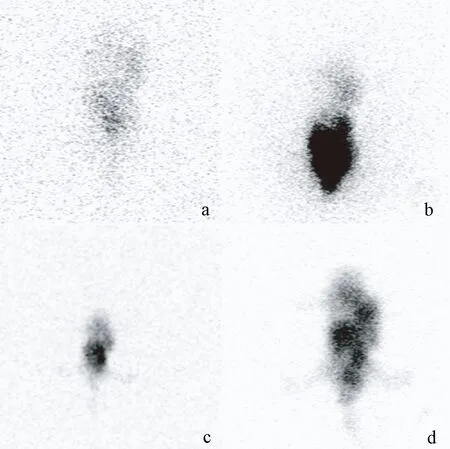
34只腦膠質瘤裸鼠均接種成功,術后組織學提示實驗組22只裸鼠為高級別膠質瘤,2周后裸鼠的腫瘤體積為(567±124)mm3,對照組12只為低級別膠質瘤,2周后裸鼠的腫瘤體積為(531±108)mm3。U251細胞接種的裸鼠為對照組,SHG44細胞接種的裸鼠為實驗組,兩組的鼠齡、性別、體重指數、腫瘤體積均無統計學差異。
2.2 攝取、滯留指數與腦膠質瘤組織學關聯
111In-BLMC標記所有的SPECT均為陽性,見圖1所示。在低級別膠質瘤組中(a和c組),早期和延遲相111In-BLMC攝取指數和滯留指數分別(1.59±1.68)和(2.99±1.36),在高級別膠質瘤組中(b和d組),早期和延遲相111In-BLMC攝取指數和滯留指數分別(3.47±1.66)和(5.193±1.49);如圖2所示,有統計學差異(均P<0.01)。
注:a和c為對照組裸鼠(低級別膠質瘤),其中a為24 h后111In-BLMC標記的SPECT結果,c為72 h后111In-BLMC標記的SPECT結果;b和d為實驗組裸鼠(高級別膠質瘤),其中b為24 h后111In-BLMC標記的SPECT結果,d為72 h后111In-BLMC標記的SPECT結果。圖1 111In-BLMC標記的SPECT在實驗組和對照組腦膠質瘤裸鼠的結果Note. a and c are control nude mice (low grade glioma). a is the SPECT result of 111In-BLMC labeling after 24 h. c is the SPECT result of 111In-BLMC labeling after 72 h. b and d are the experimental group of nude mice (high-grade glioma). b is the SPECT result of 111In-BLMC labeling after 24 h. d is the SPECT result of 111In-BLMC labeling after 72 h.Figure 1 Results of 111In-BLMC-labeled SPECT in nude mice with glioma in the experimental group and the control group
2.3 攝取、滯留指數診斷高級別腦膠質瘤的ROC曲線
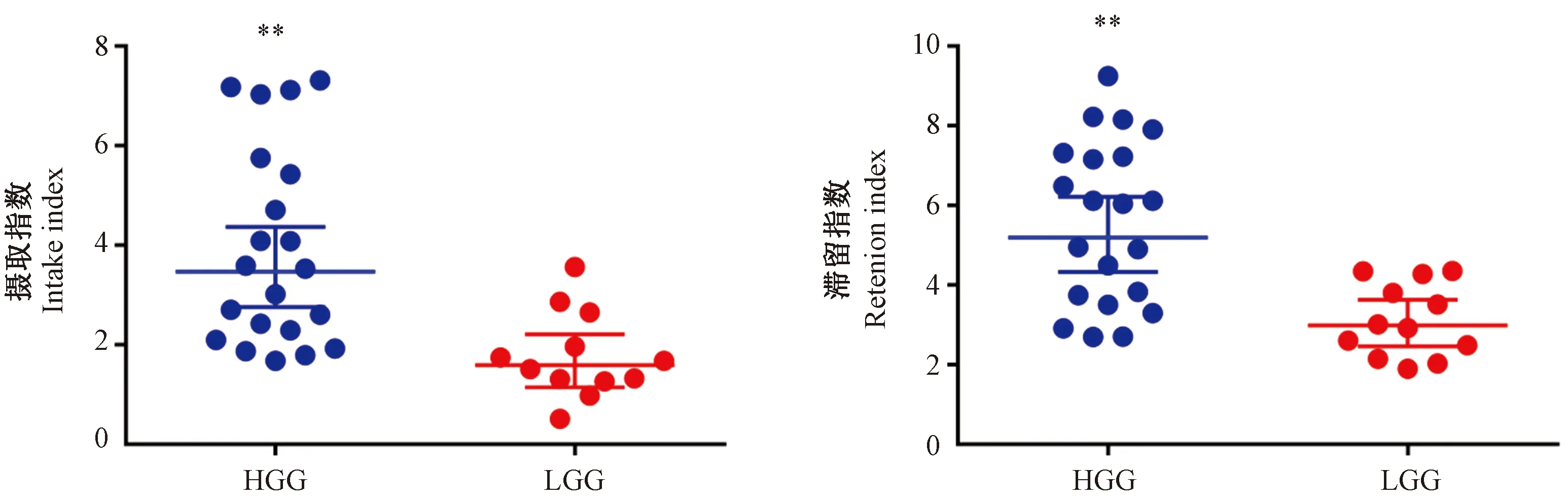
為進一步探討111In-BLMC標記所有裸鼠的SPECT診斷膠質瘤的敏感性和特異性,研究人員將進行ROC曲線分析,當攝取指數< 1.898時,診斷低級別膠質瘤的敏感性為66.67%,特異性為85.71%(P<0.01);當滯留指數< 3.155時,診斷低級別膠質瘤的敏感性為58.33%,特異性為63.66%(P<0.01),ROC曲線如圖3所示。
3 討論
注:HGG:高級別膠質瘤,LGG:低級別膠質瘤,與LGG比較,**P<0.01。圖2 不同級別膠質瘤的攝取和延遲指數Note. HGG,High-grade glioma. LGG,Low-grade glioma. Compared with the LGG group, **P<0.01.Figure 2 Uptake and delay index of the gliomas of different grades
圖3 攝取指數和滯留指數診斷膠質瘤的ROC曲線Figure 3 ROC curve of uptake index and retention index in the diagnosis of glioma
SPECT顯像是現代診斷腫瘤的重要手段之一,腫瘤顯像分子探針可以分為兩大類,非特異性陽性顯像與特異性腫瘤顯像[8]。18F-FDG是現階段用于PET腫瘤診斷的重要的非特異性正電子顯像劑,但是由于其選擇性低,特異性不強,不具有靶向性,在現代腫瘤診斷中已經不能滿足臨床需要。特異性腫瘤正電子顯像劑,由于可以與腫瘤受體特異性結合,在腫瘤診斷中更具有特異性與準確性。癌癥病人早診斷早治療是降低患者危害的最佳辦法,因此靶向的顯像劑與靶向抗腫瘤藥物正是最佳選擇[9]。腫瘤細胞中過度表達的受體是診斷和治療腫瘤的一個潛在靶點。通過檢測腫瘤細胞中受體的表達程度可以準確對腫瘤進行診斷、分期、監測治療效果等。所以新型靶向顯像劑的研發已經成為了當今最熱門的話題之一。
111In是通常用于閃爍顯像的放射性核素(t1/2∶2.81 d,172和247keV光子發射),平均每個衰變發射14.7個俄歇電子(平均能量:0.46 keV),也可能適合放療。具有< 2 keV的平均能量的俄歇電子是在組織中具有亞細胞路徑長度(2~500 nm)的高LET輻射。俄歇電子發射放射性藥物當細胞內化到細胞質中時對細胞具有高度毒性,特別是如果摻入到DNA中可能導致染色體損傷,并且已經被認為是腫瘤的放射治療劑。111In與多種納米粒子如DTPA-A5-CCPM、DTPA-CCPM、DOTA/Cy5.5/Herceptin等形成的復合物在體內有著良好的分布,通過SPECT/NIRF成像可以觀察到高腫瘤積聚和強的腫瘤與正常組織的對比,用于小鼠腫瘤的多模態成像[10-12]。
BLMC在生理和病理生理條件下啟動內在的凋亡途徑。發現BLM表達的降低與腫瘤促進和自身免疫相關,而過度表達抑制腫瘤生長和耐藥性,因為癌細胞抑制BLMC表達和穩定性。除了其在正常的動態平衡的作用,BLMC已經成為腫瘤發生的調節中的球員,因此獲得關注,作為一個合理的目標化療。BLMC表達和穩定性的調節在多個層面復雜和調節,轉錄,轉錄后,翻譯后(優選通過磷酸化和泛素化),表觀遺傳(通過啟動子乙酰化或甲基化),包括miRNA。此外,可以利用對BLMC表達和穩定性的控制來增強化學療效,克服耐藥性并選擇抗癌藥物方案,因為各種化療劑利用BLMC作為細胞死亡的執行者[13]。由于其有效的抗腫瘤活性,許多BH3模擬物例如ABT-737,ABT-263,obatoclax,AT-101和A-1210477已被開發并進入臨床試驗。更有可能的是,在不久的將來,控制BLMC表達和穩定性的策略最終導致基于BLMC的用于癌癥治療的治療方案。
111In與BLMC通過一定條件形成穩定的復合物后,由于其二者本身對腫瘤具有的殺傷性,同時對某些腫瘤的特異性結合,使其能夠在腫瘤的瘤體內停滯一定的時間,達到腫瘤顯影以及一定的治療作用,SPECT的圖像清晰,病灶定位準確,所以這種復合顯像劑在臨床診斷方面具有其自身的優勢。癌癥的死亡率偏高,究其主要原因是靶向性顯像劑品種少和早期F18-FDG診斷不靈敏,同時靶向抗癌藥物少。所以研發診斷腫瘤的特異性顯像劑尤為重要,著手以BLMC進行111In標記,從而得到新的腫瘤靶分子影像探針,確定他們的結構表征與藥代動力學參數。通過在不同腫瘤動物模型上進行SPECT顯像,確定其在不同腫瘤中的構效關系,篩選出最優靶向性最高的特異性腫瘤[14-15]。并為將來將其進行轉化醫學研究做好基礎工作,豐富腫瘤的顯像診療一體化。并將其應用于臨床,提高腫瘤患者的生存率。
本實驗結果也證實使用111In-BLMC對于在低級別和高級別腦膠質瘤患者中出現了很好的追蹤差異。低級別腦膠質瘤顯示出少量或基本不吸收,而在高級別腦膠質瘤顯示出顯著的吸收。這可能意味著111In-BLMC能夠優先與高級別膠質瘤表達的相關蛋白結合,從而出現較大的差異。
綜上,研究人員認為111In-BLMC能夠作為SPECT的追蹤劑,從而區別高級別和低級別腦膠質瘤,進而為臨床診斷和術前提供參考價值。

