腫瘤酸度響應(yīng)高分子藥物載體研究進(jìn)展
孫春陽(yáng)綜述,于春水審校
(天津醫(yī)科大學(xué)總醫(yī)院醫(yī)學(xué)影像科,天津市功能影像重點(diǎn)實(shí)驗(yàn)室,天津300052)
高分子納米藥物載體系統(tǒng)具有獨(dú)特的尺寸,可以通過(guò)鍵合、包載或囊封方式負(fù)載并保護(hù)化療藥物分子,提高藥物的體內(nèi)穩(wěn)定性,避免藥物在血液中被快速清除;此外,高分子納米載體可以借助腫瘤血管的增強(qiáng)通透性和滯留效應(yīng)(Enhanced Permeability and Retention effect,EPR effect) 改變藥物的體內(nèi)分布、被動(dòng)地增強(qiáng)藥物病灶富集、降低給藥劑量和毒副作用[1-3]。由于在腫瘤治療中體現(xiàn)出的巨大潛力,納米載藥系統(tǒng)長(zhǎng)期以來(lái)一直是研究領(lǐng)域的熱點(diǎn),以DOXIL?、力樸素為代表的納米藥物已經(jīng)進(jìn)入臨床,并獲得了相當(dāng)?shù)氖袌?chǎng)份額[4-6]。
盡管藥物載體系統(tǒng)經(jīng)過(guò)近十幾年的發(fā)展,取得了長(zhǎng)足進(jìn)步,但大量的基礎(chǔ)研究結(jié)果表明,現(xiàn)有納米載體還存在很多缺陷:如腫瘤細(xì)胞攝取量低、腫瘤滲透性差和藥物釋放速度不足等,嚴(yán)重制約載體療效的提升[7-9]。
近年來(lái),研究人員逐漸發(fā)現(xiàn),腫瘤組織由于更加旺盛的生理活動(dòng),存在與正常組織完全不同的微環(huán)境[10]。這其中,弱酸性環(huán)境是腫瘤組織和腫瘤細(xì)胞都具有的特異性環(huán)境。腫瘤細(xì)胞的能量需求高,會(huì)以更高的效率吸收葡萄糖促進(jìn)自身快速生長(zhǎng),而葡萄糖的利用方式主要是產(chǎn)能效率低下的糖酵解作用。與此同時(shí),細(xì)胞會(huì)產(chǎn)生并外排大量乳酸,造成腫瘤組織基質(zhì)呈現(xiàn)弱酸性,一般認(rèn)為,腫瘤組織基質(zhì)的pH值為6.5~7.2[11]。另一方面,為了維持酸性水解酶活性,腫瘤細(xì)胞內(nèi)內(nèi)涵體或溶酶體表面會(huì)表達(dá)特殊的轉(zhuǎn)運(yùn)蛋白,以泵入氫離子,從而將pH環(huán)境維持在 5.0~5.5 范圍[12]。
綜上所述,腫瘤細(xì)胞普遍性的生理活動(dòng)造成了腫瘤組織基質(zhì)和細(xì)胞內(nèi)的弱酸性環(huán)境。這種生理基礎(chǔ)十分穩(wěn)定,在多種腫瘤細(xì)胞系中均有所報(bào)道。因此,基于其設(shè)計(jì)構(gòu)建pH敏感高分子載藥系統(tǒng),有望解決藥物體內(nèi)輸送的多重屏障,實(shí)現(xiàn)更好的治療效果。近年來(lái),該研究領(lǐng)域已有較大進(jìn)展,本文將這些工作進(jìn)行綜述。
1 腫瘤基質(zhì)酸度促進(jìn)納米載體組織滲透
當(dāng)納米顆粒經(jīng)EPR效應(yīng)進(jìn)入腫瘤組織后,其尺寸大小是影響腫瘤滲透和組織深部給藥的決定性因素。大尺寸顆粒(100~400 nm)的體內(nèi)循環(huán)時(shí)間長(zhǎng),EPR效應(yīng)受益性好,但無(wú)法進(jìn)入腫瘤深層組織;小顆粒的腫瘤滲透性更好,但在系統(tǒng)給藥后易被迅速清除,缺乏長(zhǎng)血液循環(huán)和腫瘤富集性能。已有研究證明,腫瘤酸度可調(diào)控納米顆粒尺寸,在正常生理環(huán)境下,其尺寸約為100 nm;而當(dāng)外部刺激源出現(xiàn),顆粒收縮或崩解,產(chǎn)生小尺度顆粒,完成腫瘤滲透。例如,Wang等[13]將聚酰胺胺(PAMAM)樹(shù)枝狀分子鍵合于100 nm尺度的納米顆粒表面,在腫瘤組織pH條件,橋聯(lián)化學(xué)鍵CDM發(fā)生降解,PAMAM從大顆粒表面釋放。激光共聚焦顯微鏡觀察發(fā)現(xiàn),攜載鉑類(lèi)藥物的PAMAM分子可以在BxPC-3腫瘤模型中具有更優(yōu)越的滲透能力,從而更好地抑制腫瘤生長(zhǎng)(圖 1)。
進(jìn)而,他們還設(shè)計(jì)了超敏聚乙二醇-聚甲基丙烯酸2-(六甲撐亞胺)乙酯-聚酰胺胺嵌段聚合物(PEG-PAEMA-PAMAM/Pt),在 pH 7.4 環(huán)境下,聚合物可組裝形成80 nm的納米顆粒,在PEG殼層保護(hù)下實(shí)現(xiàn)體內(nèi)長(zhǎng)循環(huán);在進(jìn)入腫瘤組織后,疏水的PAEMA嵌段迅速轉(zhuǎn)變?yōu)橛H水性,納米顆粒解離,小尺寸的親水高分子鏈攜載藥物滲透至腫瘤組織深部(圖2)[14]。組織分布及瘤內(nèi)擴(kuò)散實(shí)驗(yàn)證實(shí),該納米載體不僅具有較好的EPR效應(yīng),而且具有較好的瘤內(nèi)深部滲透作用。Ge等[15]利用2,3-二甲基馬來(lái)酸酐對(duì)聚乙二醇-聚天冬氨酸進(jìn)行修飾,得到PEG-PAsp(EDA-DM);再將負(fù)電性 PEG-PAsp(EDA-DM)與正電性PAMAM-Pt(IV)前藥分子進(jìn)行自組裝,形成~140 nm的大尺寸納米顆粒。在pH 6.8條件刺激下,聚合物的側(cè)基發(fā)生降解,使聚合物鏈由負(fù)電性轉(zhuǎn)變?yōu)檎娦裕茐钠渑cPAMAM-Pt(IV)之間的相互作用,釋放 PAMAM-Pt(IV),增強(qiáng)對(duì) A549R 耐藥細(xì)胞的增殖抑制作用。
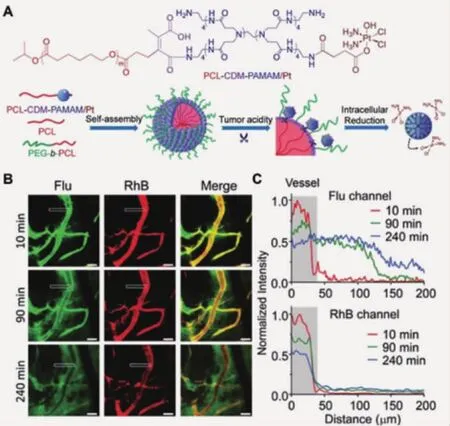
圖1 激光共聚焦顯微鏡觀察并分析響應(yīng)性載體(紅色熒光,RhB)在腫瘤內(nèi)釋放PAMAM分子(綠色熒光,F(xiàn)lu)的行為[13]
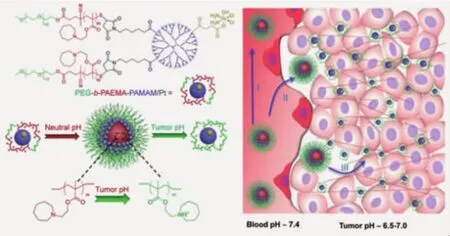
圖2 超敏pH響應(yīng)納米顆粒將在進(jìn)入腫瘤組織后,迅速解離為單分子鏈,增加進(jìn)入腫瘤深層組織的能力[14]
2 腫瘤基質(zhì)酸度增強(qiáng)納米載體細(xì)胞攝取
已有研究表明,納米載體表面“PEG化”會(huì)極大限制腫瘤細(xì)胞對(duì)其的攝取;同時(shí),納米顆粒的表面性質(zhì)對(duì)其細(xì)胞攝取有重要影響。因此,可基于腫瘤組織pH環(huán)境設(shè)計(jì)響應(yīng)性納米載體,調(diào)控顆粒表面性質(zhì)實(shí)現(xiàn)提高細(xì)胞攝取的目的。Bae課題組[16]利用聚丙交酯-聚乙二醇-聚組氨酸-生物素和聚乙二醇-聚組氨酸構(gòu)建了混合膠束。在正常生理環(huán)境,聚組氨酸為疏水嵌段,使生物素靶向分子貼近膠束內(nèi)核;而在腫瘤基質(zhì)pH環(huán)境,咪唑環(huán)質(zhì)子化,聚組氨酸轉(zhuǎn)變?yōu)橛H水性,生物素分子移動(dòng)至膠束外層,發(fā)揮靶向功能,提高膠束進(jìn)入腫瘤細(xì)胞的含量(圖3)。
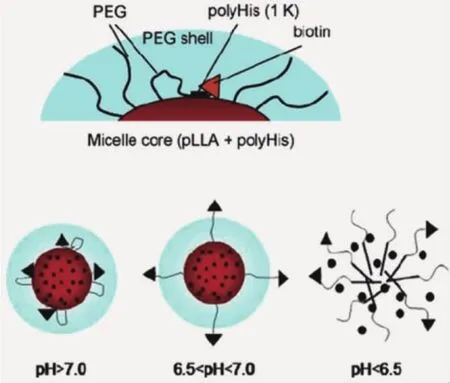
圖3 腫瘤酸度觸發(fā)靶向基團(tuán)(biotin)發(fā)揮功能的示意圖[16]
Wang等[17-20]構(gòu)建了一系列響應(yīng)性“電荷反轉(zhuǎn)”納米顆粒,在系統(tǒng)給藥后,顆粒表面負(fù)電荷會(huì)降低蛋白吸附,延長(zhǎng)顆粒的循環(huán)時(shí)間,提高被動(dòng)靶向性能;而當(dāng)顆粒富集于腫瘤組織后,聚合物側(cè)基的DMMA基團(tuán)發(fā)生降解,負(fù)電性納米顆粒轉(zhuǎn)變?yōu)檎娦裕鰪?qiáng)顆粒與蛋白的結(jié)合作用。與非響應(yīng)性載體相比,“電荷反轉(zhuǎn)”顆粒能夠兼顧長(zhǎng)循環(huán)和細(xì)胞攝取兩方面優(yōu)勢(shì),將更多的藥物輸送至腫瘤細(xì)胞內(nèi),改善藥物治療效果。在此基礎(chǔ)之上,Wang等[21-23]進(jìn)一步對(duì)DMMA基團(tuán)進(jìn)行改進(jìn),合成了多種聚乙二醇化響應(yīng)性橋聯(lián)聚合物,通過(guò)“PEG脫殼”策略,進(jìn)行siRNA和化療藥物體內(nèi)遞送。當(dāng)載體被動(dòng)進(jìn)入腫瘤組織后,Dlinkm化學(xué)鍵降解,使PEG殼層從納米顆粒表面脫落,提高腫瘤細(xì)胞對(duì)載體的識(shí)別能力。在給藥后對(duì)腫瘤細(xì)胞進(jìn)行分析,可發(fā)現(xiàn)胞內(nèi)藥物濃度顯著提高(圖4)。
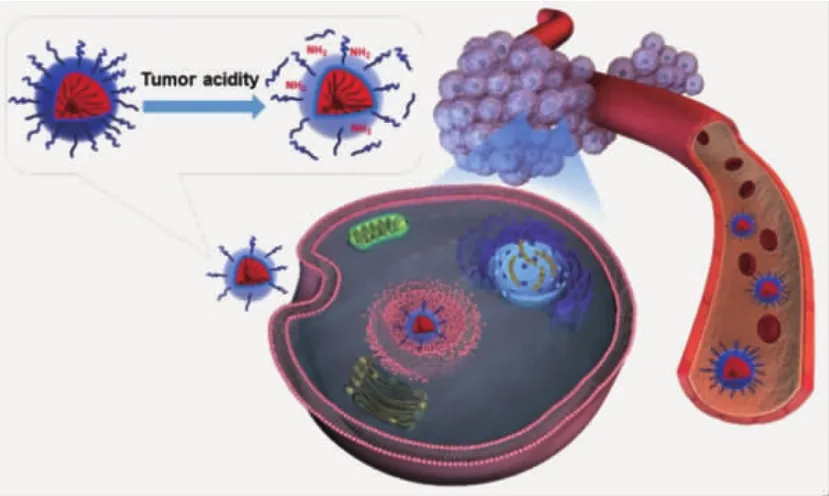
圖4 高分子納米載體借助PEG殼層的保護(hù),延長(zhǎng)藥物的血液循環(huán);在富集于腫瘤組織后,通過(guò)“電荷反轉(zhuǎn)”/“PEG脫殼”等策略,提高腫瘤細(xì)胞的識(shí)別攝取[21]
使用細(xì)胞穿膜肽對(duì)聚乙二醇化載體進(jìn)行修飾,可以在體外水平顯著性增強(qiáng)細(xì)胞攝取;但修飾后的納米顆粒后會(huì)在體內(nèi)循環(huán)過(guò)程中被加速清除,降低載體系統(tǒng)的療效[24-25]。Yang等[26]將穿膜肽Transcriptional Activator Protein(TAT)中的賴(lài)氨酸側(cè)基用2,3-二甲基馬來(lái)酸酐修飾,藥代動(dòng)力學(xué)和分布實(shí)驗(yàn)結(jié)果顯示,當(dāng)賴(lài)氨酸氨基被屏蔽后,TAT功能被顯著抑制,載體的循環(huán)性能與未修飾TAT的顆粒相近;只有在pH 6.5條件下,DMMA基團(tuán)降解,TAT才能在腫瘤組織發(fā)揮功能,增強(qiáng)顆粒的細(xì)胞攝取能力,在體內(nèi)腫瘤抑制實(shí)驗(yàn)中,這種載體系統(tǒng)體現(xiàn)出了自身的優(yōu)越性。Zhou等[27]采用類(lèi)似方法,結(jié)合腫瘤細(xì)胞胞內(nèi)谷胱甘肽響應(yīng)性藥物釋放,同時(shí)解決細(xì)胞攝取和胞內(nèi)藥物釋放屏障,實(shí)現(xiàn)了級(jí)聯(lián)響應(yīng)性藥物遞送。
3 腫瘤細(xì)胞酸度加速藥物胞內(nèi)釋放
藥物釋放是納米載體體內(nèi)給藥的最后一步,只有在細(xì)胞內(nèi)將原藥分子迅速釋放,才能發(fā)揮殺傷腫瘤細(xì)胞的功能。納米載體在細(xì)胞攝取后,會(huì)在較長(zhǎng)時(shí)間內(nèi)處于內(nèi)涵體/溶酶體。因此,可以設(shè)計(jì)響應(yīng)性的納米藥物載體,針對(duì)細(xì)胞器內(nèi)弱酸性環(huán)境(pH 5.0~5.5)解離或降解,快速釋放藥物。目前,具備胞內(nèi)敏感藥物釋放性質(zhì)的載體的設(shè)計(jì)手段,主要有兩種:一種是將反應(yīng)基團(tuán)修飾在聚合物側(cè)基,當(dāng)納米顆粒接收到刺激源后,其側(cè)基會(huì)發(fā)生響應(yīng)性的降解或質(zhì)子化,使得疏水嵌段轉(zhuǎn)變?yōu)橛H水嵌段,顆粒在無(wú)法獲得疏水-疏水相互作用的支持后會(huì)快速解離為高分子鏈,同時(shí)釋放包載藥物。Yu等[28]報(bào)道了聚乙二醇-b-聚(二異丙基氨基甲基丙烯酸酯),在pH 7.4條件下,兩親性聚合物可自組裝形成蠕蟲(chóng)狀的納米膠束。當(dāng)納米顆粒被A549肺癌細(xì)胞攝取后,由于二異丙基氨基基團(tuán)的質(zhì)子化,顆粒會(huì)迅速解離,恢復(fù)光敏劑Ce6功能,對(duì)腫瘤細(xì)胞進(jìn)行高效的光動(dòng)力學(xué)治療(圖5)。Zhong等[29]利用聚乙二醇-聚甲基丙烯酸(三甲氧基苯甲縮醛-三羥甲基乙烷酯)-聚丙烯酸(PEG-PTTMA-PAA)制備了攜載阿霉素(DOX)的納米囊泡,在pH 5.0條件下,縮醛鍵降解,使兩親性聚合物的親疏水比例變化,調(diào)控納米顆粒組裝狀態(tài),DOX得以釋放并殺傷Hela細(xì)胞。Wooley等[30]將紫杉醇(PTX)分子經(jīng)β-硫代丙酸酯鍵鍵合于聚乙二醇-聚磷酸酯側(cè)基,制備得到的PEO-PPEPTX在進(jìn)入OVCAR-3細(xì)胞后,β-硫代丙酸酯鍵降解,PTX與聚合物骨架分離,使疏水嵌段轉(zhuǎn)變?yōu)橛H水嵌段,PTX快速釋放。
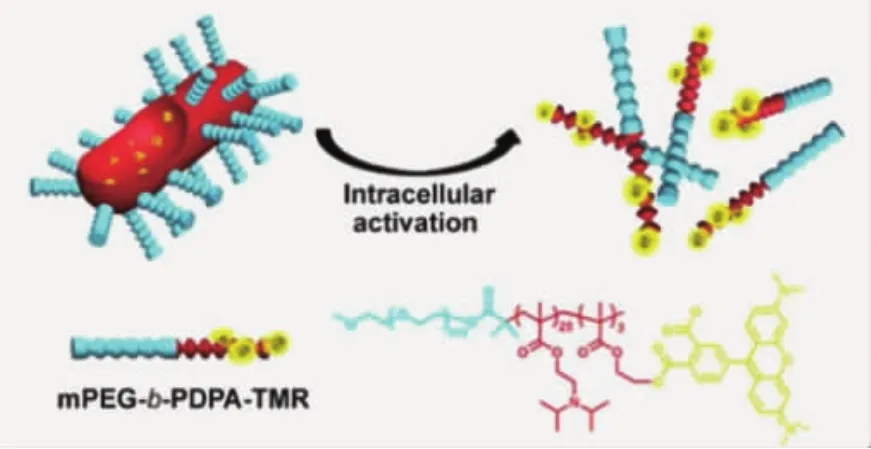
圖5 在中性條件,兩親性聚合物自組裝為蠕蟲(chóng)狀納米膠束;腫瘤細(xì)胞酸性條件刺激聚合物轉(zhuǎn)變?yōu)槿H水性,膠束解離[28]
另一種實(shí)施方案是將化學(xué)鍵作為納米顆粒親疏水組分的橋聯(lián)部分,當(dāng)橋聯(lián)化學(xué)鍵遭遇刺激源后,會(huì)迅速降解,從而將親疏水組分分離,最終改變納米顆粒的組裝結(jié)構(gòu),進(jìn)一步促進(jìn)藥物釋放。Wagner研究組[31]曾利用腙鍵將PEG與疏水性膽固醇“橋聯(lián)”,并與DNA復(fù)合,組裝成納米顆粒。在生理?xiàng)l件下顆粒可穩(wěn)定存在,而被細(xì)胞攝取并進(jìn)入內(nèi)涵體后,在偏低的pH環(huán)境(pH=5.4)下腙鍵迅速降解斷裂,使納米顆粒表面脫去PEG保護(hù)層,去PEG化的納米顆粒在響應(yīng)性釋放DNA的同時(shí)可以顯著促進(jìn)基因藥物從內(nèi)涵體的逃逸。上述載體系統(tǒng)在體外水平與非“橋聯(lián)”的體系相比,基因藥物的轉(zhuǎn)染效果增強(qiáng)約40倍(圖6)。
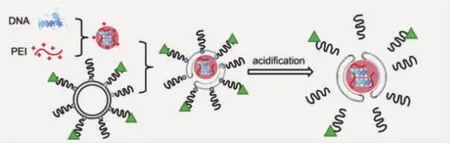
圖6 橋聯(lián)高分子的化學(xué)鍵被弱酸性環(huán)境降解,納米載體崩解,釋放攜載DNA[31]
4 展望
腫瘤酸度響應(yīng)納米藥物載體巧妙利用了腫瘤組織和腫瘤細(xì)胞內(nèi)獨(dú)特的微環(huán)境,有效解決了納米載體在系統(tǒng)給藥后面臨的腫瘤滲透、高效攝取、快速釋放藥物等難以,改善了原有化療藥物的療效,降低了毒副作用,受到納米醫(yī)學(xué)科研工作者的廣泛關(guān)注。除了腫瘤酸度,腫瘤組織還存在還原物質(zhì)、特異性表達(dá)酶等內(nèi)在微環(huán)境;同時(shí),超聲、激光等也是很好的外部刺激因子。在未來(lái)抗腫瘤藥物遞送研究中,多重級(jí)聯(lián)響應(yīng)性載體將成為研究熱點(diǎn)。這種載體集成了不同微環(huán)境下的協(xié)同效應(yīng),不僅能夠更好地克服各個(gè)給藥屏障,還可以協(xié)調(diào)各個(gè)屏障間的關(guān)系,實(shí)現(xiàn)高效藥物遞送。然而,多重響應(yīng)性載體的材料合成步驟復(fù)雜,質(zhì)量不容易控制,只有聯(lián)合推動(dòng)材料學(xué)和相關(guān)學(xué)科共同發(fā)展,才能有效解決該問(wèn)題,使納米藥物載體的給藥向更加精準(zhǔn)化方向發(fā)展。

