基于晶格化的動力學Monte Carlo方法研究鈦酞菁配合物氧化還原反應催化能力
周 蘇, 胡 哲, 高 揚, 姜 縝
(同濟大學 a. 汽車學院; b. 中德學院, 上海 201804)
一般情況下,比較催化劑的性能,可以通過實驗獲得以下兩個參數:① 單位時間內單位活性中心所轉化的反應物分子數(Turnover Frequency,TOF),即單位時間內在催化劑單位面積每個活性位置的轉化數;② 活性位置密度(Site Density,SD),即催化劑單位面積上的活性位置.但是,對于未知或者具有新型結構的催化劑,很難通過實驗得到TOF值或SD值.例如,在研究一個可能的催化反應機理時,整個反應過程持續時間很短,即使超高速攝像機也只能獲得若干張宏觀變化的圖像.若想了解其微觀層級的變化并進一步推測其催化性能,并與其他催化劑進行比較,需借助其他方法或工具.
隨著計算機技術的發展,計算化學已經能夠在沒有實驗情況下給出定性或定量結論,為尋找或設計潛在的新型催化劑材料提供方向性的信息[1].例如,以鈦酞菁配合物(TiPc)為研究對象,周蘇等[2]基于密度泛函理論構建了TiPc氧化還原反應機理模型,通過計算其Gibbs自由能等指標,分析預測了TiPc的催化能力.動力學Monte Carlo方法(KMC)也是一種應用廣泛的計算化學工具[3].例如,湯星舟[4]結合動態Monte Carlo法與分子動力學研究了C面藍寶石襯底的氮化現象,分析總結了表面氮化的相關機理;Franziska Hess等[5]利用KMC研究了催化劑RuO2對于CO和HCl氧化催化反應的作用.
本文以TiPc為研究對象,基于晶格化的KMC并借助Kmos軟件,通過求解Markov鏈主方程,計算TiPc的TOF值并以其作為催化活性的參考評價指標,研究反應溫度和氫氧氣體分壓比對TiPc催化活性的影響;通過比較未知TiPc和已知Pt兩者的TOF值,預測未知催化劑TiPc的催化活性;另一方面,從計算化學工具的角度,以TiPc作為對象,旨在驗證KMC用于研究未知催化劑催化活性的可行性.
1 模型與方法
1.1 計算軟件
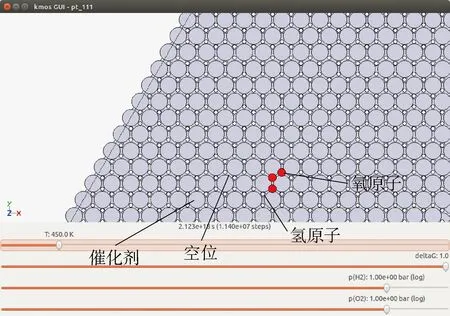
圖1 Kmos軟件GUI界面(氫氧反應圖)Fig.1 GUI interface of Kmos software (hydrogen and oxygen reaction)
Kmos是基于Python的一款開源軟件,其模型建立是由用戶通過Python編寫py文件作為輸入,然后由Kmos模擬給出結果.為了展示催化劑表面的微觀變化,該軟件也支持UI界面,圖1所示為氫氣和氧氣在催化劑表面某一反應時刻的截圖,圖中深色點代表氧原子,淺色點代表氫原子,白色點代表空位,基底圓形代表催化劑.
1.2 基于晶格化的KMC及應用的假設條件
基于晶格化的KMC將整個催化劑薄膜簡化為10×10個晶胞所組成的平面,同時以單個晶胞作為研究對象,以基本反應的動力學參數作為輸入,在晶胞表面采用KMC求解Markov鏈主方程[5-6,7,9]及微觀動力學模型;根據給定的反應條件(如溫度和所有反應物的分壓),可以計算或獲取催化劑的TOF值、晶胞表面的反應物或/和生成物成分、反應鏈中的步驟、反應機理等信息[10-11].針對所研究的對象,應用晶格化的KMC時,通常給出如下4個方面的假設.
1.2.1特殊位置的吸附和晶格排布 假設所有反應物和中間物都吸附在特殊位置,即晶體表面的活性位置.在實際的KMC模擬時,只考慮這一個晶格,整個晶體表面可以看成由這個晶格重復排列組合而成.例如,低指數單晶表面中一個晶格是由多個相同的晶胞組成.圖2所示為一個面心立方排列(100)的催化劑模型,它有2個活性位置[5].
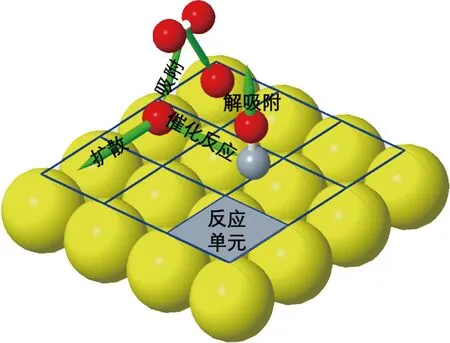
圖2 催化劑表面CO氧化反應(包含吸附、擴散、反應和解吸附過程)模型示意圖Fig.2 Catalyst surface diagram of CO oxidation reaction on catalyst surface (including adsorption, diffusion, reaction and desorption process)
1.2.2Rare-event動力學和Markov鏈主方程 假設時間演化是基于Rare-event動力學的.利用時間尺度分離,根據微觀動力學理論,假設事件的發生是相互獨立的,可以基于Markov近似來推演反應過程.因此,事件(從一種組態到另一種組態)的發生可以通過Markov鏈主方程描述:
(1)
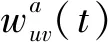
1.2.3基本反應的確定 假設前文提到的一個晶格中組態變化只考慮1~10個位置.因此,可以根據局部產物Ea的晶格狀態和變化后的局部產物Pa的晶格狀態以及相應的伴隨速率Ka來確定一個基本反應,即
(2)
1.2.4狀態轉移矩陣的大小和結構 式(1)中w可分解成一系列基本反應:
(3)
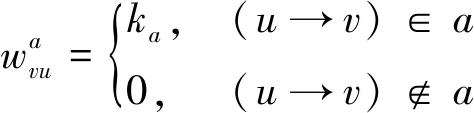
(4)
式中:ka為基本反應a的反應速率.
以上假設用于簡化Markov鏈主方程的求解.
1.3 模型
1.3.1催化反應速率計算 KMC模擬的主要特點之一就是可以計算各種催化劑的反應速率,包括TOF值.如果基本反應只有一個最終生成物,那么TOF的計算只考慮這一種生成物.
對于基本反應a,在任意時刻t,
TOFa=
(5)
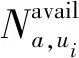
1.3.2參數計算 基于密度泛函理論(DFT),利用Amsterdan Density Functional(ADF)等軟件,根據構造的TiPc在氧化還原過程中形成的各粒子能量變化,可計算TiPc的氧吸附能:
EbO2=EML-O2-(EO2+EML)
(6)
式中:EML-O2為氧分子和吸附粒子的總能量;EO2為孤立的氧分子的總能量;EML為吸附粒子的能量.此式也可用于計算Pt的氧吸附能.
同理,計算TiPc的氫吸附能:
EbH2=EML-H2-(EH2+EML)
(7)
式中:EML-H2為氫分子和吸附粒子的總能量;EH2為孤立的氫分子的總能量;EML為吸附粒子的能量.此式也用于計算Pt的氫吸附能.
2 結果與討論
2.1 TiPc的TOF值
在模擬TiPc表面氫氣和氧氣反應時,反應溫度T和TiPc表面的氫氣分壓與氧氣分壓的比值pH2/pO2是兩個重要的參數.在Kmos軟件運行環境下,取T在470~570 K(間隔5 K)之間的21個值和pH2/pO2在 0.1~10之間的40個值,可以計算得到相應的TOF值.以溫度為470、520和570 K的情況為例,分析反應溫度T和氫氧氣體分壓比值pH2/pO2對TiPc催化劑TOF值的影響.
2.1.1TOF值隨反應溫度T的變化 由化學反應基本原理可知,反應溫度T是影響催化劑活性(TOF值)的重要因素.溫度較低時,催化劑活性較小,對于反應促進效果較差;隨著溫度上升,催化效果逐漸增強.但是,大多數催化劑都有其催化活性適宜溫度范圍.溫度過高,會使催化劑發生燒結,從而破壞其催化活性.為了分析反應溫度對TOF值的影響,圖3所示為3種溫度條件下不同氫氧氣體分壓比值對應的TOF值(實線部分).與溫度條件520 K及570 K相比,溫度470 K下的TOF值過低,所以圖3的虛線部分也給出了lg(TOF)值,以便于對比分析.
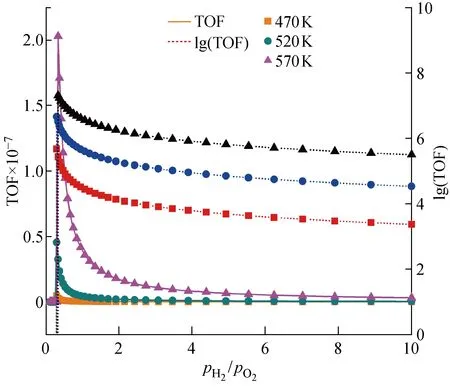
圖3 不同溫度下pH2/pO2對應的TiPc催化劑TOF及lg(TOF)值Fig.3 TOF and lg(TOF) values of TiPc under different pH2/pO2 at 470, 520, 570 K
由圖3可明顯看出:① 隨著反應溫度上升,同一氣體分壓比值對應的TOF值也依次增高,這符合催化劑基本特性.但反應溫度超過催化劑適宜反應溫度區間后,催化劑催化性能下降.Choi等[14]及陳維民等[15]通過各自的研究發現,催化劑會隨著溫度上升而發生聚集,超過一定程度會降低催化劑催化活性;② 與溫度區間520~570 K相比,在溫度區間470~520 K內TOF值的增長幅度較小,這說明TiPc的活性雖然與溫度正相關,但并不是線性相關;③ lg(TOF)值變化隨溫度變化近似呈線性關系.
2.1.2TOF值隨氫氧氣體分壓比值pH2/pO2的變化 除反應溫度T外,氫氧氣體分壓比值pH2/pO2同樣會影響催化劑活性(即TOF值).為了研究相關規律,將3種溫度條件下TOF值(圖3實線部分)在橫坐標 0.1~0.33 區間內的曲線放大得到圖4.
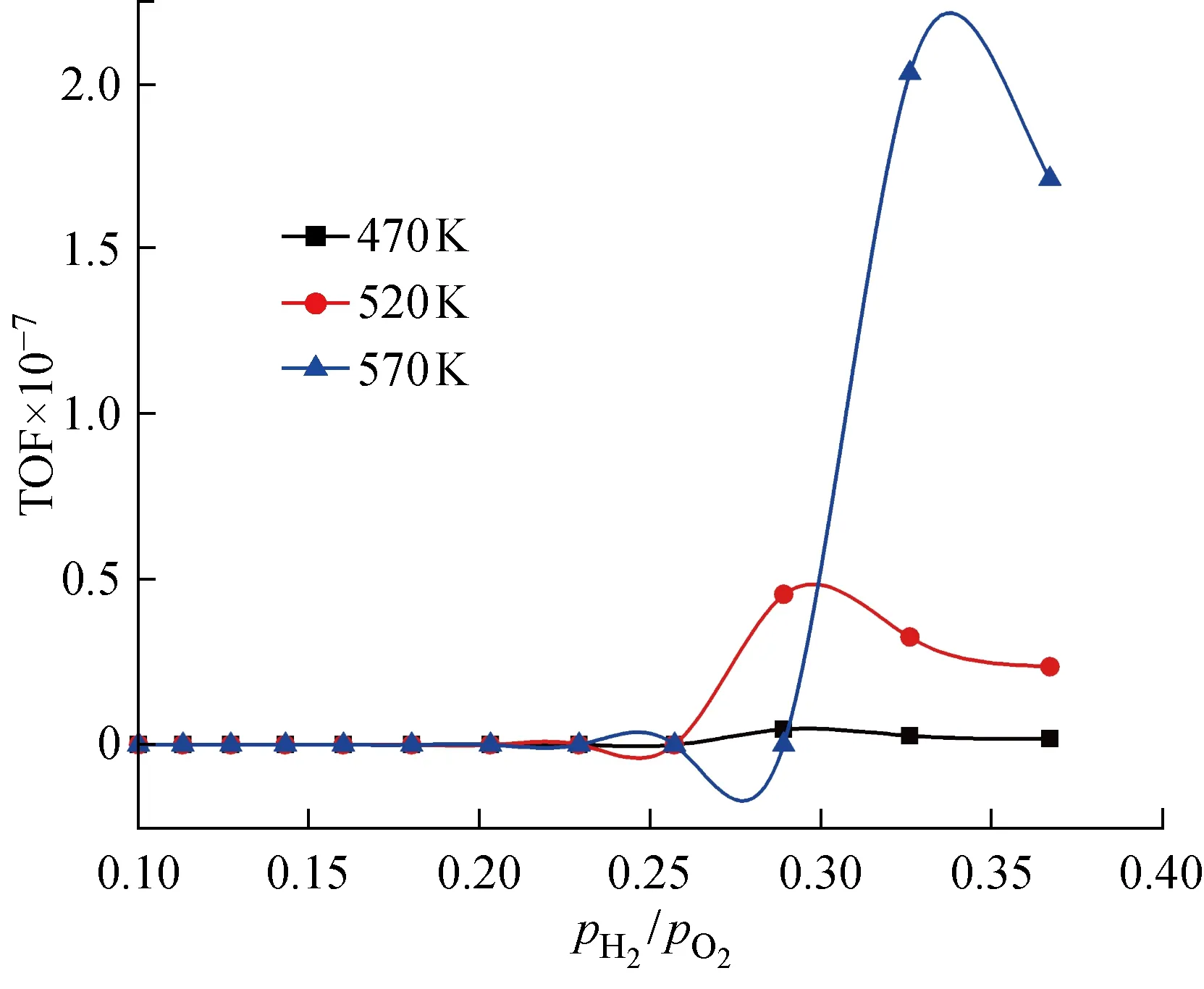
圖4 不同溫度下pH2/pO2在 0.1~0.33 區間時對應的TiPc催化劑TOF值Fig.4 TOF values of TiPc within pH2/pO2 0.1-0.33 at 470, 520, 570 K
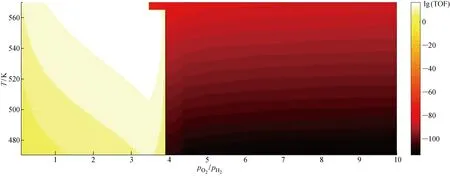
圖5 溫度470至570 K條件下不同氧氫氣體分壓比值對應的TiPc催化劑lg(TOF)值Fig.5 lg(TOF) values of TiPc under different O2 and H2 partial pressure ratios between 470 K and 570 K
結合圖3和4的信息可知,3種不同溫度條件下TOF值的最大值出現在氫氧氣體分壓比值0.289~0.326區間內.在氫氧氣體分壓比值0.1~0.2之間,TOF值單調緩慢上升;在氫氧氣體分壓比值0.2~2區間內,TOF值先急速上升至最高點,然后單調急速下降;從氫氧氣體分壓比2開始,TOF值單調平穩下降至接近0值.催化反應主要經歷以下3個步驟[12-13]:① 反應物被催化劑吸附在表面;② 反應物在催化劑表面進行反應;③ 反應生成物從催化劑表面脫附.其中,步驟①對應前文所計算吸附能,步驟③保證反應生成物能夠及時富集及保證催化劑再生.根據 1.2 中的假設,所有的反應物和中間物都吸附在表層催化活性位置.因此,根據化學平衡移動原理,當氫氧分壓比從零開始升高時,催化劑表面反應物氫氣的濃度增加,反應傾向于向正反應方向移動,對于催化劑表面的活化中心具有很好的活化作用.但是,氫氧分壓比進一步增大,使得氫氣的覆蓋度過大,會出現“氫中毒”現象,反而使催化劑活性下降,抑制反應的進行.本文所用方法不能從定量上解釋TOF值急速變化的原因,但是,從上述的分析中可以推測,TiPc催化劑的活性區域在氫氧分壓比值 0.2 ~2之間,此區間內氫氣和氧氣在催化劑表面以較為合適正向反應的比例共存.
2.1.3采用2D Map圖分析TOF 為了能夠同時研究反應氫氧氣體分壓比及反應溫度對TiPc催化活性或反應速率的影響,利用線性插值,將上述21組數據繪制成2D Map圖;為了分析方便,取氫氧氣體分壓比值的倒數即氧氫氣體分壓比值為橫坐標,縱坐標為反應溫度(見圖5);二維圖中區域的顏色深淺則對應TOF值(反應速率),顏色越淺代表TOF值越大.從TiPc的計算數據及上文的結論可知,在氫氧氣體分壓比值 0.1~0.2 區間內,TiPc的TOF值非常小,接近于零.為了增強這種區別,取TOF值的常用對數.圖5所示為反應溫度 470~570 K 下不同氧氫氣體氣體分壓比值對應的 lg(TOF) 值.
圖5中暗部區域對應的橫坐標范圍為氧氫氣體分壓比值 3.8~10,對應于氫氧氣體分壓比值 0.1~0.26,基本符合 2.1.1 和 2.1.2 得出的結論,該區域內TiPc反應活性遠低于左側亮部區域,且亮部區域和暗部區域突變位置即為TOF值陡降陡升位置.
2.2 Pt的TOF值
采用上述的相同條件,在Kmos軟件運行環境下計算得到相應的Pt催化劑TOF值,用于分析反應溫度T及氫氧氣體分壓比值pH2/pO2對TOF值的影響,從而進一步比較TiPc與Pt兩者的催化活性.
2.2.1TOF值隨反應溫度T的變化 由Pt催化劑的計算數據可知,Pt催化劑TOF值在氫氧氣體分壓比值 0.8~10 區間內幾乎不變,為了便于分析,只選用氫氧氣體分壓比值 0~0.8 區間內的計算數據.圖6所示為3種溫度條件下不同氫氧氣體分壓比值對應的TOF值(實線部分),且與TiPc催化劑情況相同,為突出470 K與520 K溫度下TOF值曲線間的差別,圖6的虛線部分也給出了 lg(TOF)值.
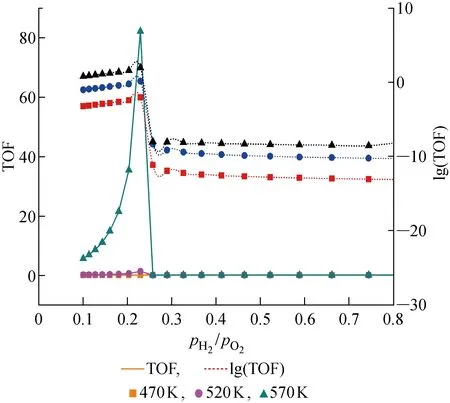
圖6 不同溫度下pH2/pO2對應的Pt催化劑TOF及lg(TOF)值Fig.6 TOF and lg(TOF) values of Pt under pH2/pO2 at 470, 520, 570 K
由圖6可看出,不同溫度條件下,Pt催化劑表現出與TiPc催化劑相似的特性:① 隨著反應溫度上升,同一氣體分壓比值對應的TOF值也依次增高;② 雖然TOF值與溫度不是線性正相關,但是 lg(TOF) 值隨溫度變化近似呈線性關系.
2.2.2TOF值隨氫氧氣體分壓比值pH2/pO2的變化 為了研究氫氧氣體分壓比值pH2/pO2對催化劑活性(即TOF值)的影響關系,將3種溫度條件下TOF值(圖6實線部分)在橫坐標 0.1~0.26 區間內的曲線放大得到圖7.
由圖7可以看出,3種不同溫度條件下TOF值的最大值均出現在氫氧氣體分壓比值0.229處,此時Pt催化劑的催化活性最高;與TiPc催化劑相比,Pt催化劑TOF值的最大值明顯小幾個數量級,所以也可以預測TiPc催化劑的活性高于Pt催化劑.
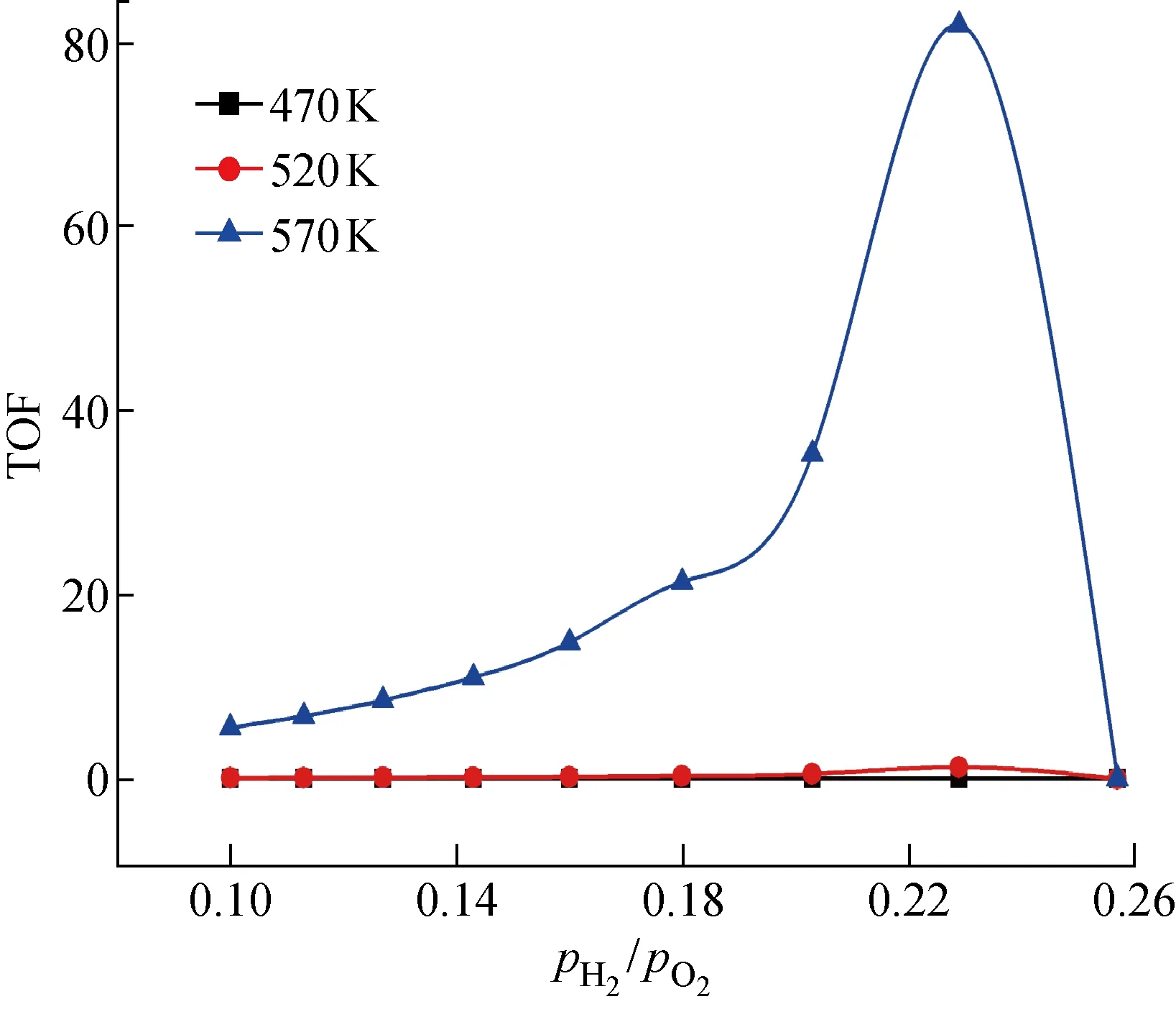
圖7 不同溫度下pH2/pO2 在 0.1~0.26 區間時對應的Pt催化劑TOF值Fig.7 TOF values of Pt within pH2/pO2 0.1-0.26 at 470, 520, 570 K
2.2.3采用2D Map圖分析TOF 將Pt催化劑21組原始數據利用線性插值繪制成2D Map圖.由圖6實線部分可知,在氫氧氣體分壓比值 0.1~0.3 區間內,Pt催化劑TOF值遠大于其他區域.為了增強這種區別,取TOF值的常用對數.圖8所示為反應溫度470~570 K下不同氧氫氣體分壓比值對應的lg(TOF)值.
圖8中亮部區域對應的橫坐標范圍為氧氫氣體分壓比值 3.9~10,對應氫氧氣體分壓比值 0.1~0.256,基本符合本節 2.2.1 和 2.2.2 所得結論,該區域內Pt催化劑反應活性遠高于左側暗部區域,且亮部區域和暗部區域突變位置即為TOF值陡降陡升位置.
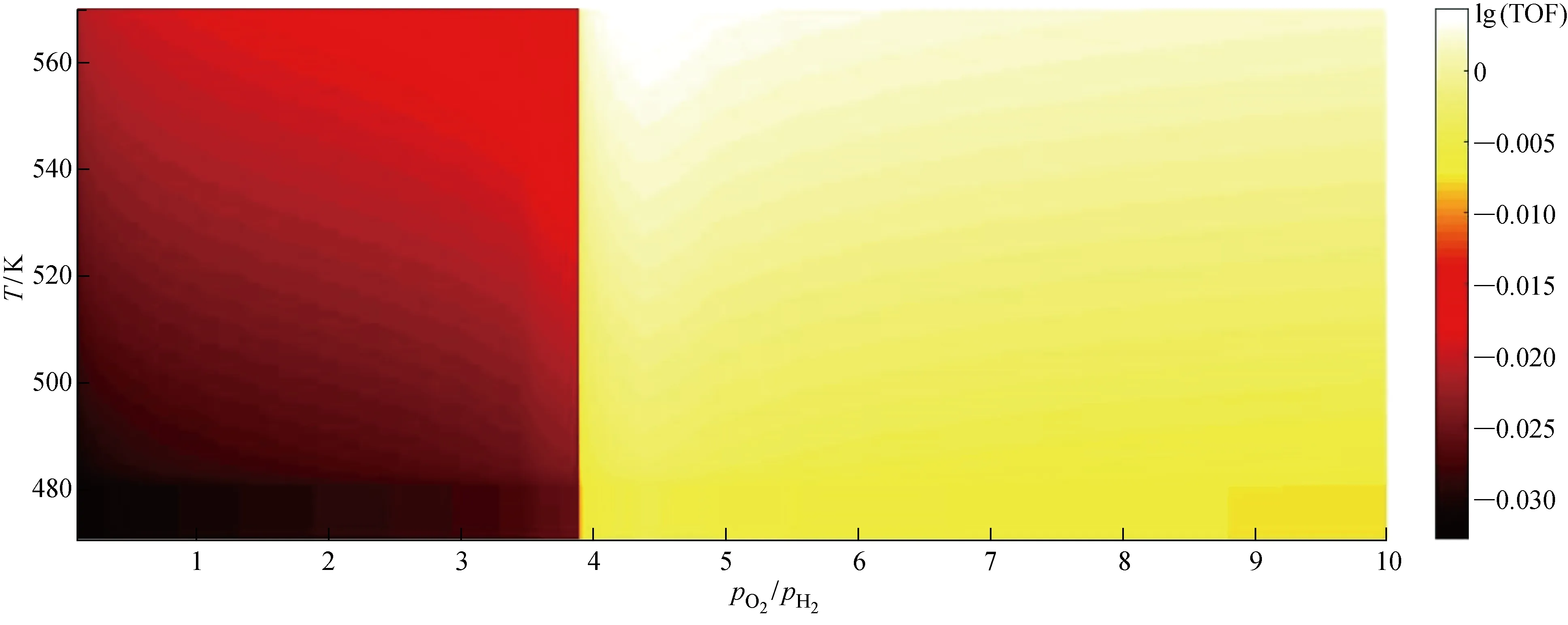
圖8 470~570 K條件下不同氧氫氣體分壓比值對應的Pt催化劑lg(TOF)值Fig.8 lg(TOF) values of Pt under different O2 and H2 partial pressure ratios between 470 K and 570 K
2.3 分析與討論
TiPc催化劑TOF值與反應溫度T及氫氧氣體分壓比值pH2/pO2存在一定復雜關系.TiPc催化劑TOF值會隨溫度變化而發生改變,隨著反應溫度由470 K增長到570 K,TOF值同樣呈現出遞增的趨勢;氫氧氣體分壓比值同樣會影響催化劑活性(TOF值),TiPc催化劑TOF值的最大值出現在氫氧氣體分壓比值 0.289~0.326 區間內,氫氧氣體分壓比值在 0.1 至該區間,TOF值首先接近于零,之后單調遞增;氫氧氣體分壓比值在該區間至10,TOF值單調遞減直至接近0值.此外,TiPc催化劑TOF值的最大值出現在反應溫度570 K和氫氧氣體分壓比值 0.326 處,其值為 2.034×107.
與TiPc催化劑不同,Pt催化劑TOF值在氫氧氣體分壓比值 0.1~0.229 之間單調遞增,在氫氧氣體分壓比值 0.229~0.26 之間單調遞減,可以推測氫氧氣體分壓比值 0.1~0.26 區間是Pt催化劑的活性區域;當氫氧氣體分壓比值處在 0.26~10區間內,TOF值接近于零且單調遞減.Pt催化劑TOF值的最大值出現在反應溫度570 K和氫氧氣體分壓比值 0.229 處,其值約為82.
與Pt催化劑相比,TiPc催化劑TOF值的最大值以及TiPc催化劑的2D Map圖中亮部區域對應氫氧氣體分壓比值區間都明顯更大,可以推測TiPc催化劑的活性區域更廣且其催化活性更高.
3 結語
基于晶格化的動力學Monte Carlo方法,采用TOF值作為參考評價指標,評價TiPc催化劑在反應中的催化活性,模擬氣-固界面氫、氧分子在催化劑表面的反應.討論了TiPc在不同反應溫度及不同氫氧氣體分壓比值的反應條件下的催化活性.TiPc催化劑TOF值隨反應溫度上升而遞增,同時也隨氫氧氣體分壓比值上升而首先遞增之后遞減.TiPc催化劑TOF值的最大值出現在反應溫度為570 K和氫氧氣體分壓比值 0.326 處.采用與TiPc催化劑相同的反應條件,在Kmos軟件運行環境下計算得到相應的Pt催化劑TOF值,并與TiPc催化劑TOF值進行比較,得到了與文獻[2]相同的預測結果,即TiPc催化劑催化活性強于Pt催化劑.
因計算方法和計算能力的局限性,本文僅研究了TiPc在相對較簡單的氣-固界面上反應的催化性能,沒有涉及質子交換膜燃料電池中催化劑在固-液界面的真實反應環境.

