在微通道反應器中探究Paal-Knorr反應動力學
田念蒙,樓一先,沈海偉,倪意文,夏春年(浙江工業大學藥學院,浙江 杭州 310014)
0 引言
微通道技術起始于20世紀90年代的微流控技術,屬于微觀范疇[1]。通過將其與普通間歇式反應器相比,發現微通道反應器由于它尺寸較小(微米級通道),有較大的比表面積,可以精確控制反應時間和物料配比[2-4],因此具有傳質和傳熱效率高、安全性高、可直接放大生產無放大效應、可高度集成化、綠色環保等優點[5]。體現在微反應器中,可以明顯縮短反應時間、大幅度提高反應轉化率,控制反應選擇性,提高產品收率等[6-7]。
該反應最初由德國化學家Carl Paal[8]和Ludwig Knorr[9]于1884年分別描述為合成呋喃的方法,然后進行了吡咯和噻吩合成的改良。但釜式反應中存在諸多難以解決的問題,例如酸性條件下加熱、反應時間較長、雜質多和產率低等[10-12],為了拓展Paal-Knorr反應的應用范圍,探索并優化了微通道反應器中的反應條件且回歸出反應動力學速率常數。
1 合成方法
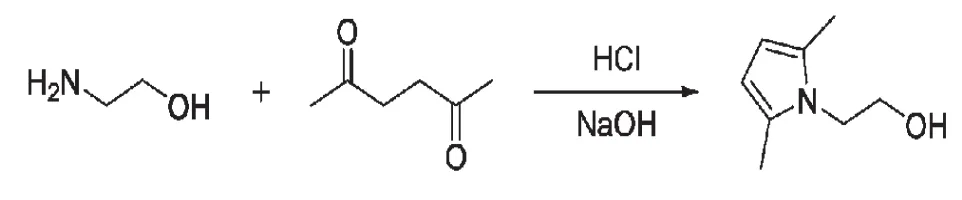
1.1 反應方程式
1-(2-羥基乙基)-2,5-二甲基吡咯的合成方程式如下:
1.2 實驗步驟
使用三支氣密性注射器 (每根體積為1 mL)分別抽取已精確配置的一定濃度的2,5-己二酮、乙醇胺和氯化氫甲醇溶液,固定至注射泵上,設置相應保留時間的流速和背壓閥壓力。氯化氫甲醇在反應器末端加入,用于淬滅反應。
檢查設備無異常情況后,啟動注射泵運行反應器,設定背壓閥壓力,待產品管有液體流出時,升溫到所需的溫度并在該溫度下運行幾分鐘,待設備穩定后開始收集反應液,并記錄時間和壓力,在收集一定量的反應液后,停止收集;重復上述過程,完成下一批次物料收集。實驗完成后至室溫,關閉注射泵以停止反應,完成一組實驗。
待壓力降至標準大氣壓后,取下氣密性注射器,重新抽取反應液,進行下一組實驗。
收集得到的樣品用氣相色譜進行檢測,統計數據,擬合反應動力學。
微通道管道示意如圖1。
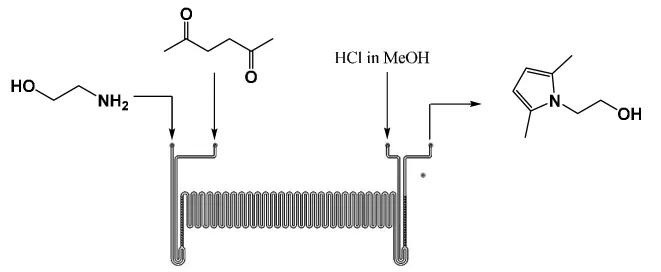
圖1 微通道制備1-(2-羥基乙基)-2,5-二甲基吡咯Fig.1 Preparation of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole by microchannel
2 實驗部分
2.1 主要實驗儀器及試劑

表1 實驗試劑Table 1 Experimental reagent
表2 實驗儀器及設備Table 2 Experimental instruments and equipment
2.2 條件優化
設定5 mol/L的反應原料液進行反應。對不同溫度 (25℃、75℃、100℃、125℃以及150℃)和保留時間 (9.3 s、18.6 s、37.1 s、74.2 s、148.4 s)進行控制單一變量進行優化,共25組不同條件,分別在這些條件下進行反應,收集樣品,用氣相色譜檢測,收集匯總結果如表3:
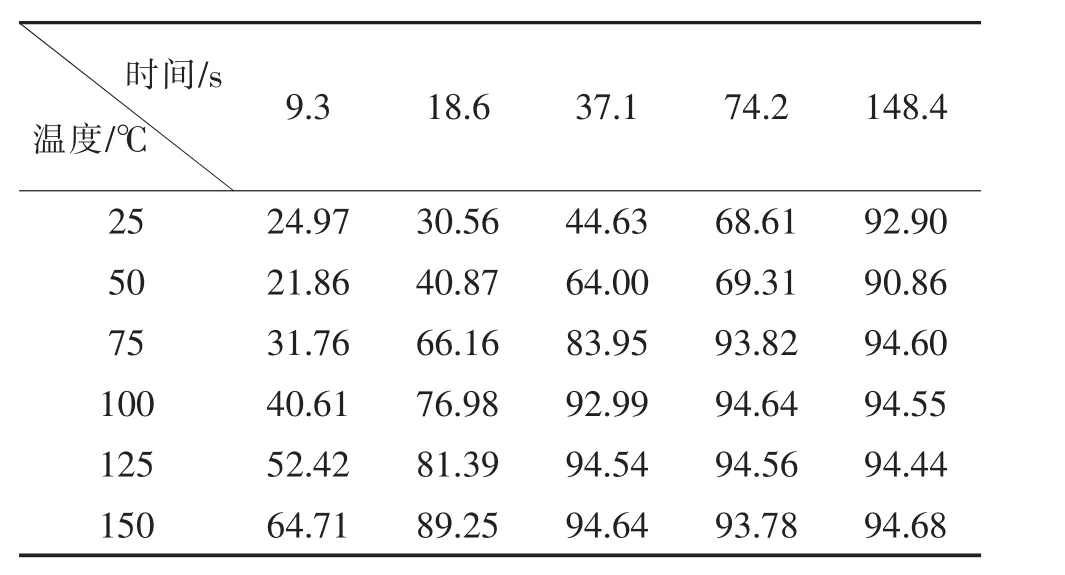
表3 反應溫度和時間對1-(2-羥乙基)-2,5-二甲基吡咯流動合成影響的數據匯總(轉化率/%)Table 3 Data summary of the effect of reaction temperature and time on the flow synthesis of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole(Conversion rate/%)
由圖2可以看出,反應溫度越高,反應越快,轉化率越高。反應溫度較高,反應時間37.1 s就已達到高峰,延長保留時間轉化率變化也不明顯。確定在5 mol/L原料液的條件下,2,5-己二酮與乙醇胺反應的最佳條件為:反應溫度為150℃,保留時間為37.1 s。
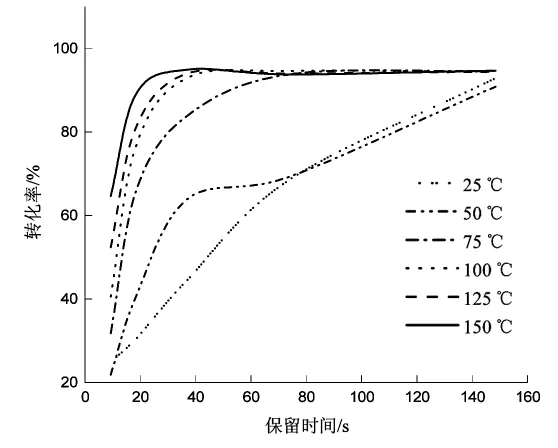
圖2 反應溫度和時間對1-(2-羥乙基)-2,5-二甲基吡咯流動合成影響的圖示Fig.2 Illustration of the effect of reaction temperature and time on the flow synthesis of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole
2.3 擬合反應動力學
從圖2看出,反應在75℃下進行時,隨著保留時間的延長,轉化率逐漸增加,具有最大的保留時間效應。選擇在75℃的溫度條件下,探究反應濃度和保留時間的關系,嘗試擬合反應動力學。

表4 反應濃度和時間對1-(2-羥乙基)-2,5-二甲基吡咯流動合成影響的數據匯總(轉化率/%)Table 4 Data summary of the effect of reaction concentration and time on the flow synthesis of 1-(2-hydroxyethyl)-2,5-dimethylpyrrole(Conversion rate/%)
進行擬合反應動力學,求取反應速率常數。
首先假設反應級數為零級,求取反應濃度與保留時間的關系表5。
由數據匯總表繪制關系圖(圖3)。
從圖3可看出,沒有線性關系,判定不是零級反應。
假設反應級數為一級,求取反應濃度與保留時間的關系,如表6所示。
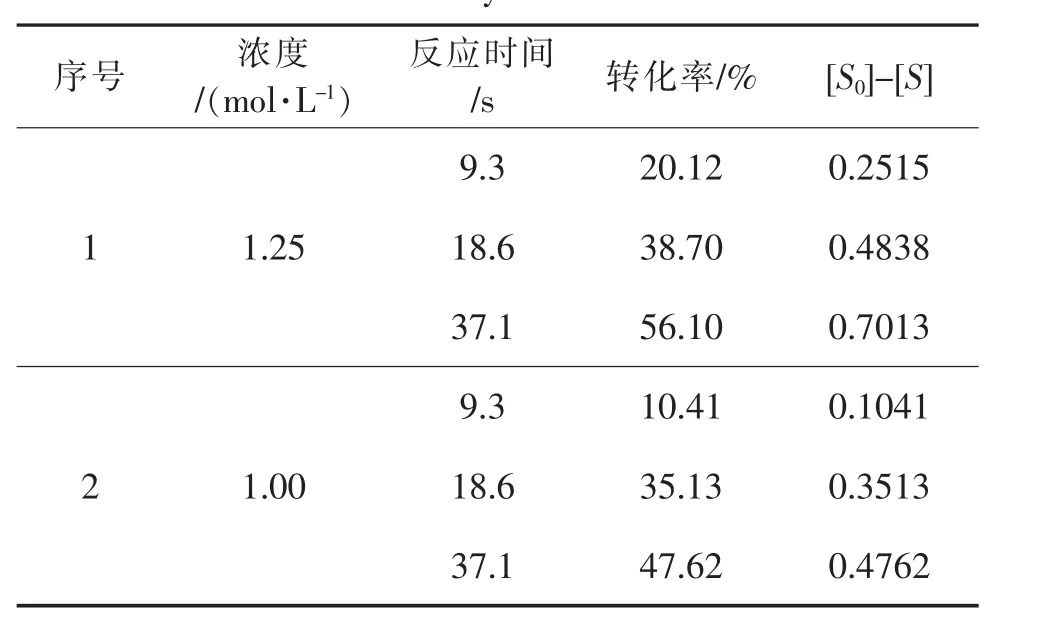
表5 零級反應數據匯總Table 5 Data summary of zeroth order reaction

圖3 [S0]-[S]與時間的關系圖Fig.3 [S0]-[S]versus time graph
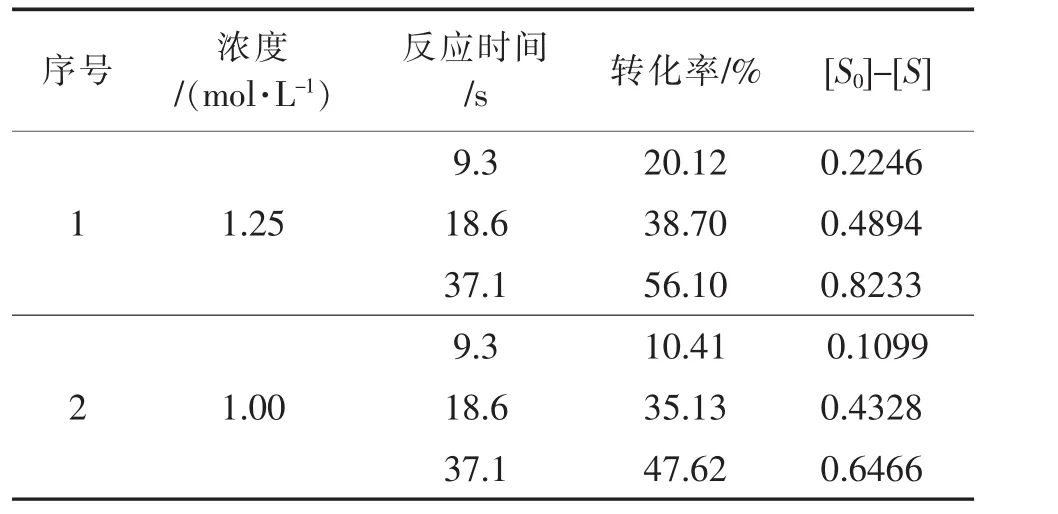
表6 一級反應數據匯總Table 6 Data summary of first order reaction
由數據匯總表繪制關系圖(圖4)。
從圖4看出,沒有線性關系,判定不是一級反應。
假設反應級數為二級,求取反應濃度與保留時間的關系,如表6所示。
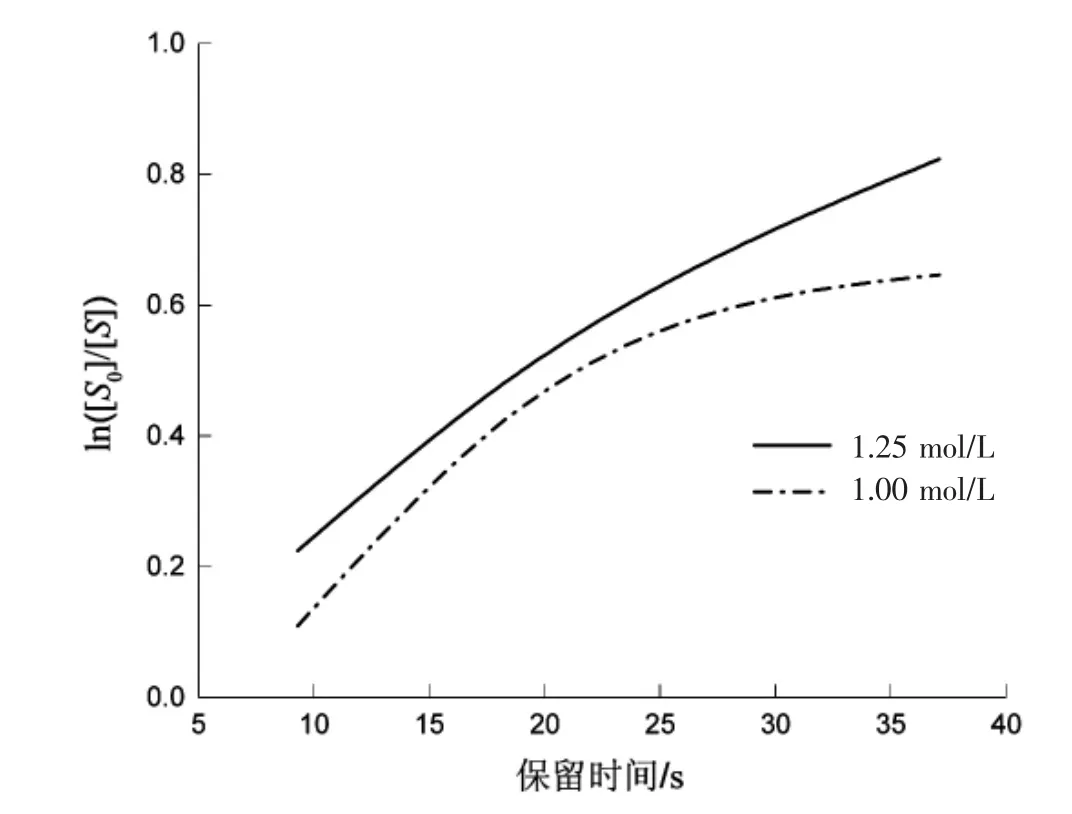
圖 4 ln([S0]/[S])與時間的關系圖Fig.4 ln([S0]/[S])versus time graph

表7 二級反應數據匯總Table 7 Data summary of second order reaction
由數據匯總表繪制關系圖(圖5)。
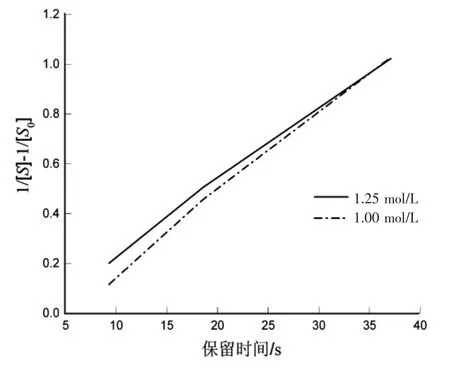
圖 5 ln([S0]/[S])與時間關系圖Fig.5 ln([S0]/[S]) versus time graph
從圖5可看出,存在明顯的線性關系,判定該反應為二級反應。1.25 mol/L的趨勢方程為y=0.0293t-0.0586,R2=0.9984;1.00 mol/L 的趨勢方程為y=0.0323x-0.1556,R2=0.9933。該反應為二級反應,反應速率常數 k=0.0308 L-1·mol-1·s-1。
3 結論
利用微通道反應器對Paal-Knorr反應動力學進行了探索,以2,5-己二酮與乙醇胺為原料,甲醇為溶劑,鹽酸甲醇溶液為淬滅劑,合成1-(2-羥基乙基)-2,5-二甲基吡咯;用氣相色譜儀(GC)對反應進行定性、定量分析;隨后對反應條件(反應溫度、保留時間)進行了一系列優化,得到最佳反應條件:反應溫度150℃,保留時間37.1 s。確定在75℃下,該反應為二級反應,反應的速率常數為 0.0308 L-1·mol-1·s-1,與釜式反應動力學級數相一致[13],也進一步確認了微通道反應器不會改變反應的級數[14]。采用同樣的方法應用到阿托伐他汀中間體的合成,得到相似的結果。

