煙草胚狀體誘導的影響因素
黃子彧,鐘 軍,宋 浩,黃德文,戴 彬,戴林建*
(1.湖南農業大學,湖南 長沙 410128;2.湖南省中煙工業有限責任公司,湖南 長沙 410007)
【研究意義】通過單倍體進行良種選育,其中由隱性基因控制的性狀,由于沒有顯性基因的掩蓋而容易顯現。單倍體植株經染色體加倍后,在一個世代中即可出現純合的二倍體,從中選出的優良純合系后代不分離,可縮短育種年限。單倍體育種如能進一步提高誘導頻率并與雜交育種等相結合應用,則在作物品種改良上的作用將更顯著。組織培養是單倍體育種中應用最廣的方式,通過組織培養產生幼苗有兩大途徑:一是通過愈傷組織的誘導分化,二是通過胚狀體誘導。采用胚狀體誘導能提高幼苗產生速率,且穩定性高,從而節省了資源,提高了效率[1-7]。【前人研究進展】胚狀體誘導頻率受多個因素的影響,如基因型、培養基、預處理、培養材料及條件等[6-13]。陳春艷等人認為4 ℃低溫預處理48 h能顯著提高花藥胚狀體的誘導率[14]。賈永炯的研究發現在含0.4~0.8 mg/L 2,4-D的Nitsch培養基上,能提高胚狀體發生頻率[15]。王仲慧[16]、李婷婷[17]等人的研究說明基因型是影響誘導率的一個重要因素。潘莉等人的研究發現,蔗糖濃度及光照強度等對胚狀體誘導率也會產生影響[18]。李春玲[13]與王立浩[19]等人對培養基中添加的碳源及其濃度進行了試驗,結果發現,3 %的蔗糖對花藥的誘導率最高。【本研究切入點】前人的試驗多是研究某一或幾個因素對花藥或葉片誘導頻率的影響,鑒于此,作者在前人實驗的基礎上,通過對花藥與葉片作為培養材料在各影響因素下的誘導能力進行比較。【擬解決的關鍵問題】著重對花藥與葉片各自最適生長激素與細胞分裂素的比例及濃度進行探討,以期為提升煙草胚狀體誘導效率提供依據。
1 材料與方法
1.1 試驗材料
供試的煙草雜交品種為鉀高效品系與其他抗黑脛病烤煙品種的雜交子一代,雜交組合為①♂凈葉黃×♀HKDN-5,②♂HKDN-5×♀革新3號。所有雜交組合于2017年3月移栽至湖南農業大學耘園基地,采用常規田間管理方法,2017年5月下旬開始現蕾。
1.2 基本培養基
花藥:1/2 MS + 0.1 mg/L IAA + 0.25 mg/L 6-BA + 3 % 蔗糖 + 0.7 % 瓊脂, pH 5.8。
葉片:1/2 MS + 0.1 mg/L IAA + 0.5 mg/L 6-BA + 3 % 蔗糖 + 0.7 % 瓊脂, pH 5.8。
1.3 實驗設計與方法
1.3.1 無菌材料獲得 ①花藥:晴天摘取花冠與花萼等長或花冠超出部分不超過花萼1/3的花蕾,4 ℃冰箱中預處理2 d后,將花蕾放入超凈臺進行消毒。消毒步驟為:先用無菌水沖洗2次;接著用75 %酒精漂洗30 s,后用無菌水沖洗3次;再用20 % NaClO和少量吐溫20浸泡15 min,后用無菌水漂洗4次,最后置于無菌濾紙上除濕。用鑷子撥開花冠,小心取出花藥。②葉片:采用花藥離體培養產生的幼苗,經單倍體鑒定后,取上部幼嫩的1~3片葉,切割成0.5 cm×0.5 cm的小塊。
1.3.2 基因型與外源激素添加量對胚狀體誘導的影響 在基本培養基的基礎上加入不同濃度的外源激素IAA與6-BA,每種激素均設0、0.125、0.25、0.5、1.0 mg/L 5個水平。將2種雜交子一代的花藥和葉片在各激素水平組合下分別進行培養,每種材料均有25個處理,每個處理重復5次,每個培養皿接種25顆,然后放入25 ℃,光照強度2000 lx,光照時間12 h/d的光照培養室進行培養。
1.3.3 其他因素對煙草胚狀體誘導的影響 ①光照。采用品種1的花藥和葉片作為試驗材料,分別在2000 lx,12 h/d的光照、暗處理10 d后移入光照條件與無光條件3種情況下分別離體培養,每組重復10次,其他條件保持一致。②接種密度。采用品種1的花藥和葉片,分別接種10、15、20、25、30、35、40顆于90 mm的培養皿中,各處理均重復5次,培養基條件與光照保持一致。
1.3.4 統計方法 自花藥接種后3 d觀察其污染情況,及時清除污染的培養皿,在上述各實驗條件下培養20 d后統計葉片胚狀體的誘導率,45 d后統計花藥胚狀體的誘導率。
花藥(葉片)胚狀體誘導率=
愈傷組織誘導率=
2 結果與分析
2.1 不同外植體與基因型對胚狀體誘導率的影響
由圖1和表1可知,基因型是影響胚狀體誘導率的重要因素之一,不同基因型之間花藥胚狀體的誘導率有極顯著的差異,在本試驗中品種1的花藥胚狀體誘導率達34 %,品種2誘導率僅為15 %,相差19 %。而二者的葉片胚狀體誘導率分別為24 %與17 %,相差雖只有7 %,但依然有顯著差異。對愈傷組織的誘導則不同,2種基因型之間的誘導率無較大差異。但同一基因型下,花藥與葉片之間,無論愈傷組織還是胚狀體,均有極顯著的差別,說明不同外植體和誘導率之間有更緊密的聯系。

表1 不同基因型對胚狀體誘導的影響
注:不同大寫字母為差異達顯著水平(P<0.01),小寫字母為差異達顯著水平(P<0.05),下同。
Note:The uppercase letter indicated significant difference at 0. 01 level. Lowercase letter indicated significant difference at 0. 05 level. The same as below.

1.♂凈葉黃×♀HKDN-5,2.♂HKDN-5×♀革新3號1.♂Jing ye huang×♀HKDN-5,2.♂HKDN-5×♀Ge xin No.3圖1 不同基因型的花藥和葉片誘導率的差異Fig.1 Differences in embryoid induction rate result from different genotypes
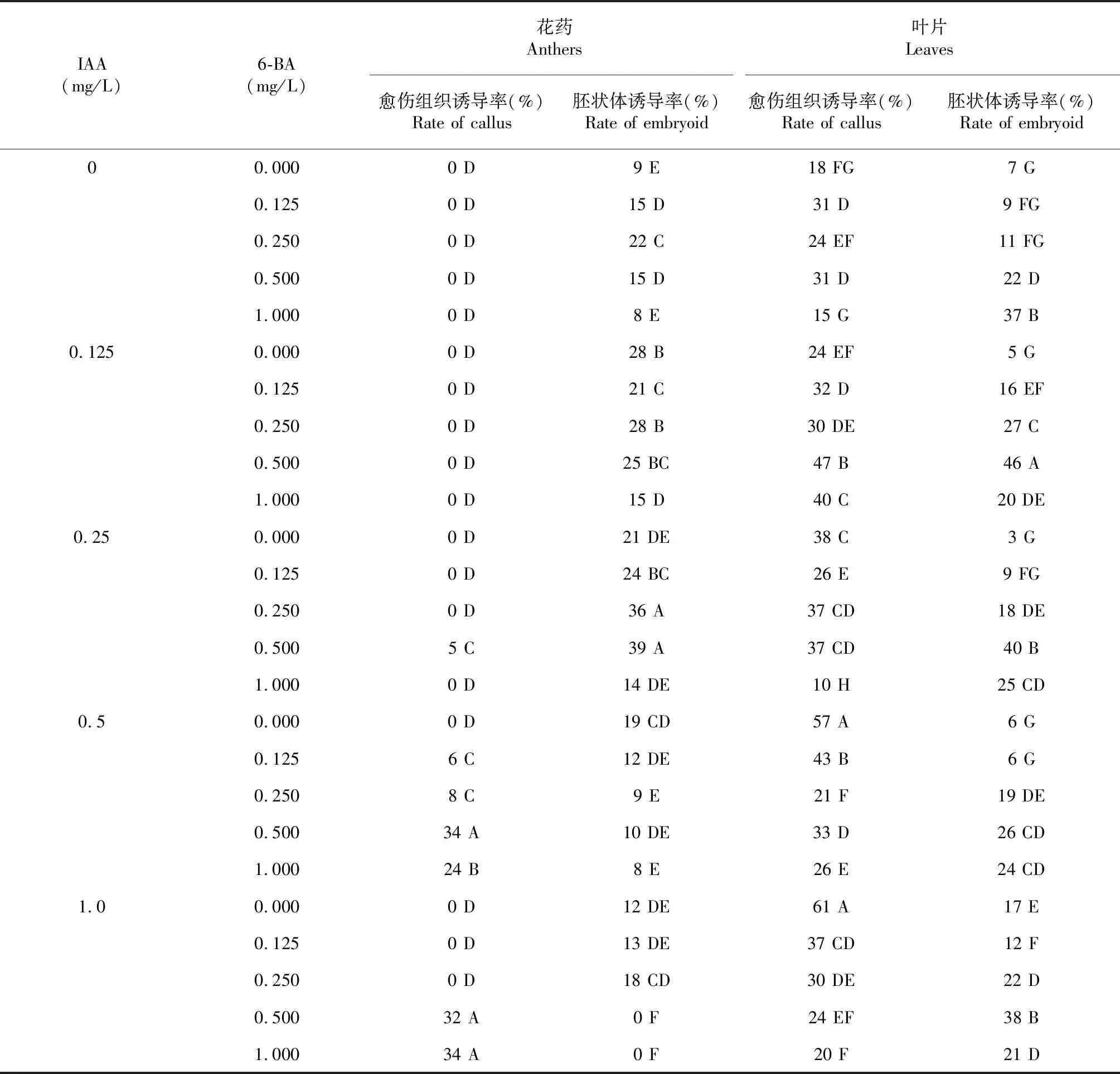
表2 不同激素濃度對胚狀體誘導的影響
2.2 培養基成分對胚狀體誘導的影響
2.2.1 外源激素濃度對胚狀體誘導的影響 如表2所示,外源激素濃度對煙草胚狀體誘導有極顯著的影響。不加激素有約8 %的外植體能被誘導出胚狀體并形成小苗,加入0.125~0.5 mg/L的外源激素后,能使胚狀體的誘導率普遍提升,提升幅度在5 %~38 %,加入1 mg/L的激素時,胚狀體的誘導率較不加激素時無明顯提升作用;而愈傷組織的誘導率卻有較大提升,最大提升了43 %。對于花藥培養而言,25組處理中共有6組產生了愈傷組織,以添加0.25 mg/L IAA+0.5 mg/L 6-BA為界,在此濃度下,花藥愈傷組織誘導率為5 %,在0.5 mg/L IAA+0.5 mg/L 6-BA濃度條件下愈傷組織誘導率達到34 %。當生長素濃度與細胞分裂素濃度出現極大差異或僅添加其中1種激素時,花藥依然傾向于開裂后形成胚狀體,而非愈傷組織。對于體細胞培養來說,25組處理均產生了愈傷組織,也均有胚狀體產生。且2種激素添加濃度相差越大,越傾向產生愈傷組織。
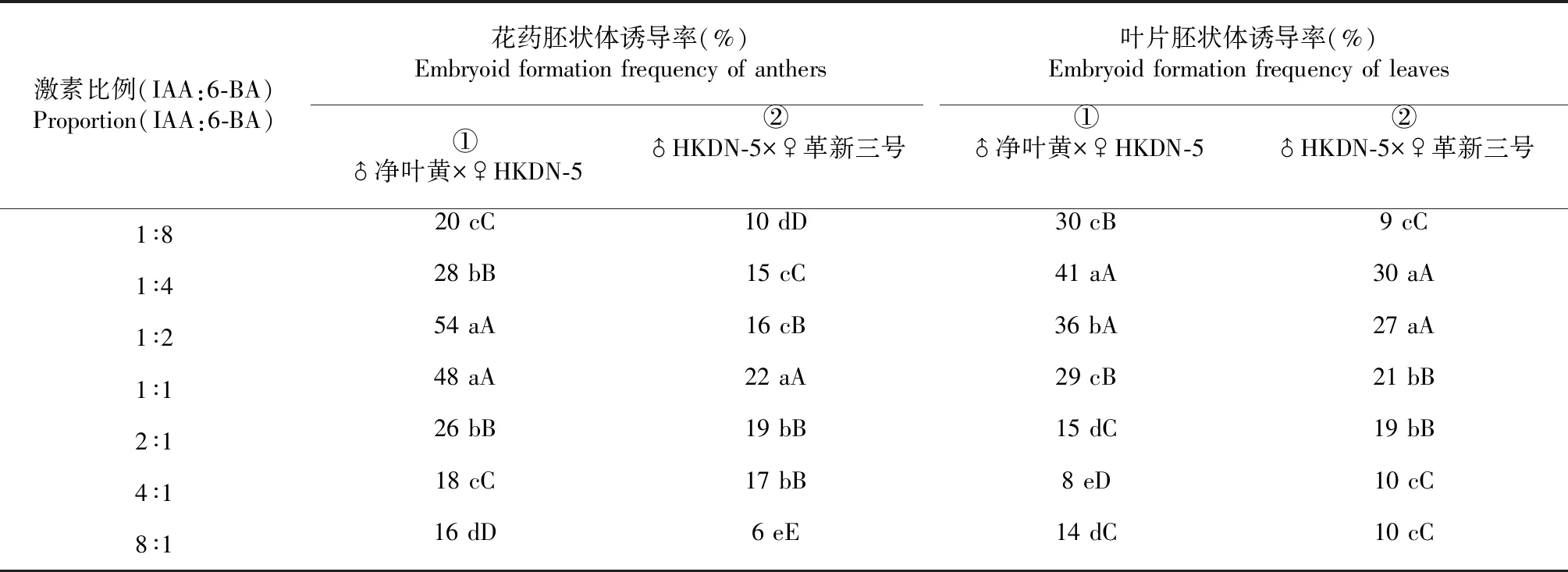
表3 不同激素比例對胚狀體誘導的影響
2.2.2 不同激素比例對胚狀體誘導率的影響 由表3可知,不同激素比例之間的誘導率差異變化更加顯著,IAA與6-BA的比例為1∶1或1∶2時,花藥胚狀體誘導率明顯高于其他比例,品種1的誘導率最大可達54 %。當二者比例超過1∶4時,誘導率極顯著下降,平均誘導率下降至10 %~21 %。對于葉片而言,當激素比例為1∶2或1∶4時,平均出胚率顯著高于其他比例,最大能達到41 %。且不同品種間的最適比例也有差別,品種1的花藥在IAA:6-BA為1∶2時具最高胚狀體誘導率,而品種2的花藥最適激素比例是1∶1。說明外源激素添加比例也對胚狀體誘導有著顯著影響,且與品種之間存在相互聯系。
2.3 其他因素對胚狀體誘導率的影響
2.3.1 光照對胚狀體誘導的影響 通過光照與黑暗條件下誘導率差異的對比實驗(圖2)發現,花藥胚狀體在光照條件下誘導率為40 %,無光條件下誘導率為36 %,誘導10 d后將黑暗中的一部分移入光照條件下,誘導率為48 %。說明對花藥而言,進行一段時間的暗處理可以在一定程度上刺激花藥胚狀體的萌發。葉片在光照條件下的胚狀體誘導率為36 %,無光條件下誘導率為48 %,誘導10 d后將黑暗中的一部分移入光照條件下,誘導率為58 %,說明無論是10 d暗處理,還是進行20 d的暗培養均可提高葉片胚狀體的萌發,但胚狀體萌發后若不及時移入光照環境下,對幼苗的生長不利,易形成白化苗,植株瘦弱,生長速度大幅減緩。
2.3.2 接種密度對胚狀體誘導的影響 圖3和表4表明,花藥胚狀體的誘導率并不會隨著密度的提高而出現明顯增加。但隨著密度的提高,誘導出胚狀體的花藥在總數上是低密度的1.2倍,提高花藥密度有利于節約資源與成本。與花藥培養不同的是,對于體細胞而言,隨著接種密度增大,胚狀體的誘導率有上升趨勢。當接種密度上升到每培養皿40顆時,胚狀體的誘導略有下降,說明密度過高也會抑制胚狀體的產生。
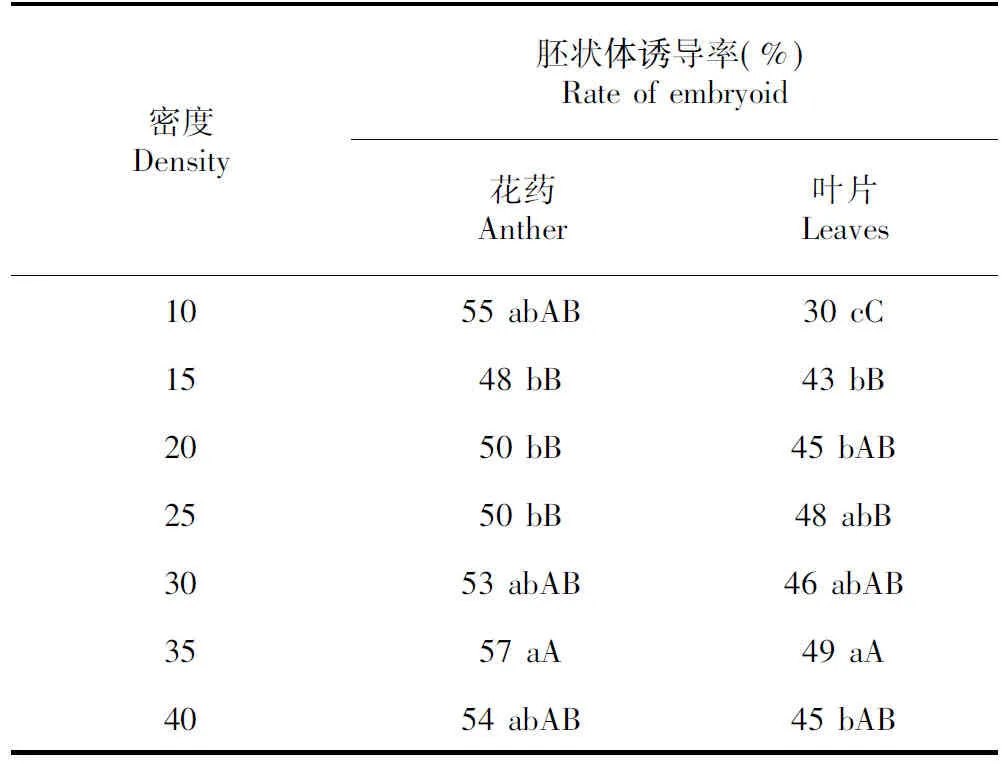
表4 密度對煙草體外培養的影響
3 討 論
對煙草胚狀體誘導效率的影響因素進行研究,結果表明基因型是影響煙草誘導出胚狀體的重要因素之一,基因型與外源激素間存在相互聯系,不同基因型的胚狀體萌發率有極大的差別。材料也是影響胚狀體誘導效率的因素[20],花藥與體細胞之間,花藥的誘導效率高,數量多,一次性能獲得大量胚狀體,有利于優良性狀的表達。但采用體細胞作為誘導材料時不受時間控制,易于獲得,節省時間成本,且在適宜的條件下也有較高的誘導效率。
激素是調控植物生長的重要物質[21]。本試驗的結果說明,添加0.1~0.5 mg/L IAA與0.25~0.5 mg/L的 6-BA的培養基上,胚狀體誘導頻率較不添加激素時,能得到顯著提高。但激素濃度升高到一定程度后(1 mg/L)反而會使花藥和葉片更加傾向形成愈傷組織,而非形成胚狀體,這在花藥胚狀體的誘導中更為明顯。這與慕平利[22]的研究結果一致。激素的比例也會對胚狀體的誘導率造成影響,不同基因型之間的最適比例并不相同,當生長激素與細胞分裂素處于1∶2或1∶1時,花藥萌發率最高,當二者比例為1∶4時,葉片胚狀體誘導率最高。綜上所述,采取較低的外源激素濃度能避免形成愈傷組織,提升胚狀體的誘導可能性,保持其適當的比例能提高獲得的效率。
除此之外,接種密度也會使誘導率產生差異,孫夕等[23]的研究表明,在一定范圍內花藥密度與誘導率呈正相關,超過一定范圍則無較大影響。本試驗結果說明花藥密度與誘導率之間并無明顯正相關,出現這一結果的原因可能是花藥的接種密度還沒有到達臨界值,花藥間的間距仍然較寬,并未出現群體效應;或者花藥密度增大雖誘發了群體效應但培養基營養水分供給不足,導致密度大的處理本應萌發出胚狀體的花藥停止了萌發,致使最后的萌發總數仍然不高。但接種密度小雖然誘導效率不減,卻并不利于節省空間與培養基原料。而體細胞的試驗結果說明,在一定程度上接種密度增大能提高胚狀體的誘導率,且當每個培養皿接種達到40個時胚狀體的誘導率即有所下降。
環境因素也是影響胚狀體誘導的重要因素之一。本試驗結果說明,光照不是花藥或體細胞萌發的必要條件,暗培養或是適當暗培養一段時間后轉移至光照條件下,更有利于胚狀體的誘導。但是光照也能刺激一些花藥或是體細胞萌發成胚狀體,且要把握好移入光照的時間,避免產生白化苗。
4 結 論
使胚狀體誘導效率提高主要體現在保持較高的胚狀體萌發率的情況下,節省時間與成本。本試驗結果說明采用體細胞進行胚狀體誘導,培養基采用1/2 MS+0.125 mg/L IAA+0.5 mg/L 6-BA,每培養皿接種35顆材料,可先在黑暗或弱光條件下培養7~10 d后,再移入光照下培養是高效誘導胚狀體的最適條件。

