水楊酸抑制生長素運輸而調節Acuce水稻根的生長
趙宜婷,武麗霞,詹曉平,鄧文麗,黃吳瑩, 魯新琪,韓 麗,周 璇,杜云龍*
(1.云南農業大學植物保護學院,云南 昆明 650201; 2.云南生物資源保護與利用國家重點實驗室,云南農業大學 云南 昆明 650201;3.云南農業大學農業生物多樣性與病害控制教育部重點實驗室,云南 昆明 650201)
【研究意義】根系作為植株的地下部分,在植物生長發育過程中起到非常重要的作用。月亮谷(Acuce) 水稻是元陽梯田的特色地方稻,開展植物激素對月亮谷水稻的根系研究,對于揭示激素對水稻根系發育的調控機制具有重要的理論意義,能充分了解根系發育與月亮谷的優異性狀之間的內在聯系,對開展新品種選育具有重要的應用價值。此外,開展月亮谷水稻根系發育的研究,對提高元陽梯田土地資源的利用、促進糧食增產、保護元陽梯田的持續發展是一個有效的手段。【前人研究進展】生長素在植物根系發育中起到一個核心的作用,許多研究揭示了生長素可調控水稻胚根[1]、不定根[2]和根毛發育。生長素的極性分布對植物發育具有重要作用[3],水楊酸可通過抑制細胞胞吞而影響生長素的極性運輸[4]調節擬南芥下胚軸的發育及向光性[5]。水楊酸(Salicylic acid,SA)作為一種重要的植物激素,廣泛參與植物抗病、抗逆、植株衰老、果實成熟、種子萌發、花發育等重要生命過程的調控[6]。水楊酸與水稻生長發育的研究,長期以來集中于其誘導植物系統獲得抗性的方面[7],但一些研究結果顯示出水楊酸可能直接或間接參與了對植物根系發育的調控,例如水稻中的OsWRKY03作為依賴于水楊酸或茉莉酸防御反應途徑中的一個轉錄激活物,過表達OsWRKY03明顯減少了水稻根發育的起始及伸長[8]。真菌及病毒性病害對水稻生長發育的危害日趨嚴重[9-10]。月亮谷(Acuce)是云南元陽哈尼梯田上種植面積最大的地方稻,已有100多年的種植歷史。月亮谷屬于農家水稻品種,研究發現月亮谷水稻具有抗病性強、較強耐冷能力和產量穩定等優異的農藝性狀[11],并具有較高的遺傳異質性[12]和居群遺傳多樣性[13]及遺傳變異性[14]。UV-B的輻射可抑制月亮谷葉片的發育[15],而在月亮谷的根系中能夠分離到熒光假單胞菌[16]。【本研究切入點】對月亮谷水稻根系機制的研究還未見相關的研究報道。【擬解決的關鍵問題】通過研究,將揭示SA與生長素相互作用調控月亮谷水稻根系發育的機理。
1 材料與方法
1.1 實驗材料
月亮谷水稻來自云南元陽梯田,為本實驗室保存材料。
1.2 實驗方法
1.2.1 水稻材料組織培養 月亮谷水稻種子去殼,種子用70 % 無水乙醇表面消毒90 s;無菌水清洗1次,之后用20 % 次氯酸鈉溶液浸泡14 min,無菌水清洗5次;用滅菌濾紙將多余水分吸干,將處理好的種子置于1/2 MS培養基中培養。
1.2.2 水楊酸處理月亮谷水稻 種子去殼后,在1/2 MS培養基上黑暗培養2 d至種子萌發。萌發的種子轉至含有0.5、1、1.5、2 mM SA的1/2 MS培養基上培養,對照組為含有等量二甲基亞砜(Dimethyl Sulfoxide,DMSO)的1/2 MS培養基,種子在28 ℃人工氣候箱中進行黑暗8 h和光照16 h的培養,7 d后,對胚根、不定根、側根進行測量分析。
1.2.3 重力刺激條件下的月亮谷水稻生長 月亮谷水稻種子在28 ℃人工氣候箱中黑暗培養2 d后,光照培養4 d。水稻苗轉移至含有SA(0.5、1、1.5、2 mM)的1/2 MS培養基上,同時將培養平板逆時針旋轉90°,在光照條件下培養18、24、48、72、96 h,觀察胚根發育。
1.2.4 月亮谷水稻中生長素運輸檢測 月亮谷水稻種子在1/2 MS培養基上萌芽1 d后,轉至含有DMSO、100 μM SA、5 μM N-(1-萘基)鄰氨甲酰苯甲酸[N-(1-Naphthyl) phthalamic Acid,NPA]、5 μM NPA+ 100 μM SA的1/2 MS培養基上,分別測量統計光照培養18、24、48、72、96 h后的胚根長度。
月亮谷水稻種子在1/2 MS培養基上萌芽2 d后,轉至含有DMSO、100 μM SA的1/2 MS培養基上,光照培養5 d后,在重力刺激條件下培養18 h,之后取與地面平行的胚根部分,用HPLC-MS/MS的方法檢測生長素的含量。
1.2.5 月亮谷水稻根中胞吞觀察 月亮谷水稻苗經光照培養4 d后,胚根的根尖用4 μM FM4-64、100 μM SA(等體積DMSO為對照)及 25 μM 布雷非德菌素A (Brefeldin A,BFA)溶液共處理90 min,在激光共聚焦顯微鏡Leica SP5(所用參數:40倍放大,Zoom: 2,Frame: 4,Agron: 488 nm,)下觀察,并用Image J軟件測量BFA 小體的大小。
2 結果與分析
2.1 SA對月亮谷水稻根系的影響
為了揭示SA對水稻根系發育的影響,月亮谷水稻用不同濃度SA處理,與經DMSO處理的對照相比,隨著SA濃度的增加,月亮谷水稻胚根的生長受到明顯抑制(圖1),側根數量減少(圖2)。當SA濃度達到2 mM時,不定根的發育受到明顯抑制(圖3),說明SA的處理影響了水稻的根系發育。
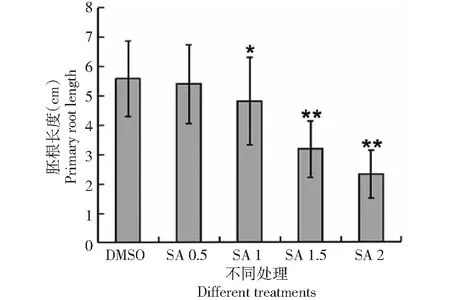
P<0.05,**P<0.01 (Student’st-test),下同。DMSO:DMSO處理;SA 0.5,SA 1,SA 1.5,SA 2:水稻苗分別用濃度為0.5、1、1.5、2 mM的SA處理DMSO treatment; SA 0.5, SA 1, SA 1.5, SA 2: rice seedlings treated with SA at a concentration of 0.5, 1, 1.5 and 2 mM, respectively圖1 SA對月亮谷水稻胚根長度的影響Fig.1 Effect of SA on the primary root length of Acuce rice
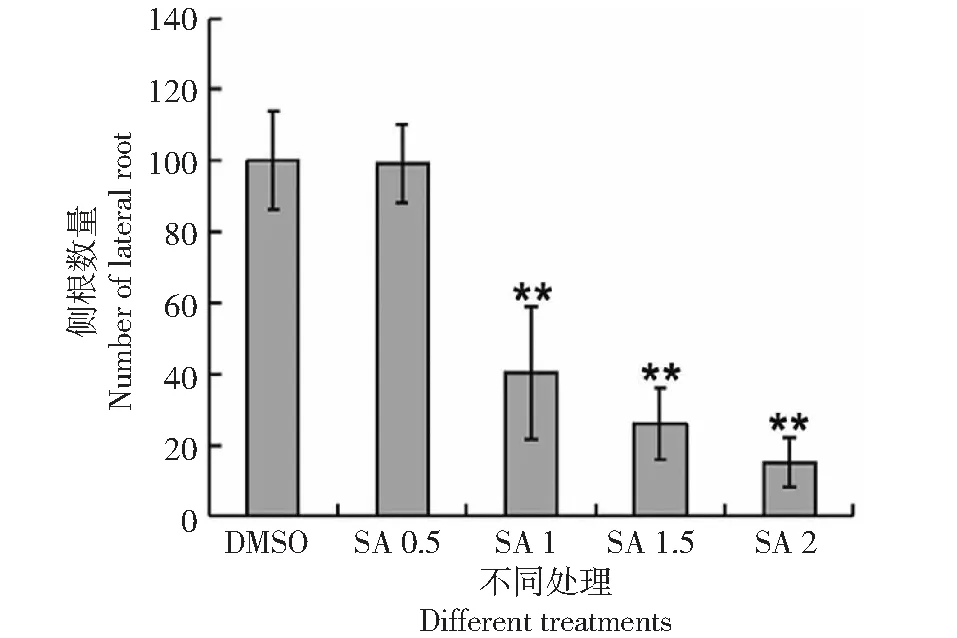
圖2 SA對月亮谷水稻側根數量的影響Fig.2 Effect of SA on the number of lateral root of Acuce rice
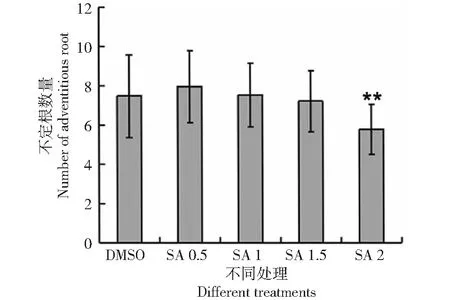
圖3 SA對月亮谷水稻不定根數量的影響Fig.3 Effect of SA on the number of adventitious root of Acuce rice
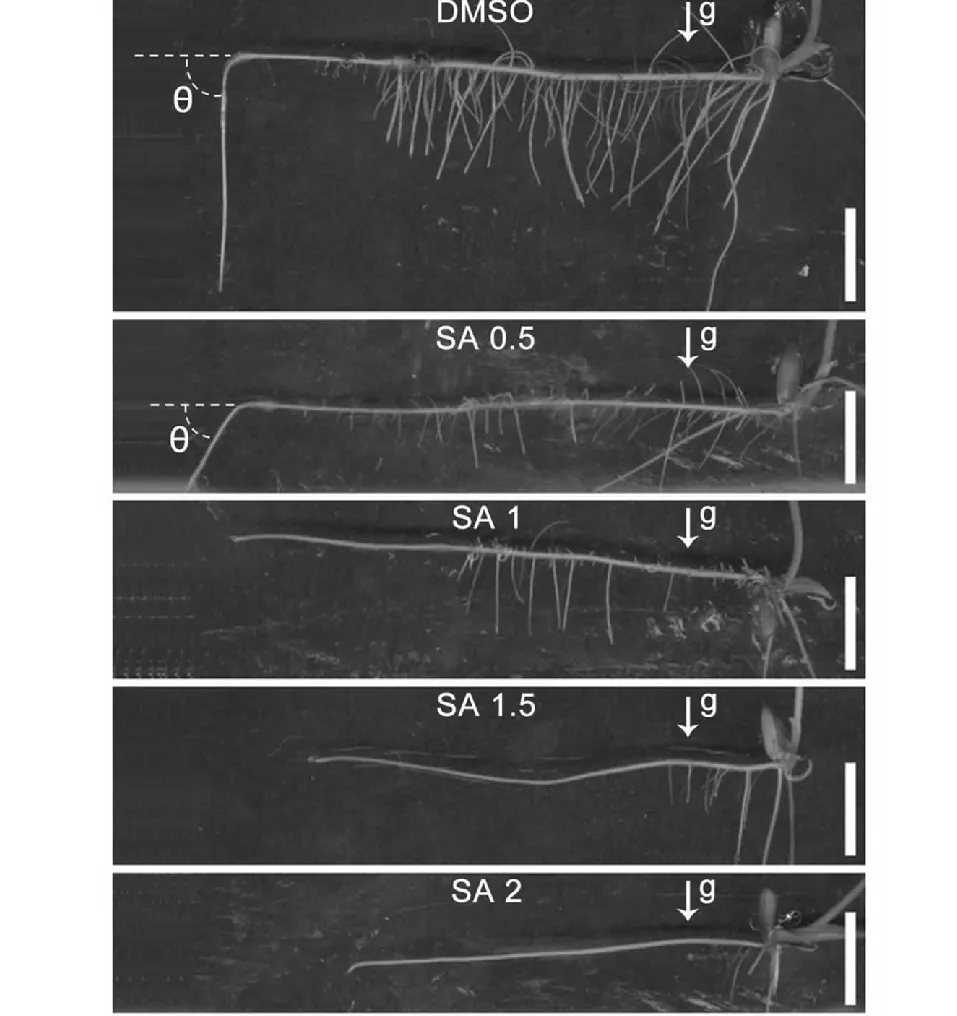
Bar = 1 cm;g:重力,箭頭指示重力方向。下同Bar = 1 cm; g: gravity,arrow showed the direction of gravity. The same was below圖4 重力刺激下的月亮谷水稻胚根及側根發育Fig.4 Development of primary root and lateral root of Acuce rice under gravity stimulation
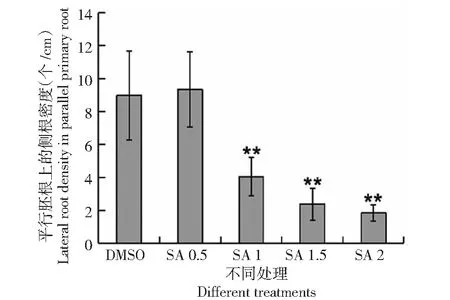
圖5 重力刺激下SA對月亮谷水稻側根密度的影響Fig.5 Effect of SA on the lateral root density of Acuce rice under gravity stimulation

圖6 重力刺激下SA對月亮谷水稻根彎曲度的影響Fig.6 Effect of SA on the root curve of Acuce rice under gravity stimulation
2.2 SA改變生長素分布
生長素的極性分布可以影響根系的生長[3]。為了探究SA影響月亮谷水稻根系發育是否與生長素分布有關,月亮谷水稻在含有SA (0.5、1、1.5、2 mM )的1/2 MS培養基生長并經重力刺激(圖4),結果顯示隨著SA濃度的增加,與地面平行的胚根上,側根密度明顯降低(圖5)。與對照相比,在低濃度SA(0.5 mM)處理下,胚根的彎曲開始明顯變小(圖4,圖6)。當SA濃度升高到1 mM 時,胚根的生長與水平面呈平行狀態(圖4,圖6)。說明SA的處理會改變生長素的分布,使得水稻根系的生長發育受到影響。
2.3 水楊酸影響月亮谷水稻根中的生長素運輸
為了進一步揭示SA影響水稻根系發育與生長素分布之間的關系,用生長素運輸抑制劑NPA處理月亮谷水稻。當采用低濃度SA(0.1 mM)處理水稻時,與經DMSO處理的水稻相比(圖7),胚根的生長沒有受到明顯的影響(圖8)。但是,用生長素運輸抑制劑NPA(5 μM)處理后,與用DMSO及SA(0.1 mM)處理的水稻相比(圖7),水稻胚根長度明顯變短(圖8)。當用NPA(5 μM)與SA(0.1 mM)同時處理水稻時,與經NPA處理的水稻相比(圖7),月亮谷胚根的長度明顯伸長(圖8)。同時,在重力刺激條件下,水稻經0.1 mM SA處理(圖9),測量水稻胚根中的IAA含量,發現經SA(0.1 mM)處理的月亮谷胚根中的IAA含量明顯升高(圖10)。這些結果顯示SA影響了生長素的運輸而調節水稻根系發育。

DMSO:DMSO處理;SA 100:水稻苗用濃度為100μM的SA處理;NPA 5:水稻苗用濃度為5μM的NPA 處理;NPA 5 + SA 100:水稻苗用濃度為 100 μM的SA和5 μM的NPA 同時處理。下同DMSO:DMSO treatment; SA 100: Rice seedlings treated with 100 μM SA; NPA 5:Rice seedlings treated with 5 μM NPA; NPA 5 + SA 100:Rice seedlings treated with 100 μM SA and 5 μM NPA. The same as below圖7 不同培養基處理下月亮谷水稻胚根的表型Fig.7 The phenotype of primary root of Acuce rice treated with different media
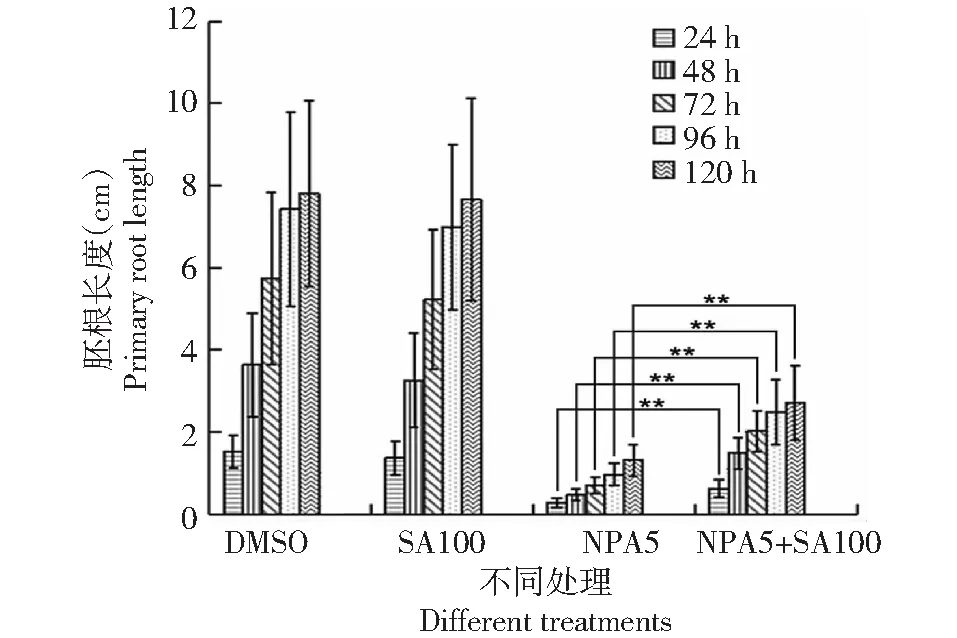
圖8 不同培養基對月亮谷水稻胚根長度的影響Fig.8 Effect of different media on the primary root length of Acuce rice

IAA,測量橫向生長胚根中的生長素含量IAA, measurement of auxin content in the horizontal primary root圖9 月亮谷水稻重力刺激示意圖Fig.9 The schematic diagram of gravity stimulation on Acuce rice
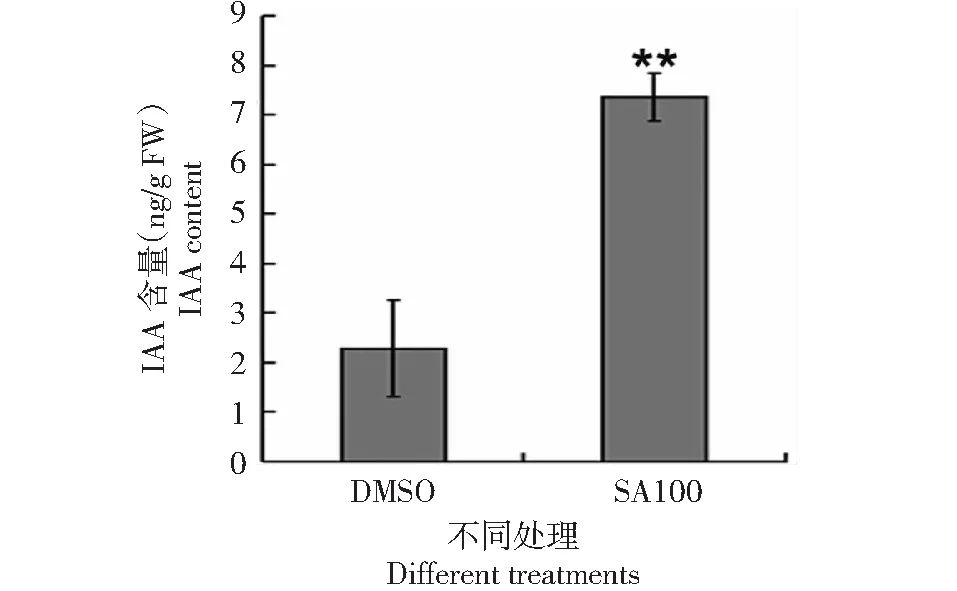
圖10 SA處理月亮谷水稻胚根后的生長素含量Fig.10 Auxin content in the primary root of Acuce rice treated with SA
2.4 水楊酸抑制水稻根表皮細胞的胞吞
水楊酸可以抑制網格蛋白clathrin介導的胞吞,從而調節生長素的運輸[4]。生長素輸出蛋白的不對稱分布可以調節生長素的極性分布,從而有利于生長素的運輸。在水稻中,生長素輸出蛋白相關基因已經被鑒定[2,17-18]。蛋白轉運抑制劑brefeldin A (BFA)處理植物細胞后,可抑制膜蛋白的轉運而在細胞質中形成BFA小體(BFA body),并能觀察細胞的胞吞[3-4]。為了揭示水楊酸是否通過抑制細胞胞吞而調節生長素運輸,月亮谷水稻胚根經水楊酸、蛋白轉運抑制劑BFA以及細胞膜染料FM4-64共同處理,在激光共聚焦顯微鏡下觀察根表皮細胞的胞吞(圖11),顯示低濃度水楊酸可以明顯抑制根表皮細胞的胞吞(圖12)。
3 討 論
激素間的相互作用對于植物的生長發育起到重要的作用。SA參與調控植物的生長發育,但是,SA對根系發育的調控機制并不清楚。研究發現較高濃度的水楊酸能夠抑制月亮谷水稻根系的發育,而較低濃度的水楊酸已能抑制月亮谷水稻根中的生長素運輸,這與水楊酸抑制根表皮細胞的胞吞密切相關。生長素的極性分布調控根系發育[1]。在重力刺激條件下,水楊酸對胚根彎曲和側根發育的影響與其濃度呈現相關性,但是,低濃度水楊酸處理已能影響生長素在胚根中的分布,這顯示水楊酸改變了生長素的運輸。在擬南芥中,觀察到水楊酸阻止了根的伸長、側根的起始和根毛的形成[19]。而水楊酸影響擬南芥根的波動生長可能與水楊酸受體NPR1及一氧化氮相關蛋白AtNOA1有關[20]。但是,試驗未觀察到水楊酸對水稻根波動生長的明顯影響,這暗示水楊酸可通過影響生長素的極性分布而調控根系發育,但水楊酸調控植物根系的生長在單子葉植物水稻和雙子葉植物擬南芥上仍存在一定的差異。生長素的極性分布與生長素輸出載體蛋白的分布密切相關[3]。SA能夠抑制擬南芥根表皮細胞中生長素輸出載體蛋白的胞吞,從而改變生長素的運輸[4]。在水稻中存在不同的生長素輸出載體蛋白,它們可定位于質膜、根冠、中柱鞘細胞、分生組織及側根原基,其表達及細胞定位受到生長素及其它激素的調控[2,17]。水稻中的生長素輸出載體蛋白也可調節生長素在水稻中的分布[2,17-18]。研究結果發現SA的處理抑制了月亮谷水稻根表皮細胞的胞吞,這顯示SA對植物細胞胞吞的抑制作用在單子葉與雙子葉植物中具有一定的保守性。因此,推測 SA具有抑制水稻中生長素輸出載體蛋白胞吞的作用,并改變了生長素運輸。考慮到水稻中生長素輸出載體蛋白的多樣性,還有待檢測水稻根中的生長素輸出載體蛋白在受到SA影響時的細胞定位情況,以確定水稻中特異生長素輸出載體蛋白與SA互作調控水稻根系發育的機理。

Bar:10 μm,箭頭指出BFA小體。BFA 25:水稻根用濃度為25 μM的BFA處理;SA 100 + BFA 25:水稻根用濃度為25 μM的BFA和100 μM的SA共同處理Bar: 10 μm, arrow head pointed out the BFA body; BFA 25:rice root treated with 25 μM BFA; SA 100 + BFA 25: rice root treated with 100 μM SA and 25 μM BFA圖11 SA抑制月亮谷水稻根表皮細胞的胞吞Fig.11 Inhibition of endocytosis by SA in the root epidermis cells of Acuce rice
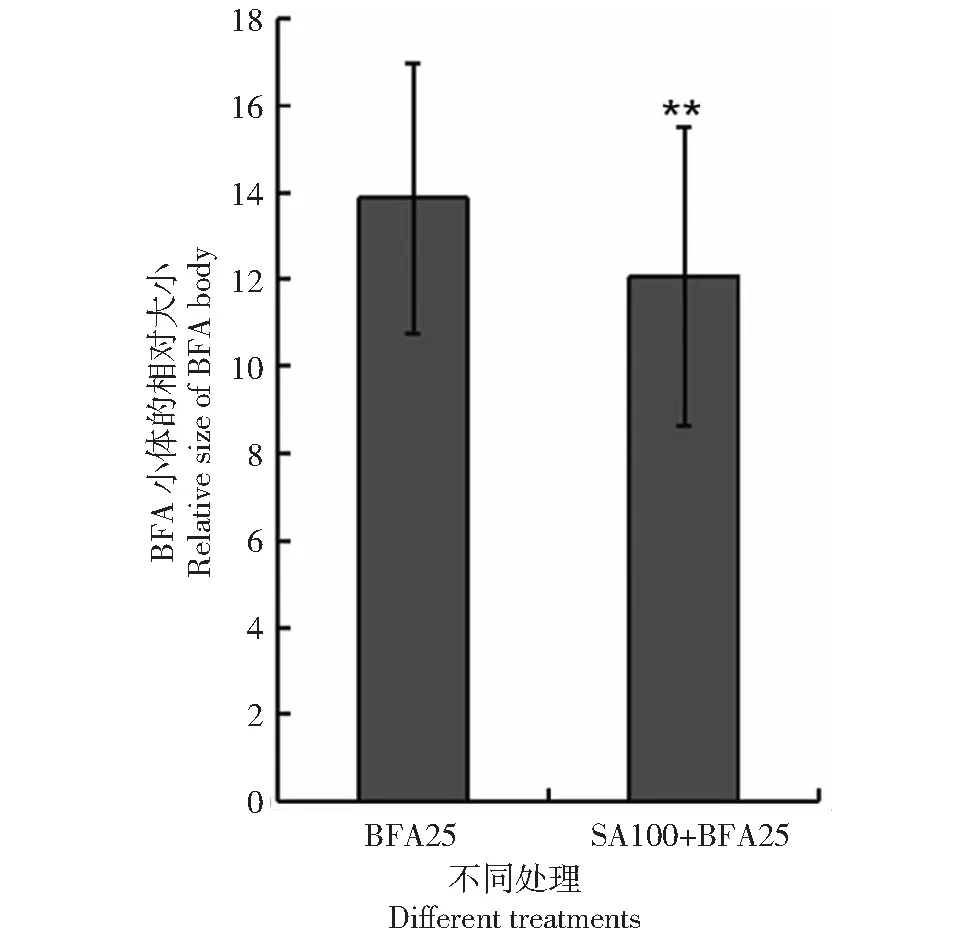
圖12 不同處理下BFA小體的大小Fig.12 Relative size of BFA body on different treatments
4 結 論
研究結果說明,SA可通過抑制生長素輸出載體蛋白的胞吞進而干擾生長素的極性運輸,并影響月亮谷水稻的根系發育。

