白內障超聲乳化術后惡性青光眼臨床分析
梁 麗,劉 勤,馬建軍,嚴蘭鳳
0引言
惡性青光眼(malignant glaucoma,MG)在1869年被Vol Graefe[1]首次報道,以虹膜周切術后發生眼內壓升高,同時伴有中央、周邊淺前房為特征。通常晶狀體-虹膜膈前移是它最典型的特征,常發生于閉角型青光眼患者青光眼濾過手術后。研究發現它也能發生在任何手術后,包括白內障超聲乳化手術[2]。常規囊袋內植入人工晶狀體的白內障超聲乳化術后發生淺前房,可能存在切口漏、瞳孔阻滯、囊膜阻滯綜合征、晶狀體半脫位、脈絡膜上腔積液、暴發性脈絡膜上腔出血、惡性青光眼等[3]。因為惡性青光眼很少見,常規囊袋內植入人工晶狀體的白內障超聲乳化術后就更少見,本文報告了白內障超聲乳化術后發生惡性青光眼的預后。
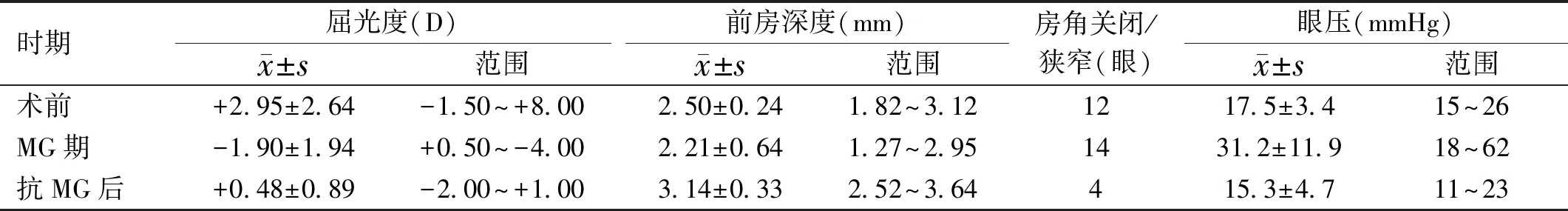
表1 白內障超聲乳化術后惡性青光眼不同時期參數比較
1對象和方法
1.1對象對2010-06/2018-05在甘肅省人民醫院接受常規囊袋內植入人工晶狀體的白內障超聲乳化術后發生惡性青光眼患者16例18眼進行回顧性研究。術前數據包括年齡、性別、屈光度、眼軸長度、超聲生物顯微鏡(ultrasound biomicroscopy,UBM)測量中央前房深度及房角、眼壓。排除標準:(1)有青光眼史的患者;(2)由其它原因引起的前房狹窄患者,例如瞳孔阻滯、人工晶狀體后殘留黏彈劑的囊袋阻滯綜合征、虹膜高褶型青光眼、脈絡膜上腔積液或暴發性脈絡膜上腔出血;(3)接受青白聯合手術的患者。惡性青光眼的診斷標準[4]:術后眼壓上升,使用縮瞳劑后眼壓持續升高,滴用睫狀肌麻痹劑有效;使用眼部A/B超或UBM檢查發現前房變淺乃至消失;B超可見玻璃體內的水囊。一旦被診斷為惡性青光眼,需要記錄屈光度、UBM測量中央前房深度及房角[5](圖1)、眼壓及惡性青光眼的發作時間。本研究通過我院倫理委員會審核通過,患者知情同意并簽訂《患者知情同意書》。
1.2方法惡性青光眼治療的最終目標就是使前房深度加深。采用階梯治療法,即睫狀肌麻痹劑和降眼壓藥聯合使用→YAG激光晶狀體后囊切開聯合玻璃體前界膜切開→前房成形術→晶狀體后囊切開聯合前部玻璃體切除術。如果前一階段的治療措施不能加深前房深度,后續的治療措施應在1mo內執行。首先采用睫狀肌麻痹劑和降眼壓藥,若無效采用YAG激光晶狀體后囊切開聯合玻璃體前界膜切開,再無效采用前房成形術,仍無效最終采用晶狀體后囊切開聯合前部玻璃體切除術。YAG激光在人工晶狀體眼或無晶狀體眼可由虹膜面擊穿,直接(無晶狀體眼)或沿人工晶狀體赤道邊緣切開晶狀體后囊及玻璃體前界膜,擊穿后瞬間可見房水流入前房,前房立刻加深。前房成形術是用25G的穿刺針將黏彈劑(10g/L透明質酸鈉)注入前房,并用針頭向后推人工晶狀體至正確解剖位,從而使前房加深,待黏彈劑自然吸收。晶狀體后囊膜切開聯合前部玻璃體切除術,在睫狀體平坦部做手術切口,將前部玻璃體徹底清除并切除中央部后囊,打開前房和后部的通路。在每一個治療階段需記錄屈光度、中央前房深度、房角及眼壓。
2結果
2.1白內障超聲乳化術前情況本研究共納入患者16例18眼,其中女14例16眼,男2例2眼。年齡52.5±9.7(40~62)歲。13眼遠視,3眼近視,2眼正視。平均眼軸長度20.26±0.71(18.46~23.92)mm。白內障超聲乳化術前,屈光度+2.95±2.64(-1.50~+8.00)D,前房深度2.50±0.24(1.82~3.12)mm,眼壓17.5±3.4(15~26)mmHg。在白內障術前,12眼(67%)因房角狹窄行激光虹膜周邊切開術,見表1。
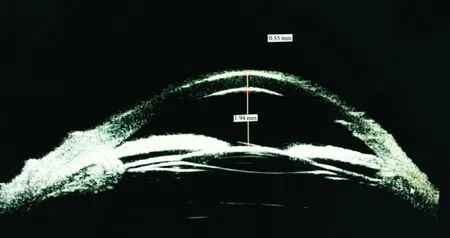
圖1 UBM測量中央前房深度及房角。
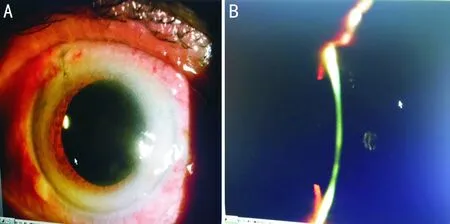
圖2 晶狀體后囊切開聯合前部玻璃體切除術后 A:瞳孔藥物性散大,人工晶狀體位正;B:中央前房深度約3.0mm。
2.2惡性青光眼期情況惡性青光眼發作是在白內障超聲乳化術后4.1±2.3(1~24)wk。14眼存在房角狹窄,其中11眼超過180°房角關閉,3眼周邊房角粘連。
2.3惡性青光眼治療后情況患者1眼(6%)使用睫狀肌麻痹劑(100g/L阿托品)和降眼壓藥聯合使用,用藥劑量也逐漸遞減,7眼(39%)使用YAG激光晶狀體后囊切開聯合玻璃體前界膜切開,6眼(33%)使用前房成形術,4眼(22%)最終采用晶狀體后囊切開聯合前部玻璃體切除術,均使惡性青光眼得以控制(圖2)。表1顯示,屈光度減小至+0.48±0.89(-2.00~+1.00)D,前房深度加深至3.14±0.33(2.52~3.64)mm,眼壓下降至15.3±4.7(11~23)mmHg,14眼(78%)房角開放。
3討論
對惡性青光眼已經有新的認識,它的機制包括晶狀體-虹膜膈前移導致初始的瞳孔阻滯轉變為虹膜-晶狀體阻滯,后房消失,房水向前排出受阻,逆流并集聚在玻璃體腔,玻璃體容積增大,進一步推動晶狀體-虹膜隔前移,由此形成惡性循環[6]。
低眼壓被認為在惡性青光眼的發病機制中扮演著重要角色。它可發生在切口制作過程中,如器械頻繁進出切口,或不恰當的關閉切口。低眼壓導致脈絡膜的擴張,繼而發生前房狹窄。房水正常彌散進入房角以維持眼壓平衡,然而,某些解剖結構特征(如小眼球、小角膜、淺前房、窄房角、晶狀體大而睫狀環小)被認為是惡性青光眼的可疑因素。雖然常規囊袋內植入人工晶狀體的白內障超聲乳化術后發生惡性青光眼很少見,但國外已有相關報道,Day等[7]對接受白內障超聲乳化103眼真性小眼球進行回顧性分析,發現6例7眼發生惡性青光眼,5眼因為術前房角關閉行激光治療,1眼術前存在高眼壓。5眼行YAG激光晶狀體后囊切開聯合玻璃體前界膜切開,其中3眼之后行睫狀體光凝術,1眼之后行青光眼小梁切除術。另外2眼行睫狀體光凝術,其中1眼之后行晶狀體后囊切開聯合前部玻璃體切除術。
Dave等[8]回顧性分析過去18a接受小梁切除術、白內障超聲乳化術、青白聯合術后發生惡性青光眼的28眼。發現10眼在白內障超聲乳化術后發生惡性青光眼,其中3眼有閉角型青光眼史。他們采用階梯式的治療方案,首先采用藥物治療,包括睫狀肌麻痹劑和降眼壓藥,隨后采用YAG激光晶狀體后囊切開聯合玻璃體前界膜切開。如果上述治療方法無效,若患者視力較好,就采用晶狀體后囊切開聯合前部玻璃體切除術;若視力較差,則采用睫狀體光凝術。隨訪結果表明27眼在使用或未使用睫狀肌麻痹劑情況下眼壓控制在21mmHg以下,中央前房在2.0CT以上。行小梁切除術后的惡性青光眼僅4眼單純用藥物得以控制。另外23眼,其中7眼行YAG激光晶狀體后囊切開聯合玻璃體前界膜切開,4眼行晶狀體后囊切開聯合前部玻璃體切除術,12眼行睫狀體光凝術,均使惡性青光眼得到有效控制,僅1眼無法控制。然而Dave等提及的治療方法并不能鑒別是否適用于單純白內障術后發生的惡性青光眼。本文回顧性分析16例18眼的惡性青光眼,重點對單純白內障術后惡性青光眼的治療進行了研究。
惡性青光眼治療的目標是控制眼壓、恢復前房解剖結構。Dave等認為50%惡性青光眼聯合使用藥物使之得以控制,包括晶狀體-虹膜膈前移的睫狀肌麻痹劑和降眼壓藥的聯合使用,僅14%惡性青光眼聯合使用一類藥[8-9]。雖然睫狀肌麻痹劑能部分或完全控制惡性青光眼,但不能解決潛在的眼壓失衡。當停用這些藥,惡性青光眼可能復發。因此,要有效遞減睫狀肌麻痹劑,就必須采用特殊的階梯式干預治療,以揭示青光眼的發病機制。
惡性青光眼的治療效果評價指標包括眼壓控制、恢復前房正常解剖關系。YAG激光晶狀體后囊切開聯合玻璃體前界膜切開,即激光由虹膜面擊穿,直接(無晶狀體眼)或沿人工晶狀體赤道邊緣切開晶狀體后囊及玻璃體前界膜,擊穿后瞬間可見房水流入前房,從而使前后節溝通,壓力達到平衡,以控制惡性青光眼[7-8,10-11]。如果單純使用激光治療無效,可以采用前房成形術,即在前房內注入黏彈劑,并用黏彈劑針頭向后推人工晶狀體。通過對前節施壓和將人工晶狀體恢復至正確的解剖位,這樣決定惡性青光眼嚴重性的后節壓力就可能被抵抗。如果前后節存在溝通,就能打破惡性青光眼的惡性循環。如果上述措施無效,晶狀體后囊切開聯合前部玻璃體切除術就是最后的解決方案[8,10-11]。本研究中女性患者占88%,且白內障術前遠視患者比例占72%。女性和遠視被認為是房角關閉的危險因素[12]。短眼軸和淺前房,也被認為是惡性青光眼的危險因素[13]。
本研究中惡性青光眼發生在白內障超聲乳化術后4.1±2.3(1~24)wk。患者典型的特征是近視、中央淺前房、狹窄或關閉的房角及高眼壓。白內障術后惡性青光眼最初的臨床特征是輕微的,表現為遠視、正常高值的眼壓、前房輕度變淺和房角狹窄。本文對16例18眼均采用階梯治療法,即睫狀肌麻痹劑和降眼壓藥聯合使用→YAG激光晶狀體后囊切開聯合玻璃體前界膜切開→前房成形術→晶狀體后囊切開聯合前部玻璃體切除術,效果較好。1眼單純接受藥物治療,6%的治愈率比已有報道低[8-9]。7眼(39%)行YAG激光晶狀體后囊切開。6眼(33%)行前房成形術,術后6h內均發生一過性眼壓升高,眼壓較術前升高最大達23mmHg,最小至8mmHg,治療措施包括靜脈滴注甘露醇,局部使用或/和口服降眼壓藥物。4眼(22%)行晶狀體后囊切開聯合前部玻璃體切除術。
綜上所述,白內障超聲乳化術后采用階梯療法能有效控制惡性青光眼。惡性青光眼治療效果表現為近視減輕、中央前房加深、房角開放、眼壓下降。本文中患者2例4眼行常規囊袋內植入人工晶狀體的白內障超聲乳化手術,1眼白內障術后發生惡性青光眼,同樣對側眼白內障術后也發生。由于白內障術后1眼發生惡性青光眼,就增加了對側眼同樣在白內障術后發生惡性青光眼的風險。所以對側眼在行白內障手術時,術者應提高警惕預防性聯合晶狀體后囊切開聯合前部玻璃體切除術,以阻止惡性青光眼的發生。

