缺氧誘導因子-1α及Foxp3在結直腸癌組織中的表達及臨床意義
孫艷麗,陳 飛,陳 武
(吉林省腫瘤醫院 1.內二科;2.核醫學科,吉林 長春130012)
近年來靶向腫瘤微環境成為腫瘤治療的新途徑,腫瘤微環境是由低氧、低PH和大量生長因子等構成的一個復雜系統。缺氧誘導因子1α被發現在多種惡性腫瘤組織過表達,是腫瘤適應缺氧微環境的重要調控因子。調節性T細胞是目前發現一種具有免疫抑制功能的重要細胞亞群,發現其在多種惡性腫瘤組織內浸潤,被認為可促使腫瘤發生免疫逃逸,與腫瘤進展及預后密切相關。叉頭狀螺旋轉錄因子(Foxp3)被認為是調節性T細胞的特異性標志物。本課題通過免疫組化方法研究結直腸癌患者組織內缺氧誘導因子-1α及Foxp3的表達情況,分析其相關性以及探討兩者表達水平與結直腸癌患者臨床病理特征的關系。
1 資料與方法
1.1 一般資料
收集我院2014年1月至2015年1月行手術切除的結直腸癌組織標本60例,所有結直腸癌患者術前均未行放、化療或免疫靶向治療,同時另取距離組織邊緣6 cm非腫瘤的癌旁組織石蠟標本為對照。其中男性38例,女性22例;年齡39-75歲(中位59歲);術后病理診斷分期:T1+T2期28例,T3+T4期32例;Ⅰ+Ⅱ患者27例,Ⅲ+Ⅳ期患者33例;腫瘤分化程度:高中分化36例,低分化24例。
1.2 免疫組化染色
結直腸癌組織,癌旁組織均用4%多聚甲醛固定,常規脫水、浸蠟、包埋、切片,然后常規脫蠟水化,采用SP法檢測組織中Foxp3和HIF-1α蛋白表達水平,DAB顯色,蘇木精復染,脫水,透明,封片,光鏡下觀察結果,結果判斷由兩名病理科醫師閱片,陽性細胞胞漿或胞核染成棕黃色。主要抗體包括:鼠抗人Foxp3單克隆抗體(Life Span Bioscience公司,美國),兔抗人HIF-1α單克隆抗體(英國Biorbyt公司)。
1.3 結果判斷標準
免疫組化染色結果所有病理染色切片均有兩名病理科醫師參照相關免疫組化反應結果的判斷標準對免疫組化結果進行判定,以細胞出現棕黃色顆粒為陽性結果。采用半定量法依照染色強度及染色細胞百分比進行判定。染色強度計分方法:無陽性染色0分,淡黃色1分,棕黃色2分,棕褐色3分;陽性染色細胞構成比計分方法:無陽性染色細胞0分,陽性細胞百分比≤10%為1分,陽性細胞百分比11%-50%為2分,陽性細胞百分比51%-75%為3分,陽性細胞百分比>75%為4分。最終評分為染色強度分數與陽性細胞百分比分數的乘積。≥4分,則代表陽性表達。
1.4 統計學分析
應用SPSS17.0統計軟件進行處理,Foxp3和HIF-1α在癌組織和癌旁組織的表達強度及結直腸癌病理程度的關系采用卡方檢驗,Foxp3和HIF-1α的表達相關性分析采用Spearman相關分析。以P<0.05表示差異具有統計學意義。
2 結果
2.1 Foxp3和HIF-1α在結直腸癌組織和癌旁組織中的表達Foxp3在腫瘤間質淋巴細胞胞核中表達,核內出現棕黃色顆粒為Foxp3陽性細胞。HIF-1α主要著色于腫瘤細胞核內及部分細胞質內,以細胞出現棕黃色顆粒為陽性結果,見圖 1。
結直腸癌組織中Foxp3的陽性表達率68.3%(41/60),HIF-1α的陽性表達率63.3%(38/60),相比于癌旁組織,均顯著上升,差異有統計學意義(P<0.01),見表 1。
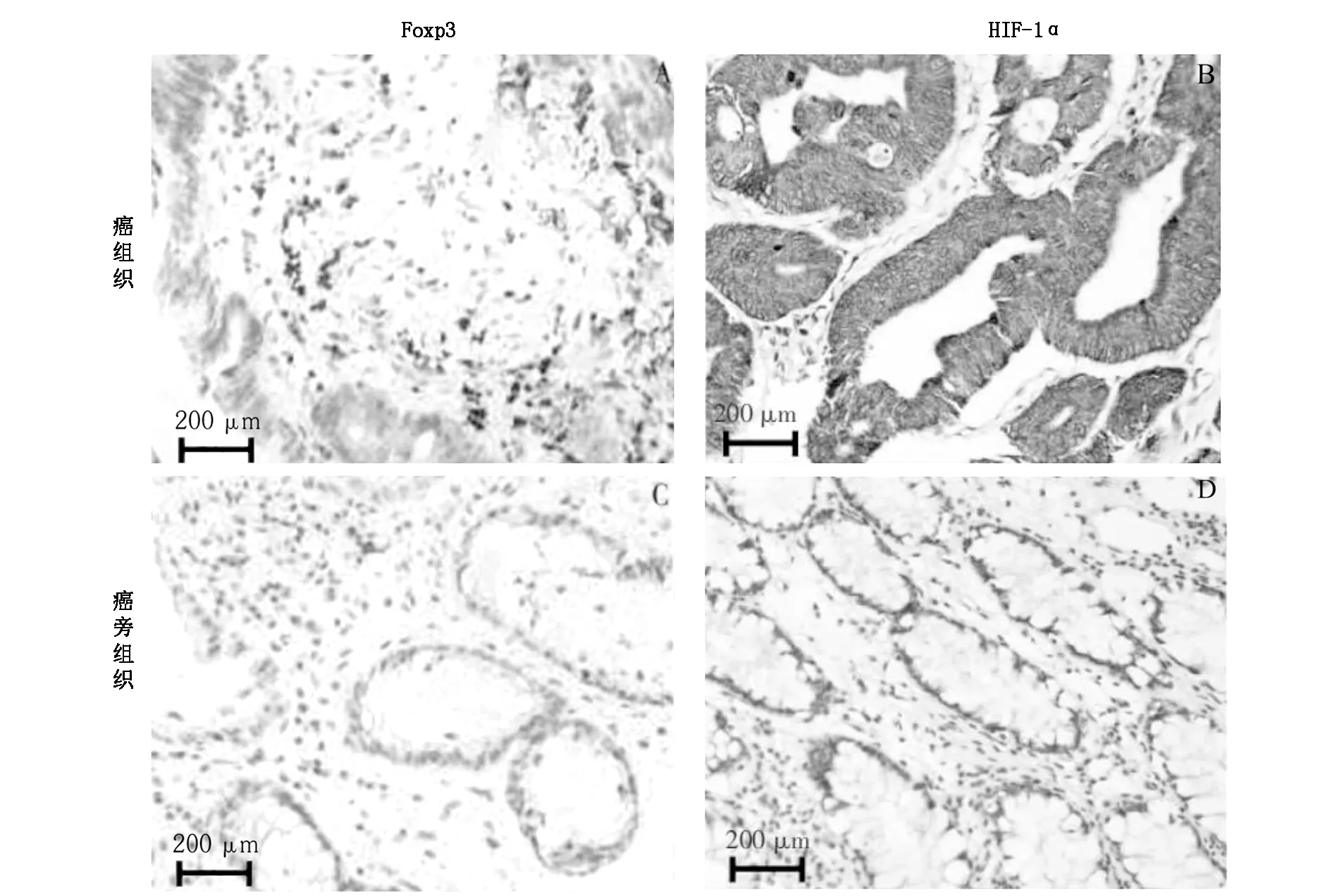
A:癌組織Foxp3表達。B:癌組織HIF-1α表達。C:癌旁組織Foxp3表達。D:癌旁組織HIF-1α表達。

表1 60例Foxp3和HIF-1α在結直腸癌組織和癌旁組織中的表達[例(%)]
2.2 結直腸癌患者組織中Foxp3和HIF-1α表達與臨床病理因素的關系結直腸癌組織中Foxp3的陽性表達率與腫瘤的分期、浸潤深度和淋巴結轉移有關,腫瘤分期為Ⅲ期/Ⅳ期,腫瘤浸潤深度為漿膜下和漿膜及漿膜外,以及淋巴結轉移的結直腸癌組織中的Foxp3陽性表達率高于腫瘤分期Ⅰ期/Ⅱ期、腫瘤浸潤深度為粘膜下層和肌層,以及淋巴結未轉移的結直腸癌組織,差異有統計學意義(P<0.05),而與性別、年齡、分化程度無關。見表2。
結直腸癌組織中HIF-1α的陽性表達率與腫瘤的分期、分化程度和淋巴結轉移有關,腫瘤分期為Ⅲ期/Ⅳ期,分化程度差,以及淋巴結轉移的結直腸癌組織中的HIF-1α陽性表達率高于腫瘤分期Ⅰ期/Ⅱ期、分化程度好,以及淋巴結未轉移的結直腸癌組織,差異有統計學意義(P<0.05),而與性別、年齡、腫瘤浸潤深度無關。見表2。
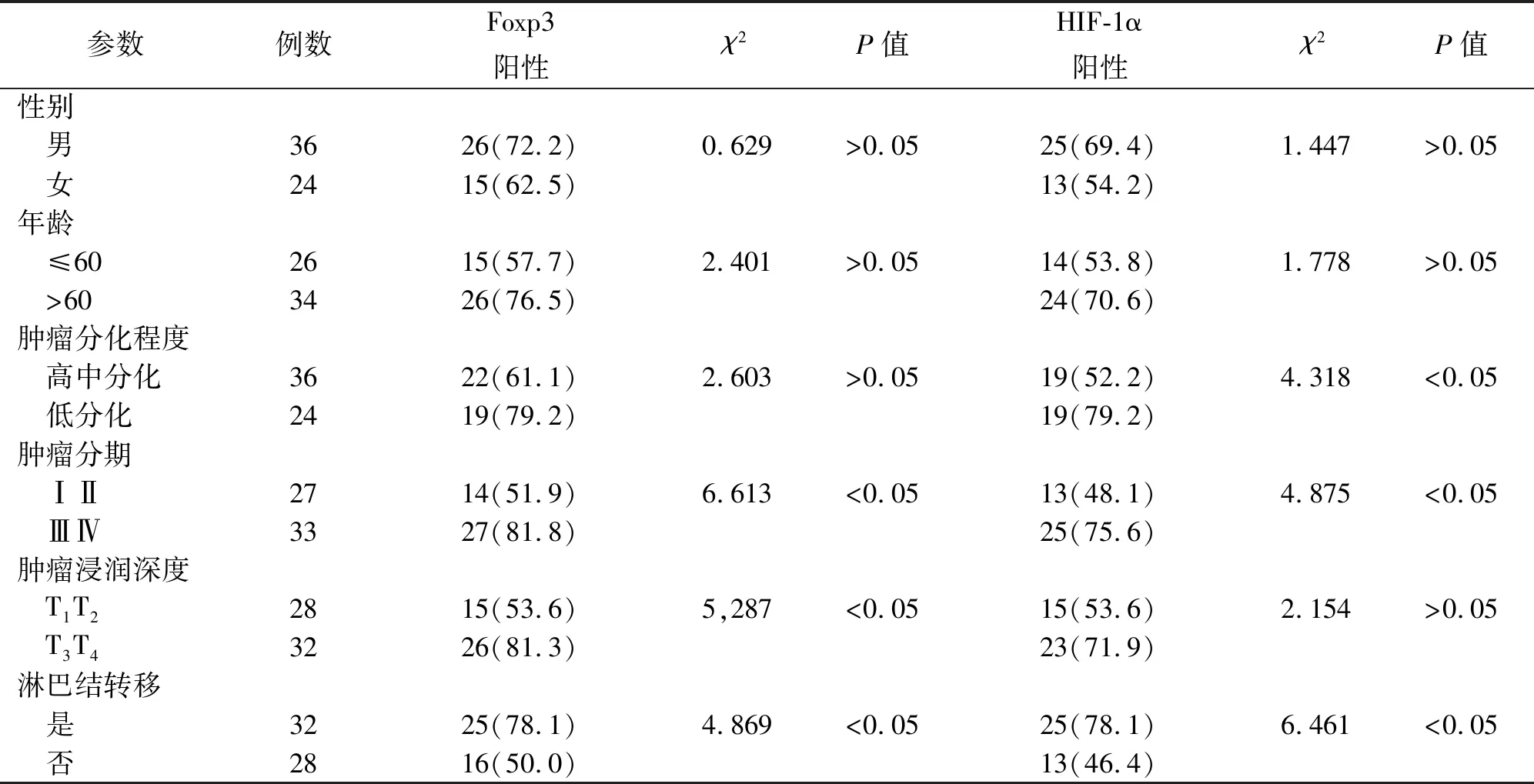
表2 60例結直腸癌組織中Foxp3和HIF-1α的表達與臨床病理因素的關系[例(%)]
2.3 結直腸癌組織中Foxp3和HIF-1α表達的相關性在結直腸癌組織中免疫組化染色中,Foxp3和HIF-1α的表達呈顯著正相關性(r=0.409P<0.01)。見表3。
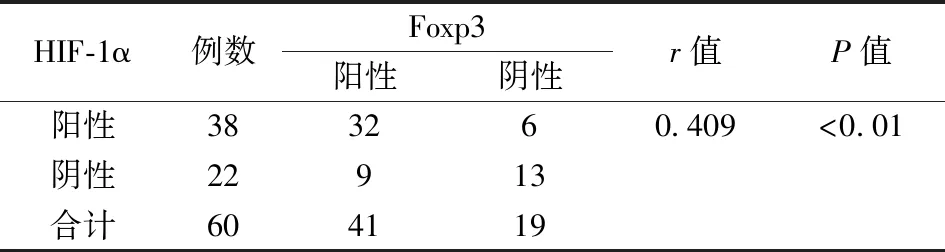
表3 60例結直腸癌組織中Foxp3和HIF-1α表達的相關性(例)
3 討論
近年來靶向腫瘤微環境成為研究的熱點,腫瘤微環境主要通過誘導新生血管形成,抑制免疫監視和免疫反應,孕育腫瘤干細胞等促進腫瘤發生及轉移。腫瘤微環境調控著腫瘤的多種生物學行為,包括腫瘤復發和轉移。
由于腫瘤細胞的快速增殖和高代謝狀態,導致腫瘤供血供氧相對不足,缺氧成為腫瘤組織中的常見現象,此時,腫瘤會作出一系列生物學行為改變以適應缺氧的環境,缺氧誘導因子-1 (hypoxiainducible factor 1,HIF-1)就是啟動這一系列適應性改變的一個重要因子。HIF-1α 為HIF-1所特有,它既是調節亞基也是功能亞基,決定HIF-1 的活性。缺氧應激引起HIF-1α的聚集、活化,活化的HIF-1通過與相應的靶基因序列結合調控多種缺氧反應基因的表達,以維持腫瘤的細胞的自身氧穩態及能量代謝平衡,在腫瘤的發生發展中起著極為重要的作用。
HIF-1α 在人類多種腫瘤中高表達,早期臨床研究報道HIF-1α在13 種實體腫瘤中高表達[1]。此后陸續報道了在食管癌[2]、胃癌[3]、前列腺癌、乳腺癌[4]、卵巢癌[5]等一系列惡性腫瘤中HIF-1α的高表達。本研究中結直腸癌組織中HIF-1α的陽性表達率63.3%,顯著高于癌旁組織(P<0.01),與臨床報道相符[6]。此外本研究證實結直腸癌組織中HIF-1α陽性表達率與患者性別、年齡、腫瘤浸潤深度無關,而與腫瘤的分期、分化程度和淋巴結轉移有關;腫瘤分期為Ⅲ期/Ⅳ期,分化程度差,以及淋巴結轉移的結直癌組織中的HIF-1α陽性表達率高于腫瘤分期Ⅰ期/Ⅱ期、分化程度好,以及淋巴結未轉移的結直腸癌組織,差異有統計學意義(P<0.05)。
調節性T 細胞(regulatory T cells,Tregs)是一類具有免疫抑制功能的T 細胞亞群。調節性T 細胞可分為多種亞型,其中最重要也是目前研究最多的為表達叉頭狀螺旋轉錄因子FOXP3 的天然調節性T 細胞及誘導調節性T 細胞。轉錄因子Foxp3是forkhead/ winged-helix 轉錄因子家族中的一員。作為重要轉錄因子對調節性T細胞的形成及免疫抑制功能起到至關重要的作用。Foxp3 是CD4+CD25+Treg 細胞的特異性標志,是參與腫瘤微環境中抑制免疫應答的重要調節基因。
本研究結果表明Foxp3在結直腸癌組織中的表達顯著高于癌旁組織(P<0.01),Foxp3陽性表達率68.3%,與臨床報道大致相符[7]。本研究證實隨著結直腸癌組織浸潤深度增加,淋巴結轉移和腫瘤分期增加,Foxp3表達進一步增加,而與性別、年齡、腫瘤分化程度無關。結直腸癌患者Foxp3陽性表達與腫瘤微環境的免疫抑制相關,隨著腫瘤的進展及病變范圍擴展,腫瘤細胞更易與機體免疫細胞直接作用或通過細胞因子介導的間接接觸,可能刺激CD4+ CD25+T細胞轉化為Treg,使Foxp3在腫瘤組織中呈高表達的同時介導并增強Treg細胞的抑制功能,加深患者體內免疫細胞對腫瘤的免疫耐受,促進了腫瘤的生長和轉移[8]。因此,本研究結果表明,隨著結直腸癌分期越晚,Foxp3表達越增加,免疫抑制越嚴重。
此外本研究分析發現結直腸癌組織中Foxp3和HIF-1α表達成正相關。且隨著結直腸癌組織出現淋巴結轉移和腫瘤分期增加,Foxp3和HIF-1α表達進一步增加,故聯合檢測Foxp3和HIF-1α在結直腸癌組織中的表達,有助于判斷結直腸癌轉移潛能及評估結直腸癌患者的預后。

