白花蛇舌草的抗癌作用研究進展Δ
王驍,范煥芳,李德輝,胡雪蕊,李兆星,郭旭瑾,王彤,杜志華#
(1.河北中醫學院附屬河北省中醫院腫瘤二科,石家莊 050011;2.河北省軍糧供應儲備庫,石家莊 050018;3.河北醫科大學附屬河北省腫瘤醫院外三科,石家莊 050011;4.河北中醫學院附屬河北省中醫院腦病科,石家莊 050011)
白花蛇舌草(Hedyotis diffusaWilld)又名二葉葎、白花十字草、尖刀草,屬茜草科耳草屬1年生披散草本植物。該藥最早記載于《廣西中藥志》,其味苦、甘,性寒,歸肺、胃、大腸、小腸經,全草皆可入藥,內服外用均可[1]。傳統中醫藥理論認為本品苦寒清泄,甘寒滲利,具有清熱解毒、消痛散結、利尿除濕之功效,可用于治療癰腫瘡毒、咽喉腫痛、毒蛇咬傷、熱淋澀痛及癌腫等癥[2]。現代藥理研究發現,該藥具有抗腫瘤[3]、調節免疫[4]、抗感染[5]、抗氧化[6]等作用。白花蛇舌草在惡性腫瘤治療中的應用十分廣泛,近年關于其抑制大腸癌[7]、胃癌[8]、肝癌[9]、肺癌[10]、乳腺癌[11]等的機制研究眾多,受到臨床及科研工作者的廣泛關注。鑒于此,筆者以“白花蛇舌草”“抗癌”“活性成分”“機制”“Hedyotis diffusaWilld”“Anticancer”“Active ingredients”“Mechanism”等為關鍵詞,在中國知網、維普、萬方、PubMed等數據庫中組合查詢2005年1月-2019年1月發表的相關文獻。結果,共檢索到相關文獻766篇,其中有效文獻47篇。現就白花蛇舌草抗癌作用研究進展進行綜述,旨在為其在抗癌領域的進一步開發利用提供參考。
1 白花蛇舌草的主要抗癌活性成分
截至目前,國內外學者已從白花蛇舌草中分離出蒽醌類、黃酮類、萜類、甾體類、烷烴類、多糖類、微量元素類、揮發油類等成分[12],而其抗癌活性成分主要為蒽醌類、黃酮類、萜類及甾體類中的某些化合物。其中,蒽醌類化合物在白花蛇舌草中含量較高,屬于其特征性成分之一[13]。于莉[14]報道白花蛇舌草蒽醌類物質中的2,7-二羥基-3-甲基蒽醌(結構式見圖1)、2-羥基-3-甲氧基-7-甲基蒽醌、2-羥基-1-甲氧基-3-甲基蒽醌、2-羥基-3-甲基蒽醌對人胃癌SGC-7901、肝癌BEL-7402、乳腺癌MCF-7細胞株/系均有抑制作用,其中2,7-二羥基-3-甲基蒽醌的抑制作用最強,且呈劑量依賴性,其對上述3種細胞株/系的半數抑制濃度(IC50)分別為84.40、54.22、53.72 μmol/L。白花蛇舌草黃酮類物質的主要成分包括槲皮素(結構式見圖2)、山柰酚以及兩者的糖苷。王宇翎等[15]的研究發現,不同劑量的白花蛇舌草總黃酮對S180荷瘤小鼠肝癌HepA小鼠的腫瘤細胞均有明顯的抑制作用,體外研究發現其對人肝癌Bel-7402、人肺癌H460及人乳腺癌MCF-7等細胞株均有一定抑制作用;其還可通過阻礙胃癌組織中氯離子胞內通道蛋白4(CLIC4)的表達來抑制惡性腫瘤組織間質的形成,從而減緩腫瘤細胞的浸潤和轉移[16]。萜類化合物是白花蛇舌草含有的又一類特征性成分,包括三萜類化合物和環烯醚萜類化合物,前者主要包括熊果酸(結構式見圖3)和齊墩果酸,后者主要包括雞屎藤次苷衍生物、車葉草苷衍生物等,均具有良好的抗癌作用[13]。白花蛇舌草中提取得到的五環三萜類化合物熊果酸能夠通過下調凋亡抑制基因Survivin的表達,激活血清胱天蛋白酶3(Caspase-3)和Caspase-9相關信號通路,抑制人肝癌細胞的復制[17]。白花蛇舌草中還含有甾體類物質,如β-谷甾醇(結構式見圖4)、豆甾醇和胡蘿卜苷。其中,β-谷甾醇、豆甾醇可通過阻滯細胞周期而抑制人肝癌SMMC-7721細胞的增殖,并能促使其發生典型的凋亡變化[18]。雖然近些年關于白花蛇舌草抗癌活性成分研究較多,某些活性成分的抗癌具體機制得到了較深入的闡釋,但現有研究大多停留于基礎研究階段,相關活性成分并未很好地應用于臨床,且相關新藥的研發工作稍顯滯后。
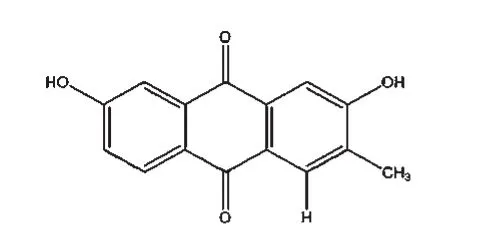
圖1 2,7-二羥基-3-甲基蒽醌結構式

圖2 槲皮素結構式
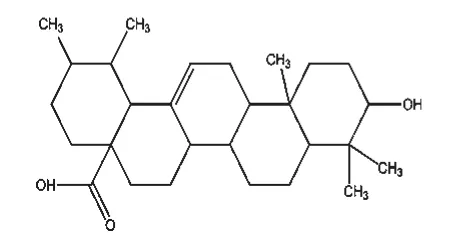
圖3 熊果酸結構式

圖4 β-谷甾醇結構式
2 白花蛇舌草的抗癌機制
白花蛇舌草含有多種抗腫瘤活性成分,大量研究發現,這些活性成分主要通過調節機體免疫功能、抑制腫瘤組織血管及淋巴管生成、誘導腫瘤細胞凋亡、調控相關信號通路、抗氧化等途徑實現對腫瘤細胞的抑制作用。
2.1 調節機體免疫功能
現已證實,癌癥的發生、發展與免疫監視、逃逸等免疫功能異常密切相關[19]。免疫療法在癌癥的治療中具有獨特優勢,在黑色素瘤、非小細胞肺癌、腎癌、膀胱癌等的治療中均已取得了良好的臨床效果,受到越來越多研究者的重視,是繼傳統手術、放療、化療、靶向治療外的又一重要的癌癥治療方法[20-22]。免疫療法是通過激發或調動機體免疫系統來增強腫瘤微環境抗腫瘤免疫力,從而控制和殺傷癌細胞的一種治療方法,該方法可增強T細胞、自然殺傷(NK)細胞等免疫細胞對腫瘤細胞的抑制作用,是近年來的研究熱點[23]。研究發現,與使用白花蛇舌草多糖之前比較,白花蛇舌草多糖可促進免疫抑制小鼠脾淋巴細胞的增殖,提高NK細胞活性,能顯著提高小鼠血清白介素2、白介素6和腫瘤壞死因子α的水平(P<0.01),進而提高免疫抑制小鼠的免疫功能[24],還可以明顯提高免疫抑制小鼠的胸腺指數、脾指數、廓清指數以及吞噬指數(P<0.05),具有明確的增強免疫功能的功效[5]。與上述研究相類似,王航等[25]報道,1.75 g/kg的白花蛇舌草超微粉可非常顯著地提高小鼠外周血淋巴細胞增殖能力和血清中新城疫抗體水平(P<0.05),同時還能十分顯著地提高小鼠腹腔巨噬細胞的吞噬功能及脾臟指數(P<0.01),對機體的非特異性免疫功能和特異性免疫功能均有明顯的促進作用。可見,白花蛇舌草可通過提高機體免疫力、減輕患者免疫抑制等途徑發揮抑制腫瘤細胞的作用。
2.2 抑制腫瘤組織血管、淋巴管生成
腫瘤血管生成是指血管內皮細胞從現有的血管系統中分化、遷移而形成新微血管的復雜生物學過程;由于淋巴管生成機制十分復雜,目前尚無相關定論,一些學者認為血管內皮生長因子C(VEGF-C)、VEGF-D、淋巴管內皮細胞透明質酸受體1(LYVE-1)可能在腫瘤組織淋巴管的生成中起到重要作用[26]。研究已證實,腫瘤組織血管以及淋巴管的生成與腫瘤的生長、侵襲、轉移、復發和腫瘤患者的預后有密切的關系[27-28],而白花蛇舌草對腫瘤組織血管、淋巴管的生成具有明顯抑制作用。肖云等[29]將32只CT26腸癌模型小鼠隨機分為4組,每組8只,Ⅰ組為對照組,予生理鹽水0.1 mL/(10 g?d)灌胃,Ⅱ、Ⅲ、Ⅳ組小鼠分別予劑量為90、180、360 mg/(kg?d)的白花蛇舌草乙醇提取物灌胃,共給藥10 d,實驗開始后第32天殺死所有小鼠,發現Ⅱ、Ⅲ、Ⅳ組小鼠腫瘤組織的微血管密度均顯著低于對照組(P<0.05),腫瘤體積均顯著小于對照組(P<0.05)。還有研究發現,白花蛇舌草提取物可通過抑制人腎癌GRC-1細胞中基質金屬蛋白酶2(MMP-2)和MMP-9蛋白的表達而抑制腫瘤組織的血管生成[30]。此外,白花蛇舌草乙醇提取物具有抑制磷脂酰肌醇3-激酶(PI3K)、蛋白激酶B(PKB)通路活化,減緩人大腸癌細胞的生長,抑制血管及淋巴管形成的作用[31]。可見,白花蛇舌草可通過多種途徑實現對腫瘤組織血管及淋巴管生成的抑制,進而實現抗腫瘤作用。
2.3 誘導腫瘤細胞凋亡
細胞凋亡是在多細胞生物的生長、發育和死亡等過程中普遍存在的自然現象,其可發揮及時清除機體內受損和(或)多余細胞的作用,以維持組織器官及內環境穩態[32]。這個過程屬于基本的生物學現象,涉及一系列基因的激活、表達與調控等。細胞凋亡的異常與癌癥等疾病的發生有密切關系,誘導腫瘤細胞凋亡是目前治療癌癥的重要手段。研究發現,白花蛇舌草可使人胃癌SGC-7901細胞出現細胞核裂解、染色體形態異常,使該細胞DNA呈現片段化,細胞周期阻滯于G1期,并上調Bax基因的表達,下調Bcl-2基因的表達,從而誘導SGC-7901細胞的凋亡[33]。白花蛇舌草對結腸癌原代細胞、HCT-116細胞、Lovo細胞、HT-29細胞以及DLD-1細胞均具有明顯的降低細胞活力、促進細胞凋亡的作用,具體機制可能與哺乳動物雷帕霉素靶點(MTRO)抑制、p53抑癌基因活化以及表皮生長因子受體、血小板衍生生長因子受體降解密切相關[34]。白花蛇舌草總黃酮可能通過下調Ezrin基因表達并上調ICAM-1基因的表達,使人胃癌BGC-823細胞周期阻滯于G0/G1期,從而誘導該細胞的凋亡[8]。其乙醇提取物可阻滯人乳腺癌MCF-7細胞周期,抑制該細胞的增殖,促進其凋亡,其中以600 μg/mL白花蛇舌草乙醇提取物的作用效果最明顯[35]。此外,從白花蛇舌草葉和根中分離得到的新型環肽類化合物具有促進人前列腺癌細胞凋亡、抑制其增殖和遷移的作用[36]。可見,白花蛇舌草在誘導腫瘤細胞凋亡方面具有較重要的臨床意義,其可通過多種途徑實現對多種腫瘤細胞的誘導凋亡作用。
2.4 調控相關信號通路
信號通路的異常與腫瘤的形成、侵襲、轉移有密切關聯,通過糾正信號通路的異常從而達到抑制腫瘤細胞生長也是腫瘤治療的手段之一[37]。例如,程序性死亡蛋白1(PD-1)及其配體(PD-L1)信號通路的過度激活被證實與多種惡性腫瘤的發生有關,上述信號通路的異常會導致腫瘤細胞免疫逃逸,而PD-1抑制劑可通過恢復腫瘤特異性細胞免疫從而達到治療腫瘤的目的,此種方法在黑色素瘤、非小細胞肺癌等的治療中均取得了良好效果,是當下研究的熱點[38]。科學家同時還發現,白花蛇舌草亦可對多種信號通路進行調控。靳祎祎等[39]報道,白花蛇舌草可對轉化生長因子β(TGF-β)/Smad信號通路介導的上皮間質轉化產生抑制作用,從而防止大腸癌細胞的轉移。嚴兆坤等[40]研究發現,白花蛇舌草對細胞外調節蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)等信號通路均有抑制活化的作用,從而逆轉耐5-氟尿嘧啶(5-FU)HCT-8大腸癌細胞的耐藥性。此外,白花蛇舌草還可以通過抑制干細胞標記物LGR-5和OCT-4的表達,上調Wnt/β-catenin信號通路中負調控因子APC及磷酸化β-catenin)的表達,下調凋亡抑制基因Survivin的表達從而實現對腫瘤細胞的抑制作用[41]。可見,白花蛇舌草對信號通路的調控亦是多途徑、多靶點的,不僅可直接實現對腫瘤細胞的抑制,還能逆轉其對化療藥物的耐藥,防止腫瘤細胞轉移,但具體機制有待深入研究。
2.5 抗氧化
自由基是指帶有不成對電子的分子、原子團、原子或離子,又稱游離基,其性質十分活潑,其中氧自由基對人體的危害最大,人體許多疾病(包括腫瘤)的發生、發展與體內較高水平的氧自由基有密切關系[42-43]。過氧化氫的大量產生被認為是惡性腫瘤發生、發展過程中的關鍵因素,下調組織內過氧化氫濃度可抑制蛋白磷酸化過程,阻斷過氧化氫介導的相關信號通路,最終可阻礙腫瘤細胞的增殖[44]。白花蛇舌草正丁醇、石油醚等不同萃取部位對羥基自由基(·OH)和1,1-二苯基-2-三硝基苯基肼自由基(DPPH·)均具有較好的清除能力,提示白花蛇舌草具有良好的抗氧化作用[45]。類似研究亦指出,白花蛇舌草多糖對DPPH·有較強的清除能力及抗氧化作用,在0.24~1.20 mg/mL的劑量范圍內,其白花蛇舌草多糖乙醇溶液的抗氧化能力隨著白花蛇舌草多糖劑量的升高而增強[6]。Kim DH等[46]報道,從白花蛇舌草中提取得到的環烯醚萜苷具有抑制低密度脂蛋白氧化反應的作用。白花蛇舌草具有的抗氧化作用亦是其抑制腫瘤細胞的方式之一,但相對其他抗癌機制研究,目前關于白花蛇舌草如何通過抗氧化途徑而實現抗癌作用的系統研究相對較少。
3 結語
近些年國內外關于白花蛇舌草抗癌作用的研究較多,其抗癌活性成分、抗癌機制在某些領域取得了一些進展,目前認為其主要抗癌活性成分為蒽醌類、黃酮類、萜類及甾體類中的某些化合物,這些抗癌活性成分主要通過調節機體免疫功能、抑制腫瘤組織血管及淋巴管生成、誘導腫瘤細胞凋亡、調控相關信號通路、抗氧化等途徑來發揮對腫瘤細胞的抑制作用。該藥在抗癌領域應用廣泛,但是基于白花蛇舌草的抗癌新藥研發工作仍十分滯后。檢索國內外文獻,發現目前含有白花蛇舌草的抗癌成藥絕大多數為口服藥,靜脈用藥僅白花蛇舌草注射液1種,且僅為癌癥治療的輔助用藥,劑型十分單一,尚無某種或者某類白花蛇舌草抗癌活性成分提純而得到的靜脈用藥[47]。白花蛇舌草的某些抗癌活性成分、抗癌具體機制研究仍不夠系統和深入,亦缺乏多中心大樣本的臨床研究支持。上述這些問題都有待日后進一步研究。

