hucMSCs-Exo對子癇前期孕鼠血清sFLt-1 VEGF的影響
熊智慧 王欣晨 官海漣 金美媛
子癇前期(PE)一直是臨床研究的熱點,是導致不良妊娠結局的主要疾病,其發病機制復雜,有大量的證據顯示胎盤血管形成異常是子癇前期發病過程中的一個中心環節,血管生成是血管內皮細胞增殖、遷移和細胞外基質降解共同參與過程,受血管生成因子和抗血管生成因子的調節[1]。人臍帶間充質干細胞源外泌體(hucMSCs-Exo)是人臍帶間充質干細胞(hucMSCs)通過旁分泌方式產生的一種直徑約30~100nm的膜性小囊泡,hucMSCs-Exo中含有多種蛋白質,在生物活動中起重要的調控作用,包括血管生成、免疫應答、炎癥反應、細胞凋亡等[2-3]。已有研究報道外泌體可以促進人臍靜脈血管及腦血管的新生[4-5],并發現hucMSCs培養液能有效刺激胎盤血管再生[6],而hucMSC產生的外泌體能否刺激胎盤血管再生尚不清楚。本研究將hucMSCs-Exo用于子癇前期胎盤血管形成異常的孕鼠模型干預治療,從胎盤血管內皮功能修復、胎盤微血管密度來評價hucMSCs-Exo的生物學效應,為子癇前期的治療探索一種具有廣泛應用前景的生物制劑。
1 材料與方法
1.1 主要試劑與材料 人臍帶間充質干細胞購自廣州賽業生物科技有限公司;10周齡健康SD雌性大鼠(200~250 g)購自第二軍醫大學實驗動物中心[SCXK(滬)-2013-0016];流式細胞儀(美國BD公司);FEI Tecnai 12 型透射電子顯微鏡(Philips 公司);Biorad Gel Dol EZ 成像儀(GEL DOC EZ IMAGER,Biorad,California,USA)。
1.2 hucMSCs及hucMSCs-exo的分離提取及鑒定 人臍帶間充質干細胞,獲取P3代細胞分別從形態學進行觀察,流式細胞計數進行細胞表面標志CD45、CD29、CD90、CD34、CD105鑒定、成骨成脂試驗進行分化能力的鑒定。超速離心取出FBS中的外泌體待用。P3代hucMSCs融合至90%左右時將培養基更換為無血清培養基培養48h后,充分收集上清液。利用超速離心方法從hucMSCs培養上清液中獲取hucMSCs-exo,分別進行電鏡及蛋白CD63和CD81的鑒定。采用Image J軟件對目的條帶進行灰度值分析。
1.3 實驗動物分組與處理 取50只受孕成功的SD大鼠連續腹腔注射L-NAME,建立子癇前期模型大鼠[7],將模型大鼠分為5組,分別為PE組(n=10,不做任何處理)、PE+NC組[n=10、孕14d腹腔注射無菌生理鹽水,0.5ml/(只·d),共6d];L-Exo組[n=10,孕14d腹腔注射濃度為120μg/ml的外泌體,0.5ml/(只·d),共6d]、M-Exo組[孕14d腹腔注射濃度為140μg/ml的外泌體,0.5ml/(只·d),共6d]、H-Exo組[孕14d腹腔注射濃度為160μg/ml的外泌體,0.5ml/(只·d),共6d]。
1.4 標本收集及檢測 (1)實驗結束時,麻醉大鼠后,開腹取腹主動脈血。ELISA檢測血清血管生成因子(VEGF)和抗血管生成因子可溶性fms-樣酪氨酸激酶受體-1(sFlt1)的水平;(2)剖宮取出胎盤組織,剪取合適大小胎盤組織于多聚甲醛溶液中固定,石蠟包埋進行免疫組化檢測。
1.5 統計學方法 采用SPSS 21.0 統計軟件。計量資料以(x±s)表示,兩兩比較采用最小顯著差法(LSD法),多組之間的比較采用One-Way ANOVA 單因素方差分析,服從正態分布的計量資料兩組之間的比較采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 hucMSCs-Ex的提取和鑒定 透射電鏡下觀察到一組直徑為30~100 nm、大小不等的圓形或橢圓形膜囊泡。膜結構在囊泡周圍區域明顯,胞內的電子密度較低,見圖1A。Western blot結果顯示hucMSCs-exo有高表達CD63和CD81,見圖1B-C。以上結果表明,hucMSCs-exo被成功分離。
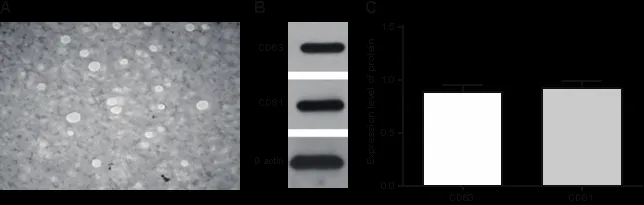
圖1 A hucMSCs-Ex在透射電鏡下的形態學(×100000);B hucMSCs-Ex的Western blot鑒定;C hucMSCs-Ex細胞陽性表達CD63和CD81
2.2 hucMSCs-exo對孕鼠胎盤微血管密度(MVD)的影響 采用免疫組化法檢測胎盤組織中MVD,顯微鏡下觀察胎盤組織CD31 陽性細胞表達情況,見圖2A-B,400倍視野下計算單位面積內CD31 陽性微血管數目,隨機選取5個視野,取平均值。結果顯示PE組和PE+NC組比較,MVD在L-Exo組,M-Exo組和H-Exo組明顯升高,H-Exo高于L-Exo組和M-Exo組(P均<0.05)。MVD在M-Exo組明顯高于L-Exo組,差異無統計學意義(P>0.05),見表1。

圖2 A:免疫組化法檢測各組大鼠胎盤CD31的陽性表達;B:各組大鼠的MVD;C:各組大鼠血清中VEGF的表達;D:各組大鼠血清中sFLT1的表達

表1 hucMSCs-exo對大鼠胎盤微血管密度的影響(x±s)
2.3 hucMSCs-exo對孕鼠血清sFlt-1及VEGF的影響 ELISA進行VEGF和sFlt-1表達的確定,見圖2C-D,結果:PE組與PE+NC組比較,差異無統計學意義(P>0.05)。同時還發現,VEGF的表達在L-Exo組、M-Exo組和H-Exo組明顯高于PE組和PE+NC組,而sFlt1的表達在PE組和PE+NC組則明顯下降,并且H-Exo組與PE組和PE+NC組相比有顯著差異,見表2-3。結果表明hucMSCs-exo通過抑制sFlt-1和促進VEGF的產生來促使血管內皮修復,從而增加胎盤微血管密度,達到改善子癇前期大鼠胎盤的形態。

表2 hucMSC-exo對大鼠血清sFlt-1表達水平的影響(x±s)

表3 hucMSCs-exo對大鼠血清VEGF表達水平的影響(x±s)
3 討論
子癇前期是妊娠期常見的并發癥,每年有50000~100000孕產婦死于子癇前期,是孕產婦死亡的主要原因之一[8]。子癇前期可影響機體各器官系統功能,在臨床上是醫源性早產最常見的原因,可導致胎兒生長受限、胎盤早剝以及圍生兒死亡。
子癇前期一直被臨床所關注,經過長期的探索研究,總結出多種治療子癇前期的方法,包括血管生成因子、血管舒張藥物、抗炎藥物及減少氧化應激的藥物的應用等[9],但目前尚處于基礎研究階段,因此尋找能夠促進血管內皮功能恢復,胎盤血管生成的治療方案尤為關鍵。近年間質干細胞(MSCs)在一些領域已取得一定的成就,如細胞替代治療、器官移植及再生醫學[10],但MSCs對人體也存在一定的負面作用,在免疫抑制和免疫調節中的不可控性,潛在的致瘤性,異常堆積等[11],因此,MSCs在疾病的治療中受到了限制。而外泌體作為機體細胞分泌的活性囊泡,所表現出來的治療優勢被越來越多的學者所認識。外泌體性能相對穩定,不存在異倍體性的風險,免疫排斥機會小,并且具有母體細胞相似的生物學作用[12],MSCs-Exo在某些疾病如神經系統疾病、免疫系統疾病及女性生殖系統疾病等動物實驗中已表現出良好的治療策略。
本研究結果發現,子癇前期大鼠可出現胎盤血管不同程度的異常,并與疾病的嚴重程度呈正相關,治療組經過1個療程的外泌體治療后,胎盤的MVD顯著升高(P<0.05),并且通過大鼠血清中sFlt-1、VEGF的蛋白量對比發現,經過1個療程的外泌體治療后,治療組的VEGF的蛋白表達量較對照組有不同程度的升高趨勢(P<0.05),而sFlt-1蛋白則有不同程度的下降趨勢(P<0.05)。上述研究結果提示hucMSCs-exo可在一定程度上恢復VEGF分泌的能力,促進血管內皮功能的恢復。其作用機制可能是hucMSCs-exo作為一種炎癥調控因子參與免疫調節,上調VEGF同時下降sFlt-1的表達發揮免疫調節作用和微環境調控的方式,繼而達到恢復血管內皮的功能。由此可見,一定濃度的hucMSCs-exo對SD大鼠血管內皮功能有一定的修復作用,能夠恢復胎盤血管生成能力。根據上述研究結果,可以推測hucMSCs-exo的胎盤移植,有望成為臨床防治子癇前期的新方式,然而其具體作用機制還需要進一步的研究,今后可以對hucMSCs-exo所攜帶的蛋白質及核酸分子進行分析,找出其有效成分及發揮重要作用的細胞信號通路,或者通過人工生物合成其有效成分,更直接的促進血管內皮功能的恢復及胎盤血管的生成,對臨床治療子癇前期具有重要的指導意義。
綜上所述,通過本實驗研究證實,hucMSCsexo可有效改善血管內皮功能,這種作用可通過調整sFLt-1與VEGF來發揮作用,hucMSCs-exo可以成為臨床防治子癇前期的新方法,但仍需要更加深入的研究來驗證。

