兩種飼養方式對蘇尼特羊肉脂肪酸組成和脂肪代謝相關基因表達的影響
袁 倩,王柏輝,蘇 琳,要 鐸,王德寶,趙麗華,靳 燁*
(內蒙古農業大學食品科學與工程學院,內蒙古 呼和浩特 010018)
肌內脂肪沉積是脂肪代謝氧化分解和合成的動態平衡結果,很大程度上受脂肪代謝相關基因和酶的調控,而肌內脂肪沉積水平又會對羊肉的脂肪酸組成造成影響。研究表明,過氧化物酶體增殖物激活受體(peroxisome proliferators-activated receptors,PPARγ)和固醇調節元件結合蛋白(sterol regulatory element binding protein1-c,SREBP1-c)是脂肪酸代謝中兩個重要的調控因子[1-3]。且SREBP1-c和脂肪酸合成酶(fatty acid synthase,FASN)是脂肪酸從頭合成的關鍵酶,表達水平的升高能夠顯著地增加甘油三酯在體內的沉積[4]。二酰基甘油酰基轉移酶(diglyceride acyltransferase,DGAT)控制著合成甘油三酯的最后一步,由甘油二酰加上脂肪酸合成甘油三酰[5]。過軍明等[6]研究表明DGAT的高表達可以降低飽和脂肪酸含量,增加單不飽和脂肪酸(monounsaturated fatty acid,MUFA)含量。激素敏感酯酶(hormone-sensitive lipase,HSL)能夠顯著調控脂肪組織的分解從而成為影響脂肪沉積的關鍵酶之一[7-8]。脂蛋白脂酶(lipoprotein lipase,LPL)控制著甘油三酯分解,LPL高表達可以促進MUFA積累[9]。脂肪酸脫氫酶(fatty acid desaturase,FADS)是多不飽和脂肪酸(polyunsaturated fatty acid,PUFA)合成途徑的關鍵酶,FADS1和FADS2受不同因素調控,FADS1的表達易受胰高血糖素抑制,FADS2的表達則更易受腎上腺素抑制[10-11]。Khang等[12]研究表明FADS2高表達可以降低n-6/n-3 PUFA的比例。
亞油酸、亞麻酸、花生四烯酸、二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)等不飽和脂肪酸是必需脂肪酸,機體不能自主生成,只能從食物中獲取,而這些不飽和脂肪酸是細胞膜、線粒體和其他代謝活躍部位的必需成分;因此,脂肪酸組成與食用健康息息相關。除此之外,肉中揮發性風味物質的形成與脂肪酸組成也有很大關系。脂肪中飽和脂肪酸尤其是長鏈脂肪酸在冷卻降溫時容易凝固,直接影響肉的口味[13]。不飽和脂肪酸本身具有很高的營養價值,它比飽和脂肪酸更容易氧化產生肉風味,特別是PUFA,極易被氧化,其氧化產物直接影響風味物質的組成[14]。肌肉中揮發性風味物質大部分為脂肪降解產物,如醛類、醇類、酮類、酸類、烴類等化合物。
蘇尼特羊肉肉質細嫩、味道鮮美,具有體質結實、結構勻稱、營養豐富的優點,深受廣大消費者的歡迎[15]。近年來,草場退化造成的草原載畜力不足和國家退牧還草政策的實施等原因使得很多地區由傳統放牧模式向舍飼模式轉變。大量研究表明放牧條件下羊肉的風味和脂肪酸組成不同于舍飼條件[16-19]。本實驗通過研究不同飼養方式對脂肪酸組成和脂肪代謝相關基因mRNA表達量的影響,分析脂肪酸組成和脂肪代謝相關基因mRNA表達量的相關關系,以期為今后通過調控脂肪代謝相關基因的表達改善舍飼條件下羊肉脂肪酸組成提供一定的理論依據。
1 材料與方法
1.1 材料與試劑
選取來自內蒙古烏拉特中旗育種園區12 月齡健康的放牧和舍飼蘇尼特羊各10 只,每組公母各半。放牧組和舍飼組平均體質量分別為41.49 kg和29.39 kg。凈肉質量分別為11.06 kg和9.12 kg。放牧組羊白天放牧,晚上不予補飼。牧草種類主要以烏拉特中旗荒漠化草原典型牧草為主(芨芨草、蒙古蔥、中間錦雞兒、沙生冰草、堿韭等十余種)。舍飼組羊以內蒙古限牧政策下的飼養模式為依據,即前9 個月處理同放牧組,后3 個月舍飼育肥。育肥階段食用農區飼草料(玉米秸稈、葵盤粉、葵花籽皮等,同時補充玉米精料)。兩組實驗羊在共同放牧9 個月后平均體質量大致相同。屠宰后迅速采集肉樣,取股二頭肌60 g于-20 ℃保藏待測定脂肪酸組成。其余股二頭肌小塊分割放入凍存管后投入液氮速凍,采回置于-80 ℃冰箱保存,待測定脂肪代謝相關基因mRNA表達量。
甲醇(色譜純)、三氯甲烷(分析純)、正己烷(色譜純)、三氟化硼-乙醚絡合物(分析純)、氯化鈉(分析純)、氫氧化鈉(分析純)、無水硫酸鈉(分析純)、硫酸(分析純)、乙醚(分析純)、37 種脂肪酸甲酯的混標 美國Sigma公司;RNAiso Plus、Premix Taq?Version 2.0(Loading dye mix)、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR?Premix Ex Taq? II、6hloading buffer、Marker DL2000 大連寶生物工程有限公司;RNase-free水北京天根生物技術有限責任公司;焦碳酸二乙酯 美國Intrivogen公司;核酸染料 無錫百泰克公司。
1.2 儀器與設備
ISQ型氣相色譜質譜聯用儀 賽默飛世爾科技公司;RE-52AA旋轉蒸發器 上海亞榮生化儀器廠;TU-1810紫外-可見分光光度計 北京普析通用儀器有限責任公司;HJ-6型多頭磁力攪拌加熱器 江蘇榮華儀器制造有限公司;5810R離心機 德國Eppendorf公司;ZHJH-C1112C超凈工作臺 上海智城分析儀器制造有限公司;BG-power5000型穩壓穩流電泳儀、水平電泳槽 北京百晶生物技術有限公司;凝膠成像系統、CFX96?Real-Time PCR Detection System 美國Bio-Rad公司;普通聚合酶鏈式反應(polymerase chain reaction,PCR)儀美國Applied Biosystems公司。
1.3 方法
1.3.1 脂肪酸的測定
1.3.1.1 總脂肪酸的提取
稱取5 g已均質肉樣加入氯仿-甲醇混合液(體積比2∶1),振搖2 h、浸泡8 h后用G3漏斗過濾,濾液中加入5 mL質量分數20%氯化鈉溶液,靜置分層,下層的氯仿層即為脂肪提取液。通過無水硫酸鈉脫水后,40 ℃旋轉蒸發濃縮得到脂肪。然后加入0.5 mol/L的氫氧化鈉-甲醇溶液5 mL,70 ℃下回流5 min,進行脂肪皂化,隨后加入5 mL的三氟化硼乙醚溶液,70 ℃下回流2 min,進行脂肪甲酯化。最后加入2 mL色譜純正己烷,70 ℃下回流1 min后,加入5 mL飽和NaCl溶液,靜置10 min,吸取出1 mL正己烷層于進樣瓶中,用0.22 μm有機濾膜過濾后,進行氣相色譜分析[20]。
1.3.1.2 氣相色譜檢測
氣相色譜條件:反式色譜柱(100 mh0.25 mm,0.20 μm),載氣為氦氣,載氣流速為1 mL/min,進樣口溫度:240 ℃,進樣量為1 μL,分流比為100∶1。采用程序升溫:初始溫度為60 ℃,保持1 min,然后以20 ℃/min的速率升至120 ℃,保持1 min;然后以5 ℃/min的速率升至240 ℃,保持15 min。
MS條件:離子源溫度為300 ℃,傳輸線溫度240 ℃,質量掃描范圍m/z 50~500,溶劑延遲時間4 min。
1.3.2 RNA的提取和反轉錄
采用TRizol法提取總RNA,經瓊脂糖凝膠法和紫外分光光度計檢測被提取總RNA完整性和含量。cDNA由反轉錄試劑盒法制備,置于-20 ℃保存、待用。目的基因和管家基因的引物參照美國國立生物技術信息中心中提供的序列進行設計,引物序列如表1所示。引物均由上海生工生物工程有限公司合成。熒光定量PCR程序為預變性:95 ℃ 30 s;變性:95 ℃ 5 s,退火:57 ℃ 30 s,延伸:72 ℃ 30 s,共計35 個循環;延伸:72 ℃ 10 min,4 ℃保存24 h。試劑配制選用SYBR?Premix Ex Taq? II試劑盒說明書的CFX96? Real-Time PCR Detection System步驟操作。以FASN、SREBP1-c、DGAT、PPARγ、HSL、LPL、FADS1、FADS2作實驗基因,18S RNA作管家基因,分別做3 個平行,兩個陰性對照,進行實時熒光定量反應。

表1 熒光定量PCR引物序列Table1 Primer sequences used for relative quantif i cation of gene expression by real time PCR
1.4 數據處理與分析
以37 種脂肪酸甲酯混合標準品保留時間為依據,對樣品中脂肪酸甲酯定性,依據樣品峰面積對樣品中的脂肪酸甲酯進行定量,以面積歸一法計算各脂肪酸的相對含量[21]。
本實驗采用相對表達量,計算方法選用2-ΔΔCt,其中ΔΔCt=(目的基因平均Ct值-內參基因平均Ct值)處理后-(目的基因平均Ct值-內參基因平均Ct值)處理前
使用Excel和SPSS 19.0軟件進行數據差異顯著性分析(單因素方差分析)和相關性分析(Pearson相關系數分析),方差分析實驗結果用平均值±標準差表示。
2 結果與分析
2.1 不同飼養方式對蘇尼特羊脂肪酸組成的影響
不同飼養方式對蘇尼特羊股二頭肌脂肪酸組成的影響如表2所示。兩種飼養模式下蘇尼特羊股二頭肌均檢測出16 種脂肪酸。飽和脂肪酸中棕櫚酸、硬脂酸相對含量最高,放牧組棕櫚酸和硬脂酸相對含量分別為19.011%和16.744%,舍飼組對應相對含量分別為24.373%和21.933%。不飽和脂肪酸中油酸相對含量最高,放牧組和舍飼組分別為45.577%和36.089%。放牧組飽和脂肪酸相對含量顯著低于舍飼組(P<0.05),棕櫚酸和硬脂酸相對含量均顯著低于舍飼組(P<0.05)。放牧組MUFA相對含量顯著高于舍飼組(P<0.05),棕櫚油酸相對含量顯著低于舍飼組(P<0.05),油酸相對含量顯著高于舍飼組(P<0.05)。放牧組PUFA相對含量高于舍飼組,但差異不顯著(P>0.05)。PUFA中α-亞麻酸、共軛亞油酸(conjugated linoleic acid,CLA)、EPA和DHA相對含量均顯著高于舍飼組(P<0.05)。放牧組的n-3PUFA相對含量顯著高于舍飼組(P<0.05),n-6/n-3水平顯著低于舍飼組(P<0.05)。
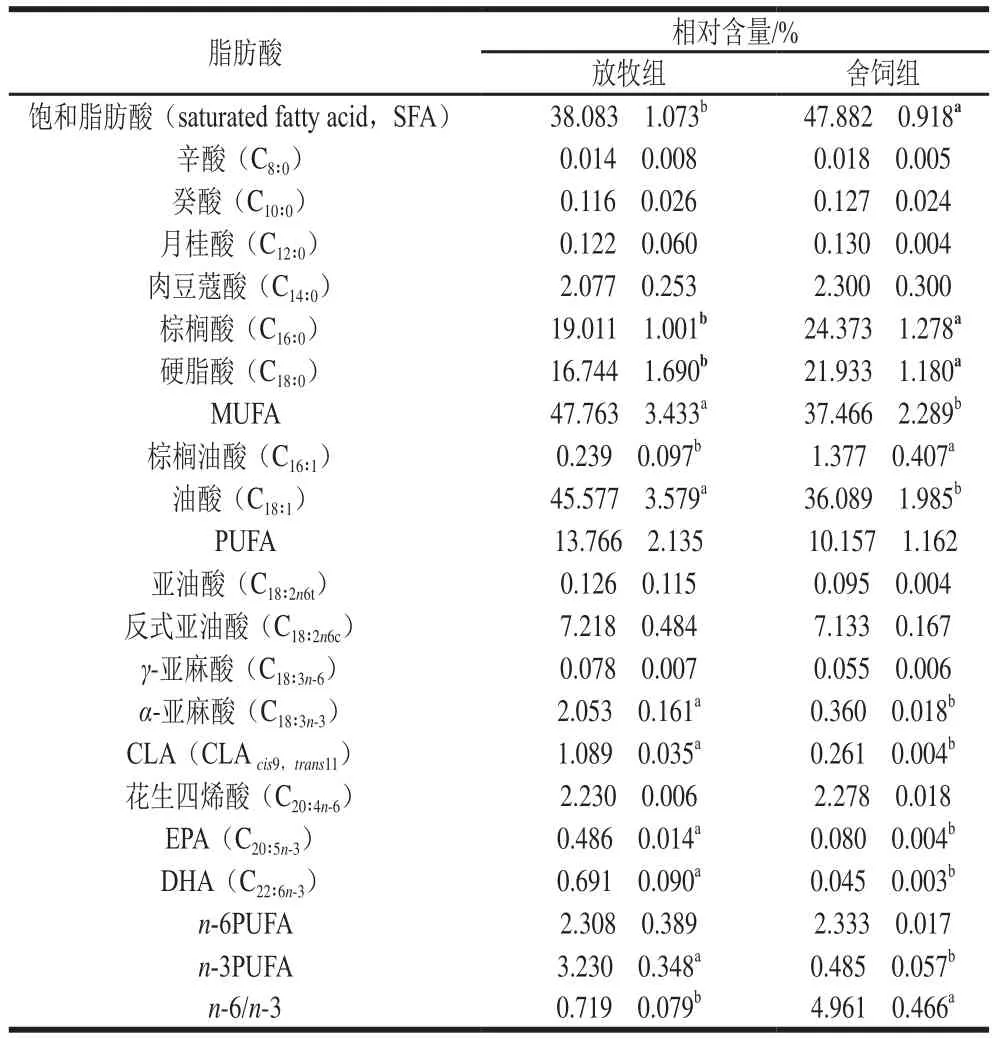
表2 不同飼養方式對蘇尼特羊脂肪酸組成的影響Table2 Effects of different feeding regimens on fatty acid composition in mutton
2.2 RNA提取結果
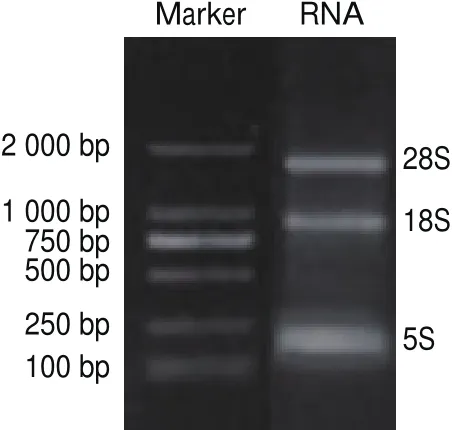
圖1 羊肌肉總RNA提取電泳圖Fig.1 Electrophoretic detection of total RNA extracted from sheep muscle
由圖1可知,從蘇尼特羊股二頭肌肌肉中提取的總RNA經質量分數1.5%瓊脂糖凝膠電泳檢測后,28S、18S處條帶清晰明亮,總RNA完整無降解。經TU-1810型紫外-可見分光光度計檢測OD值均在1.8~2.1之間,可知RNA純度高,可用于后續反轉錄實驗。
2.3 不同飼養方式蘇尼特羊脂肪代謝相關基因表達的差異
由圖2可知,放牧組SREBP1-c在股二頭肌的表達量顯著低于舍飼條件下(P<0.05)。放牧條件下HSL、DGAT和FADS2基因表達量顯著高于舍飼組(P<0.05)。FASN、LPL、PPARγ和FADS1的表達量在不同飼養方式下無顯著差異(P>0.05)。

圖2 不同飼養方式蘇尼特羊脂肪代謝相關基因表達的差異Fig.2 Differential expression of genes related to lipid metabolism under different feeding regimens
2.4 脂肪酸含量與脂肪代謝相關基因表達量的相關性分析

表3 脂肪酸含量與脂肪代謝相關基因表達量的相關性分析Table3 Correlation analysis between fatty acids and the expression of genes related to lipid metabolism
由表3可知,PPARγ基因表達量與SFA含量呈顯著負相關(P<0.05)。SREBP1-c的表達量與SFA含量呈正相關,HSL和LPL表達量與SFA含量呈負相關,這主要是因為SFA占脂肪酸組成的絕大部分,而SREBP1-c基因主要調節脂肪合成,HSL和LPL基因主要調控脂肪分解。
3 討 論
不飽和脂肪酸積累受多種因素共同作用,但目前眾多研究表明飼養方式是影響不飽和脂肪酸積累的主要因素,已有諸多研究表明放牧羊骨骼肌中不飽和脂肪酸積累顯著高于圈養羊[22-23],這與本研究結果一致。研究證明增加牧草攝入量可以刺激瘤胃頻繁蠕動,促進瘤胃微生物合成長鏈MUFA[24]。不飽和脂肪酸種類和含量與牧草種類和牧草成分有關,肌肉中不飽和脂肪酸比例與牧草中不飽和脂肪酸比例規律基本一致[25]。EPA和DHA是兩種功能性長鏈脂肪酸,具有抗氧化、抗衰老作用,對預防記憶力減退、阿爾茨海默病有一定療效。研究表明CLA(C18∶2cis-9trans-11)具有抗動脈粥樣硬化、抗腫瘤等重要的生理功能。放牧組中CLA的相對含量高于舍飼組,其原因可能是牧草中某些成分有利于肌內脂肪中CLA的沉積,日糧脂肪酸被吸收后大部分不經過代謝就直接沉積,因此羊肉脂肪酸組成與日糧脂肪酸組成密切相關[26]。
放牧組的n-3PUFA相對含量顯著高于舍飼組(P<0.05),n-6/n-3水平顯著低于舍飼組(P<0.05),這與Sa?udo等[27]的研究結果一致,其對不同飼料條件下的育肥羔羊脂肪酸特性進行比較時發現飼喂牧草可獲得較高水平n-3系列脂肪酸。營養專家認為合理的n-6/n-3有利于降低血壓、抑制不規律心臟跳動等其他慢性疾病的發生以及促進正常的生長發育[28],如何改善飼養模式下羊肉的n-6/n-3比例還需進一步的研究。
由于放牧組所食牧草不飽和脂肪酸含量較高,降低了SREBP1-c的表達量[29]。所以放牧組SREBP1-c在股二頭肌的表達量顯著低于舍飼條件下的。已有研究表明飼料中添加PUFA喂養大鼠可以降低其肝臟中SREBP1-c的表達量[30]。放牧條件下HSL、DGAT和FADS2表達量顯著高于舍飼組(P<0.05)。有研究表明DGAT過表達組細胞中棕櫚油酸、油酸和總MUFA相對含量顯著高于對照組,而硬脂酸和總飽和脂肪酸相對含量則極顯著低于對照組[8],與本實驗結果一致。脂肪酸脫氫酶是合成長鏈PUFA的關鍵酶,已有研究表明FADS2的表達與EPA的含量呈顯著正相關(P<0.05)[11]。還有研究表明FADS2的高表達可以增加n-3PUFA含量多于n-6系列,即FADS2的高表達可以降低n-6/n-3水平,使其更接近營養學家提出的n-6/n-3系列PUFA5∶1的黃金比例[12]。
P PA R γ基因表達量與S FA含量呈顯著負相關(P<0.05)。放牧羊和舍飼羊的飽和脂肪酸組成中棕櫚酸均占最大比例。研究表明棕櫚酸的積累可以抑制PPARγ的表達[31-33]。PPARγ是脂肪細胞基因表達和胰島素細胞間信號傳遞的主要調節者,脂肪酸的種類、濃度和作用時間等都是影響胰島素表達的重要因素,未來可以通過調整膳食中脂肪酸組成來增加胰島素的基因表達和分泌,發揮其有益作用。
放牧組蘇尼特羊肉中調控脂肪分解的基因表達量高于舍飼組,調控脂肪合成的基因表達量低于舍飼組。放牧組SFA含量低于舍飼組,但有益健康的CLA、DHA、EPA等含量高于舍飼組,放牧組羊肉從脂肪酸角度考慮的營養價值高于舍飼組。

