23G玻切術治療PDR術后早期出血的危險因素分析
王 翔,趙澤明,劉永帥
0引言
增生型糖尿病視網膜病變(proliferative diabetic retinopathy,PDR)是導致成年人眼盲的主要因素。臨床中對于PDR主要選擇全視網膜激光光凝進行治療,玻璃體切割術則應用于病情更加復雜多變的患者,如存在牽拉視網膜脫離等。23G玻璃體切割術治療后的患者術后早期很容易發生玻璃體出血,往往在術后數周或者數月后便會發生,文獻報道其發生率為12%~63%[1],屬常見并發癥[2]。一旦發生,便會影響患者的常規檢查及治療,導致可能存在的其它并發癥很難被發現,影響視力預后,因此臨床治療中需要對導致術后早期發生出血的危險因素進行分析,降低出血發生率[3-4]。基于此,本研究選擇我院100例PDR患者進行研究,旨在分析23G玻璃體切割術后早期出血的危險因素,便于更好地預防以及治療,報道如下。
1對象和方法
1.1對象回顧性分析2016-06/2018-01于我院行23G玻璃體切割術治療的PDR患者100例100眼的臨床資料,年齡40~55(平均55.3±10.5)歲,糖尿病病程6~24(平均15.1±7.4)a。根據術后早期(1mo內)是否發生玻璃體出血分為早期玻璃體出血組(27例27眼)和無玻璃體出血組(73例73眼)。早期玻璃體出血組中男16例,女11例,年齡40~55(平均48.5±8.5)歲,糖尿病病程6~23(平均13.8±7.1)a。無玻璃體出血組中男43例,女30例,年齡41~55(平均56.5±10.1)歲,糖尿病病程6~24(平均14.2±7.5)a。納入標準:(1)牽拉性視網膜脫離;(2)術前玻璃體積血存在嚴重不吸收者;(3)活動性視網膜纖維血管增生;(4)致密的視網膜前出血和黃斑前纖維膜。排除標準:(1)23G玻璃體切割術前6mo內具有內眼手術史;(2)合并葡萄膜炎、青光眼、視網膜靜脈阻塞等疾病。本研究通過我院醫學倫理委員會批準。所有患者術前均對手術知情同意并簽署知情同意書。
表1 兩組患者全身性臨床資料分析
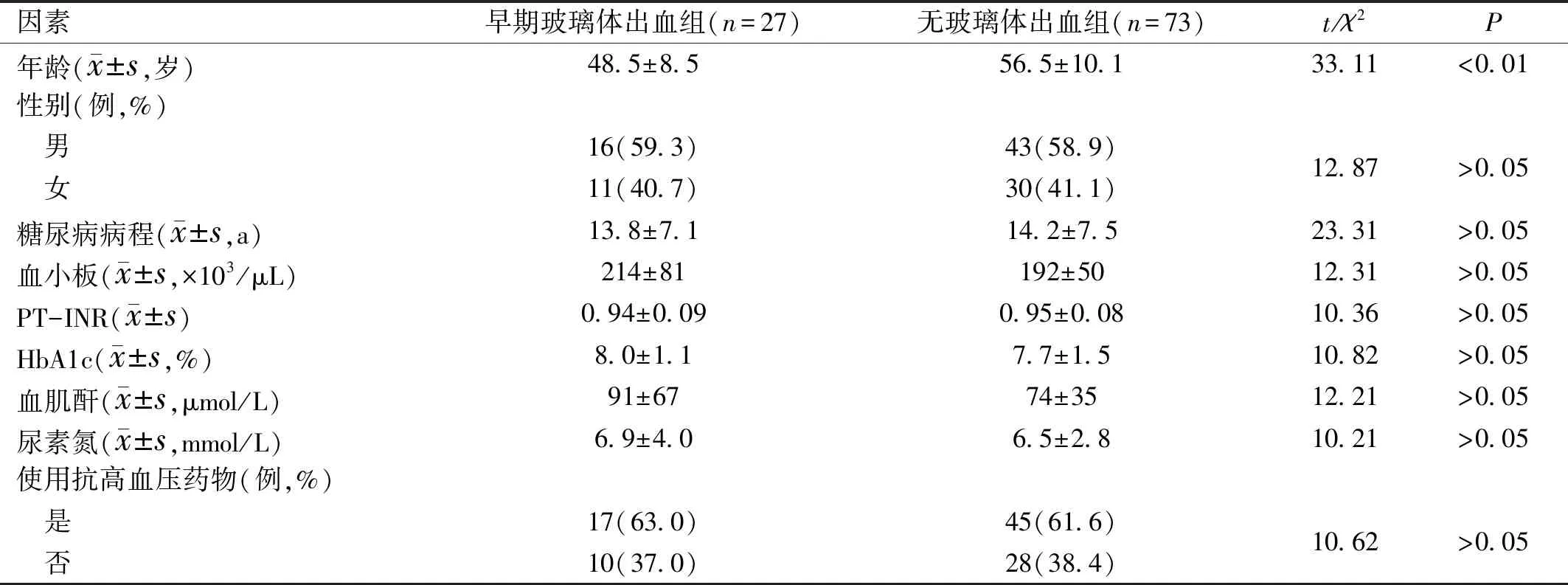
因素早期玻璃體出血組(n=27)無玻璃體出血組(n=73)t/χ2P年齡(x±s,歲)48.5±8.556.5±10.133.11<0.01性別(例,%) 男16(59.3)43(58.9)12.87>0.05 女11(40.7)30(41.1)糖尿病病程(x±s,a)13.8±7.114.2±7.523.31>0.05血小板(x±s,×103/μL)214±81192±5012.31>0.05PT-INR(x±s)0.94±0.090.95±0.0810.36>0.05HbA1c(x±s,%)8.0±1.17.7±1.510.82>0.05血肌酐(x±s,μmol/L)91±6774±3512.21>0.05尿素氮(x±s,mmol/L)6.9±4.06.5±2.810.21>0.05使用抗高血壓藥物(例,%) 是17(63.0)45(61.6)10.62>0.05 否10(37.0)28(38.4)
1.2方法
1.2.1手術方法所有患者均由同一位醫師行標準三通道23G經睫狀體扁平部玻璃體切割術,術中切除混濁的玻璃體,剝離纖維血管膜,解除牽拉視網膜,術中均行全視網膜激光光凝術(panretinal photocoagulation,PRP),術中根據每位患者的實際病情等綜合情況行玻璃體腔注氣術或者硅油填充術。兩組患者術后5d內均未發生眼部感染及相關并發癥。
1.2.2資料收集收集兩組患者的全身性和眼局部臨床資料。全身性臨床資料包括年齡、性別、糖尿病病程,入院時糖化血紅蛋白(HbA1c)、血肌酐、血小板、凝血功能(PT-INR,凝血酶原時間與測定試劑的國際敏感指數比值)、尿素氮等生化指標水平,抗高血壓藥物使用情況等。眼局部臨床資料:糖尿病視網膜病變(DR)分期,術前最佳矯正視力(BCVA)、是否有玻璃體積血、是否注射抗血管內皮生長因子(VEGF)藥物、是否存在纖維血管膜增殖,術中是否存在視盤新生血管出血、牽拉性視網膜脫離是否累及黃斑、是否注入氣體等。

2結果
2.1兩組患者全身性臨床資料分析早期玻璃體出血組和無玻璃體出血組患者年齡差異有統計學意義(P<0.01),性別構成比、糖尿病病程、血小板、PT-INR、HbA1c、血肌酐、尿素氮水平及使用抗高血壓藥物情況比較,差異均無統計學意義(P>0.05),見表1。
2.2兩組患者眼局部臨床資料分析早期玻璃體出血組和無玻璃體出血組患者術前抗VEGF治療、術前存在纖維血管膜增殖、術中視盤新生血管出血、術中注入氣體情況比較,差異均有統計學意義(P<0.01),見表2。
2.3 PDR術后早期出血的危險因素分析將年齡、術前抗VEGF治療、術前存在纖維血管膜增殖、術中視盤新生血管出血、術中注入氣體作為自變量,以術后早期是否發生玻璃體出血為因變量,經多元Logistic回歸分析顯示,術前存在纖維血管膜增殖、術中存在視盤新生血管出血是導致患者術后早期出血的獨立危險因素,見表3。
3討論
PDR患者常病情復雜多變,嚴重者甚至會永久性喪失視力。目前,臨床中已經將23G玻璃體切割術廣泛應用于PDR的治療中,但23G玻璃體切割術后早期可能發生玻璃體出血的情況。本研究顯示,早期玻璃體出血組與無早期玻璃體出血組患者的糖尿病病程、是否服用抗高血壓藥物及HbA1c水平無明顯差異,并不是導致出血發生的危險因素,而Soto-Pedre等[5]研究顯示,玻璃體切割術前3mo進行抗高血壓治療能夠降低術后早期發生出血的風險。近年來,大量關于玻璃體切割術前注射抗VEGF藥物是否能夠減少術后早期出血的發生率的研究仍存在較大爭議。Yang等[6]研究認為,PDR患者術前注射康柏西普,術后早期玻璃體出血發生率明顯較未注射的患者低。本研究中早期玻璃體出血組術前注射抗VEGF藥物患者的比例(29.6%)明顯高于無早期玻璃體出血組(9.6%),分析可能是由于眼底病變嚴重程度不同。Logistic回歸分析發現,術前是否注射抗VEGF藥物并不是術后早期發生玻璃體出血的獨立危險因素。本研究中,術后早期發生玻璃體出血患者的年齡明顯低于無早期玻璃體出血者,提示年輕患者術后早期更容易發生玻璃體出血,分析可能是由于年輕患者病情更具有進展性,活性纖維血管的增殖范圍更加廣闊,手術操作過程中人工玻璃體脫離存在難度,纖維血管膜增殖牽拉力更強,因此很容易導致術后發生玻璃體出血[7-10]。本研究發現,年齡并不是導致術后早期發生玻璃體出血的危險因素。有研究報告長效氣體C3F8對預防術后早期出血有效,可能是氣泡長期機械填塞或壓迫易破裂的視網膜血管,使凝血因子聚集在出血部位,血管完整性得以重建[10]。但我們發現長效氣體填充并沒有降低術后早期出血的風險,考慮與本文納入病例較少有關,后期將收集更多病例進行深入分析。
表2 兩組患者眼局部臨床資料分析
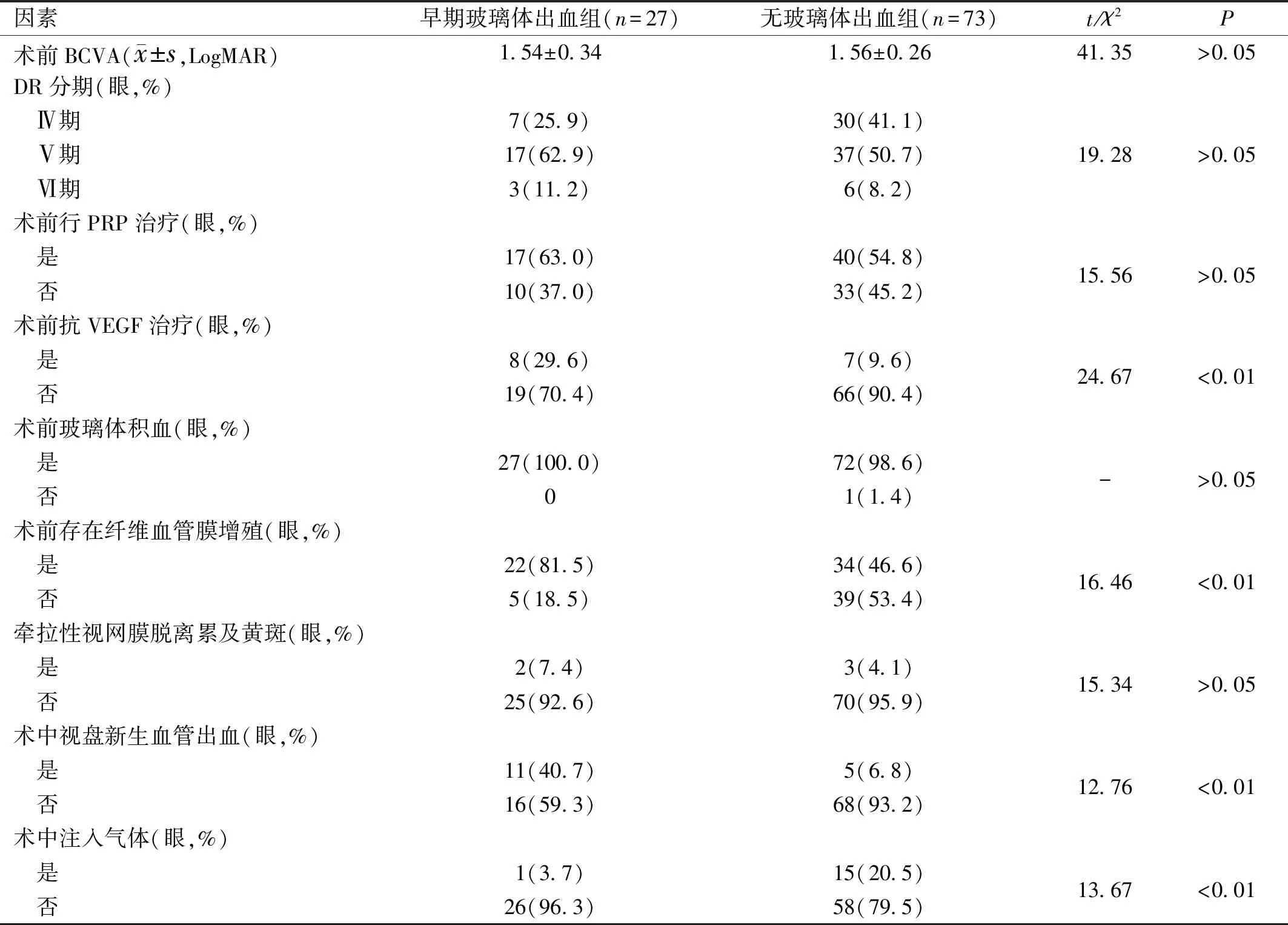
因素早期玻璃體出血組(n=27)無玻璃體出血組(n=73)t/χ2P術前BCVA(x±s,LogMAR)1.54±0.341.56±0.2641.35>0.05DR分期(眼,%) Ⅳ期7(25.9)30(41.1) Ⅴ期17(62.9)37(50.7)19.28>0.05 Ⅵ期3(11.2)6(8.2)術前行PRP治療(眼,%) 是17(63.0)40(54.8) 否10(37.0)33(45.2)15.56>0.05術前抗VEGF治療(眼,%) 是8(29.6)7(9.6)24.67<0.01 否19(70.4)66(90.4)術前玻璃體積血(眼,%) 是27(100.0)72(98.6)->0.05 否01(1.4)術前存在纖維血管膜增殖(眼,%) 是22(81.5)34(46.6)16.46<0.01 否5(18.5)39(53.4)牽拉性視網膜脫離累及黃斑(眼,%) 是2(7.4)3(4.1)15.34>0.05 否25(92.6)70(95.9)術中視盤新生血管出血(眼,%) 是11(40.7)5(6.8)12.76<0.01 否16(59.3)68(93.2)術中注入氣體(眼,%) 是1(3.7)15(20.5)13.67<0.01 否26(96.3)58(79.5)
注:-表示采用Fisher確切概率法。
表3 增生型糖尿病視網膜病變患者術后早期出血的危險因素分析

因素βSEWald χ2POR(95%CI)術前存在纖維血管膜增殖0.3660.00449.1540.0042.281(1.180~19.768)術中存在視盤新生血管出血0.5940.13015.4840.0111.545(1.488~16.196)
此外,我們發現,術前存在纖維血管膜增殖以及術中存在視盤新生血管出血是導致術后早期玻璃體出血的獨立危險因素。G?ncü等[11]研究發現,術后早期玻璃體出血與手術過程中纖維血管膜切開存在關系,出血通常發生于術后1wk左右,而且很可能發生于首次出血的部位,主要是由于周邊可能存在殘留的玻璃體,手術過程中對視網膜組織造成一定的損傷以及炎癥反應增加血管的滲透性導致。也可能是視網膜新切開的血管部位或者視盤部位再次發生出血,可以通過增加灌注壓力,使用玻切頭直接對出血的部位進行壓迫,有效控制出血[12-13]。但可能會損傷視網膜神經纖維層,導致眼內光凝無法直接光凝視盤新生血管,且在縫合鞏膜滲透部位時眼壓波動,以及在手術完成之后也可能會由于身體運動的影響導致視盤和視網膜新生血管再次發生出血,從而引發早期出血[14-15]。23G玻璃體切割術無需進行鞏膜切口縫合,但是仍然會由于眼壓波動的影響而再次發生出血[16-17]。
綜上所述,行23G玻璃體切割術治療的PDR患者術后早期發生玻璃體出血的危險因素為術前存在纖維血管膜增殖以及術中發生視盤新生血管出血,且更容易發生于眼底病變嚴重的患者。在臨床中需要針對每位患者可能存在的危險因素進行預防以及治療,提高術后視覺質量。

