B細胞轉錄激活因子在非酒精性脂肪性肝炎中的表達及意義
唐穎悅 李靜 雷曉紅 李春敏 曾民德 茅益民
非酒精性脂肪性肝炎(NASH)作為非酒精性脂肪性肝病(NAFLD)中更具肝臟病變進展風險的臨床表型,已成為美國肝移植的第二大適應證[1]。其發病機制復雜,迄今尚無藥物獲批用于NASH的治療。有研究認為,轉錄因子激活蛋白1(AP-1)在NASH進展中具有重要作用[2],可通過調節Toll樣受體和PPARγ等信號通路影響NAFLD進展[3]。作為AP-1家族成員之一,B細胞轉錄激活因子(BATF)被認為是AP-1的抑制劑,主要表達于造血干細胞和免疫細胞如T淋巴細胞、B淋巴細胞、NKT細胞及巨噬細胞[4-5]。已有研究提示,BATF及其誘導的Th17細胞反應可能在慢性乙型肝炎的發展中發揮著重要作用[6]。也有研究提示,BATF的表達異常與腫瘤發生、發展密切相關[7-8]。然而,目前鮮有研究探討BATF對NASH的影響,本研究旨在通過NASH小鼠模型,初步探討BATF在NASH進展中的潛在作用。
材料與方法
一、實驗動物、試劑及儀器
雄性C57BL/6小鼠,6~8周齡,購于上海斯萊克動物實驗中心。所有實驗小鼠均飼養于上海睿太莫斯生物科技有限公司實驗動物中心,SPF級獨立通風籠,自由飲食。MCD飼料(A02082002B)購于美國Research Diets公司;TRIzol試劑購自美國Invitrogen公司;反轉錄試劑盒、PCR試劑盒購自日本Takara公司;PCR引物由上海生工合成,采用HAP方法純化,引物序列見表1。兔抗小鼠BATF抗體購自美國CST公司;兔二步法免疫組化檢測試劑盒、DAB染色液購自北京中杉金橋;Percoll購于德國GE Healthcare公司;流式細胞抗體、FoxP3固定和透化試劑盒均購自美國Biolegend和eBioscience公司。
二、動物分組及模型建立
雄性C57BL/6小鼠14只,隨機分成2組,每組各7只。在適應性喂養1周后開始誘導小鼠NASH模型,實驗組小鼠進食MCD 8周;對照組小鼠進食正常飼料,實驗期間自由飲水,飼養溫度控制在(24±2)℃,濕度為(50±5)%,每天換水和墊料,每周稱量體重及進食量。到第8周末,對實驗組和對照組小鼠進行安樂死處理并收集相應樣本。使用全自動生化檢測儀檢測小鼠血清ALT、AST。
三、小鼠肝組織RNA分離及RT-qPCR檢測
取適量肝臟組織,加入1 mL TRIzol裂解液后進行研磨裂解,加入200 μL氯仿后室溫靜置15 min,4 ℃,12 000 rpm離心15 min,取無色水相層加入異丙醇后室溫靜置30 min,4 ℃,12 000 rpm離心15 min,棄上清加入75%乙醇洗滌沉淀,DEPC水充分溶解沉淀并檢測mRNA濃度和純度。按反轉錄試劑盒說明將mRNA反轉錄為cDNA,并使用SYBR Green體系進行qPCR檢測,設3個復孔,以2-δδCT法計算基因相對表達量。
四、小鼠肝組織石蠟切片免疫組化
肝組織4%多聚甲醛固定24 h,常規梯度酒精脫水,二甲苯透明,石蠟包埋。包埋標本均切成4 μm薄片,65 ℃烘烤1 h,常規脫蠟、水化后,經微波抗原修復,常規氧化水化,山羊血清封閉,一抗BATF(1∶500,美國CST)4 ℃封閉過夜。棄一抗,加入HRP標記的二抗,室溫孵育30 min,加入 PBS 洗滌3次,DAB顯色,蘇木素復染。
五、流式細胞分析
小鼠肝臟沖洗干凈,取出并研磨,將細胞離心、沖洗,用Percoll分離液分離,棄上清后加紅細胞裂解液離心,用RPMI1640細胞培養液重懸調整計數細胞為106/mL,制成肝臟單細胞懸液備用。取肝臟單細胞懸液100 μL, 分別加入Brilliant Violet 421TManti-mouse F4/80(BM8)、APC anti-mouse CD206 (MMR)(C068C2)、Brilliant Violet 605TManti-mouse CD11c(N418)、Zombie NIRTMFixable Viability Kit各1.5 μL 輕柔混合,4 ℃孵育30 min后加入 PBS 洗滌2次,固定透化,先后加入PE F(ab')2 Donkey anti-Rabbit IgG、BATF 4 ℃孵育30 min后加入 PBS 洗滌2次上機檢測,用FlowJo軟件進行后期數據分析。
六、統計學方法
采用SPSS 16.0軟件進行統計學分析,采用GraphPadPrism 7.0進行繪圖,計量資料采用均數±標準差表示。兩組間比較采用t檢驗,相關性分析采用Spearman Correlation方法。P<0.05為差異有統計學意義。
結 果
一、NASH模型肝組織BATF、TNF-α、IL-1β mRNA表達變化
成功構建對照組和MCD組動物模型后,對各組肝臟樣本進行RT-qPCR檢測,結果表明,與對照組相比,MCD組小鼠肝組織中BATF表達明顯增加,同時,TNF-α和IL-1β表達水平明顯上調。提示在MCD飲食誘導的NASH模型中,肝臟BATF和促炎因子表達水平均明顯增加兩組比較,差異均有統計學意義(均P<0.05)。見表2。

表1 PCR引物序列
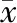
表2 對照組和MCD組肝組織BATF、TNF-α、IL-1β mRNA表達水平(±s)
二、免疫組化檢測NASH模型小鼠肝組織BATF的表達
進一步確定BATF的表達水平和位置,如圖1A所示,對照組小鼠肝臟未見BATF陽性的細胞。然而,MCD組小鼠肝組織中可見BATF陽性細胞大量聚集在組織間質,表達在細胞核中(見圖1B),提示BATF在NASH肝組織中表達增強,且主要表達于間質的炎性細胞胞核中。

圖1對照組和MCD組BATF蛋白表達(免疫組化DAB染色 200) A:對照組; B:MCD組
三、NASH模型肝巨噬細胞中BATF表達情況
應用流式細胞術檢測BATF在肝臟巨噬細胞中表達水平。結果顯示,MCD組F4/80+巨噬細胞的比例明顯高于對照組。MCD組的F4/80+BATF+細胞比例(52.24±13.43)%顯著高于對照組(16.39±6.49)%(P<0.01)。
分析巨噬細胞亞群發現,MCD組M1型巨噬細胞明顯高于對照組(P<0.01),其中MCD組F4/80+CD11c+BATF+細胞比例(67.36±7.27)%明顯高于對照組(12.03±6.02)%(P<0.01)。而M2型巨噬細胞比例在兩組中無明顯差異。MCD組的F4/80+CD206+BATF+細胞比例(20.61±8.43)%明顯高于對照組(5.09±6.04)%(P<0.01)。以上結果表明,MCD組肝巨噬細胞大量浸潤,且以促炎作用的M1型巨噬細胞為主。同時,MCD組中BATF陽性的巨噬細胞比例明顯增多,以F4/80+CD11c+BATF+為主,提示BATF陽性的肝巨噬細胞參與NASH的發生、進展。
四、 BATF與臨床指標的相關性分析
對兩組肝組織BATF mRNA水平和生化指標ALT、AST以及肝臟組織學NAS評分進行Spearman Correlation分析。結果顯示,BATF與ALT、AST存在顯著正相關,相關系數R分別為0.745和0.793(P<0.01);BATF與NAS積分、肝臟脂肪變、小葉炎癥、氣球樣變評分均存在明顯正相關(R分別為0.912、0.877、0.912和0.877,P<0.01)。
討 論
本研究發現,NASH小鼠模型肝臟BATF表達明顯增高,并集中于肝臟的組織間質。肝臟BATF陽性的巨噬細胞比例明顯升高,以F4/80+CD11c+BATF+為主,進一步的相關性分析結果顯示,BATF水平與肝臟組織學評分以及肝臟生化的臨床指標存在顯著相關性。
免疫調控的失調以及炎癥浸潤在NASH進展中發揮著重要作用[9]。在炎癥早期,庫普弗細胞活化,驅動其他免疫細胞,參與肝損傷的發生、發展。庫普弗細胞極化為兩種不同亞型:促炎作用的M1型和抑炎作用的M2型。M1型分泌促炎因子如TNF-α、IL-1β等,同時通過增加二酰基甘油轉移酶的活性增加肝臟的脂肪變性,促進NAFLD進展。IL-1β可通過自分泌或旁分泌方式促使庫普弗細胞和肝星狀細胞持續性活化,加重體內炎癥、纖維化形成。TNF-α可促進Il-1β和IL-6的釋放。本研究發現,MCD模型肝內巨噬細胞以及M1型巨噬細胞比例明顯上升,TNF-α和IL-1β表達明顯增加,與Zhang等[10]研究一致。表明肝內以M1型極化為主的巨噬細胞比例增加,并且該類細胞大量分泌促炎因子,可繼續招募炎癥細胞入肝,進一步加重炎癥反應。
已有研究認為,AP-1家族是NAFLD疾病發展的重要靶點。成員Jun和Fos蛋白調節Toll樣受體可介導炎癥反應[11]。Dorn等[2]發現,NAFLD患者因肝臟脂肪變性誘導c-Jun表達水平明顯增加,加重了NAFLD的肝臟炎癥。既往報道發現,BATF水平增高與乙型肝炎患者肝損傷程度相關[6],可能與其參與調節細胞代謝以及免疫應答反應有關。本研究發現,MCD組小鼠的肝臟BATF表達明顯高于NC組,主要表達于肝臟間質區的免疫細胞,而且,NASH組巨噬細胞表達主要以促炎的M1型巨噬細胞為主。因此,推測BATF表達增高可能與NASH肝臟內炎癥細胞浸潤增多有關,進而共同參與NASH進展。與臨床組織學和生化指標的關聯分析顯示,BATF與肝臟組織學特征以及肝損傷的生化指標存在顯著正相關,這提示BATF可能是肝損傷的敏感生物標記,在預測NASH進展中可能具有潛在價值。