啤酒活性干酵母凝血質提取研究
田小海 王莘

摘要 [目的]研究并優化啤酒活性干酵母凝血質的提取工藝。[方法]生長曲線法確定其培養時間,采用L9(34)正交試驗設計,應用低溫和葡聚糖凝膠(SephadexG-75)對凝血質進行純化。[結果]啤酒活性干酵母最佳培養時間為9 d,凝血質提取優化工藝參數為乙醇濃度85%、提取溫度35? ℃、第1次丙酮體積(丙酮∶粗提液)為0.7、恒溫磁力攪拌器轉數為600 r/min,凝血質提取量可以達到1 000 mL活化液0.660 g,純化率為13%。[結論]從啤酒活性干酵母可提取凝血質,方法簡單易實現,降低凝血質動物來源的生成成本,具有極大的應用價值。
關鍵詞啤酒活性干酵母;凝血質;提取;純化
中圖分類號TS262.5+4文獻標識碼A
文章編號0517-6611(2019)03-0147-03
doi:10.3969/j.issn.0517-6611.2019.03.047
凝血系統是人體發揮內源性或外源性凝血途徑的物質基礎,凝血物質一般可分為經典凝血和激肽2個系統[1]。凝血質屬于經典凝血系統中的凝血因子Ⅲ,當凝血因子Ⅲ與其受體Ⅶa結合后,可通過啟動外源性凝血途徑而發揮凝血作用[2]。
凝血質來源較為廣泛,主要有中藥、動物和微生物等。前人的研究主要集中在2種來源的凝血質的提取,一種是從中藥中進行凝血質分離和提取,另一種是從試驗動物的血液中進行提取和純化。中藥來源的凝血質分離提取過程復雜、純化困難,獲取量少限制了其應用;動物源性的凝血質為優質凝血質,但難于從動物體內大量獲得,試驗動物獲取凝血質生產成本較高,也限制了其應用;微生物來源的凝血質主要存在于半知菌綱的真菌中,啤酒活性干酵母中凝血質含量豐富,容易擴大培養,分離提取及純化工藝相對容易,是獲得凝血質的理想來源,但微生物來源的凝血質的提取研究較少。筆者主要通過對啤酒活性干酵母的生長曲線的測定確定凝血質提取的時間,通過醇浸提,脫水后乙醚提取,再通過丙酮沉淀的方法進行研究,達到優化提取方案的目的。
1材料與方法
1.1材料
1.1.1菌種。湖北安琪酵母公司提供安琪啤酒活性干酵母。
1.1.2試劑。葡萄糖、蛋白胨、酵母膏、磷酸二氫鉀、七水硫酸鎂、鐵粉、瓊脂、蒸餾水、不同濃度的乙醇、無水硫酸鈉、乙醚、丙酮、考馬斯亮藍G-250、甲叉雙丙烯酰胺、丙烯酰胺、三羥甲基氨基甲烷、二巰基乙醇、四甲基乙二胺、過硫酸銨、鹽酸、甘氨酸、磷酸鹽緩沖溶液等。
1.1.3儀器。高壓蒸汽滅菌箱、光照培養箱、無菌操作臺、恒溫水浴箱、多循環水式真空泵、恒溫磁力攪拌器、搖床、離心機、分析天平、搖床、pH計、旋轉蒸發儀、冷凍干燥機、分光光度計(可見光和紫外光)、冰箱、超聲波振蕩器、電泳儀、Sephadex G-75。
1.1.4培養基。
活化培養基[3]:葡萄糖2.5 g、蒸餾水100 mL,121.3 ℃,103.4 kPa,滅菌20 min。
斜面培養基:葡萄糖40 g、蛋白胨和瓊脂各10 g、酵母膏5 g,加水至500 mL,121.3 ℃,103.4 kPa,滅菌20 min。
液體發酵培養基[4-5]:葡萄糖40 g、蛋白胨10 g、酵母膏5 g、KH2PO4 5 g、MgSO4·7H2O 2 g、微量Fe粉,加水至500 mL,121.3 ℃,103.4 kPa,滅菌20 min。
1.2方法
1.2.1啤酒活性干酵母活化和擴大培養[4-6]。
1.2.1.1菌種活化。2.5 g葡萄糖置于250 mL三角瓶中,加水100 mL,溶解后于電爐加熱煮沸,冷卻至35 ℃,即得活化液,121.3 ℃,103.4 kPa,滅菌20 min。啤酒活性干酵母0.2 g,35 ℃條件下加入活化液中,自然冷卻至30 ℃后,置于30 ℃水浴中活化2 h。
1.2.1.2斜面保存。取活化后菌種,在無菌操作臺進行斜面接種,培養7 d,冷藏保存備用。
1.2.1.3擴大培養。取適量冷凍保存的菌種,接入40 mL(250 mL三角燒瓶)液體發酵培養基中,于28~30 ℃搖床振蕩(150 r/min)培養24 h,可用于凝血質的提取分離。
1.2.2啤酒活性干酵母生長曲線的測定[7]。
250 mL活化液分別對生長1~12 d的啤酒活性干酵母進行測定,從培養24 h后開始,每間隔24 h收集一次菌體,由于離心效果差,采用靜置沉降的方法收集菌體[8],測定前采用200目篩網對發酵液進行過濾,50 ℃以下對過濾得到的菌體進行烘干處理后進行稱重,根據稱重結果以發酵天數為橫坐標、干菌體量為縱坐標繪制曲線,即為生長曲線。
1.2.3啤酒活性干酵母凝血質的提取方法[9]。
啤酒活性干酵母干菌體在一定溫度下,通過一定濃度的乙醇浸提,獲得提取液;提取液在一定溫度下經過濃縮,獲得膏狀物;膏狀物經無水硫酸鈉脫水后,再經過乙醚提取,獲得乙醚提取液;乙醚提取液進行濃縮,獲得濃縮物;濃縮物經丙酮沉淀后,獲得凝血質粗品。250 mL活化液對乙醇濃度、提取溫度、轉速、丙酮濃度影響因素采用正交試驗L9(34) 確立最佳提取條件。
1.2.4啤酒活性干酵母凝血質的純化方法[10]。
除去脂類物質,如麥角固醇、卵磷脂等可以采用乙醚揮發和低溫沉淀除去。
準確稱取SephadexG-75 2.0 g置于燒杯中,加入250 mL雙蒸水溶脹48 h;取直徑為2 cm、高60 cm層析柱,關閉出口后加入5 mL磷酸鹽緩沖溶液,緩慢加入溶脹好的凝膠顆粒,同時打開出口使其緩慢沉積。緩慢注入磷酸鹽緩沖溶液,達到柱平衡后將溶解在磷酸鹽中的凝血質粗品溶液緩慢加入凝膠柱,不斷用磷酸鹽緩沖溶液洗脫,同時收集洗脫液進行干燥處理,即可得到純化的凝血質。
2結果與分析
2.1啤酒活性干酵母活化及擴大培養結果
啤酒活性干酵母經活化后保存的菌種接種于活化液12~16 h即可獲得較多菌體,為了便于試驗過程的進行,一般培養24 h后開始使用菌體。
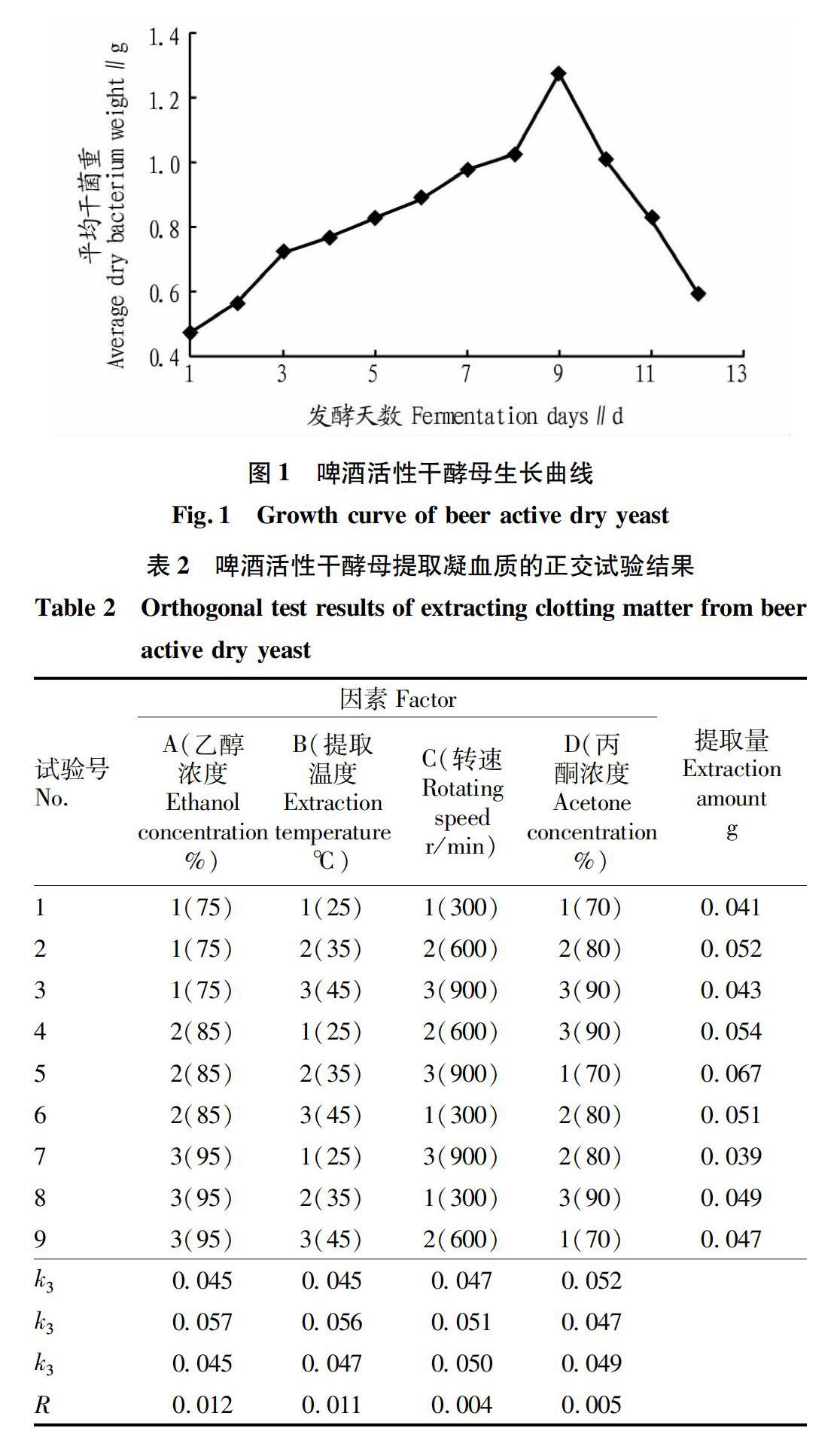
2.2啤酒活性干酵母的生長曲線
對培養1~12 d的啤酒活性干酵母設定3個重復,分別烘干菌體后取平均值,根據具體的干菌體量制作其生長曲線見圖1。
凝血質是啤酒活性干酵母生長繁殖過程中的初級代謝產物。因此,隨著菌體生成量的增多,凝血質的產量也隨之增加,其凝血質提取的最佳時期為8~10 d[11],試驗中確定第9天啤酒活性干酵母菌量最多,250 mL活化液最多可獲得1.27 g干菌量。
2.3啤酒活性干酵母凝血質的提取
通過正交試驗結果(表2)分析,各項影響因素的最佳水平組合為A2B2C2D1,即乙醇濃度為85%、提取溫度35 ℃、攪拌器轉數600 r/min、丙酮濃度為70%。4種影響因素的重要性排序為A>B>D>C,即乙醇濃度最重要,其次為提取溫度,再次為丙酮濃度,最后為攪拌器轉數。
優化工藝后采用85%乙醇、35 ℃、600 r/min、丙酮濃度為70%的條件下再次提取粗品凝血質的量為0.165 g。1 000 mL活化液提取凝血質粗品量達0.660 g。
2.4啤酒活性干酵母凝血質的純化
2.4.1啤酒活性干酵母凝血質除脂類物質。
將凝血質粗品置于-14 ℃冰箱中過夜,即可除去凝血質粗品中含有的少量麥角固醇和卵磷脂,使用冷凍干燥機可迅速干燥。
2.4.2啤酒活性干酵母凝血質經葡聚糖凝膠純化。
將0.660 g粗品凝血質經SephadexG-75可純化為凝血質成品,可獲得純化的凝血質0.085 8 g,使得啤酒活性干酵母純凝血質的純化率達13%。
3討論與結論
3.1啤酒活性干酵母的培養
對啤酒活性干酵母的培養也嘗試利用酒糟中的成分以及糖廠的廢糖蜜等作為培養基進行培養。可以通過正交試驗確定蛋白飼料水、DDGS水、廢糖及酵母泥的最佳配比[12],在培養原料上節省資源,便于擴大培養和投入實際生產。但由于培養的效果沒有達到預期,因此,該試驗中仍然采用了經典的酵母菌培養的培養基,培養條件簡單,酵母菌對培養基中的營養成分要求不高,僅在大量培養時消耗大量的葡萄糖、蛋白胨、酵母膏等成分。
3.2啤酒活性干酵母生長曲線的測定
由于凝血質為啤酒活性干酵母生長繁殖過程中產生的初級代謝產物,因此,菌體的量越多,所含有的凝血質越多,測定其生長曲線非常必要。對啤酒活性干酵母生長曲線的測定可以采用干法或濕法2種測定方法。由于濕法測定中對于發酵液過濾的效果不能完全一致,因而導致測定結果不夠準確。但采用干法測定時,一定保證在烘干處理過程中溫度不能太高,否則會破壞蛋白質的生物活性,導致其出現熱變性,因此溫度要嚴格控制在50 ℃以下。
3.3凝血質提取過程中各種試驗因素的影響
培養后獲得的啤酒活性干酵母細胞壁的破壞可以采用多種方法處理,可以采用破壁效果較好的破壁機處理,效果較好;采用超聲波破碎會使得細胞壁破壞不均勻,嚴重的會破壞細胞內蛋白成分,輕微的又不能起到破壁作用,效果不好;研缽研磨僅適合實驗室的小規模試驗,不適合擴大生產。因此,該試驗采用破壁機處理。
乙醇濃度過低(75%)浸提效果不好,濃度過高,會產生大量的難于與蛋白質分離的物質,且會造成乙醇的浪費。提取的溫度過低,不利于凝血質的釋放,溫度過高,容易造成凝血質的部分活性的破壞或喪失。一次丙酮濃度過高會造成浪費,但如果濃度過低則會導致其中殘留的乙醚無法徹底除去。磁力攪拌器轉子的轉數高低的影響較小,但如果轉數過高容易造成溫度升高,要采用恒溫磁力攪拌器處理。因此,凝血質提取過程中各種試驗影響因素的具體參數為:乙醇濃度85%;提取溫度35 ℃;一次丙酮濃度70%;轉數為600 r/min。
3.4凝血質提取及純化比較
啤酒活性干酵母發酵9 d干菌體量達1.270 g/250 mL活化液,凝血質的提取量為0.165 g/250 mL活化液,提取率達12.992%,與文獻[13]中的提取率提高5百分點;純化后凝血質量為0.215 g/250 mL,純化率達13%,與文獻[13]中的純化率提高4百分點。因此,試驗達到了提取優化和純化改進的效果。
參考文獻
[1] 韓邦志,謝金鮮.中藥止血與凝血機制的研究進展[J].廣西中醫藥,2009,32(2):6-8.
[2] DUSSE L M SA,DAS GRACAS CARVALHO M,COOPER A J,et al.Tissue factor and tissue factor Pathway inhibitor:A potential role in pregnancy and obstetric vascular complications?[J].Clin Chim Acta,2006,372(1/2):43-46.
[3] 姚娟,肖冬光,王亞楠.“安琪”啤酒活性干酵母釀造特性研究[J].釀造科技,2003(6):40-41.
[4] 王歲樓,張平之,張欣,等.酵母SOD形成的生理學研究[J].工業微生物,1997,27(3):20-23.
[5] 吳江,陳代杰.微生物中超氧化物歧化酶含量及分布[J].中國醫藥工業雜志,1997,28(11):495-498.
[6] 王歲樓,張鑫,張平之,等.活性干酵母SOD搖瓶發酵條件的研究[J].工業微生物,2000,30(3):36-39.
[7] 錢銘鐮.發酵工程最優化控制[M].南京:江蘇科學技術出版社,1998:150-153.
[8] ZIVELIN A,BAUDUER F,DUCOUT L,et al.Factor XI deficiency in French Basques is caused predominantly by an ancestral Cys38Arg mutation in the factor XI gene[J].Blood,2002,99(7):2448-2454.
[9]? WANG W,JOHN WANG Y,KELNNER D N.Coagulation factor VIII:Structure and stability[J].International journal of pharmaceutics,2003,259:1-15.
[10] TOMAZ C T,QUEIROZ J A.Fractionation of Trichoderma reesei cellulases by hydrophobic interaction chromatography on phenyl-sepharose[J].Biotechnology letters,2004,26(3):223-227.
[11] SOLHEIM B G,FLESLAND O,BROSSTAD F,et al.Improved preservation of coagulation factors after pre-storage leukocyte depletion of whole blood[J].Transfusion and apheresis science,2003,29(2):133-139.
[12] 田小海,崔洪艷,王莘.酒糟為基質提取凝血質的白地霉培養條件的優化[J].安徽農業科學,2016,44(13):12-13,16.
[13] 劉詩音.酵母菌類發酵提取凝血質及凝血作用的研究[D].長春:吉林農業大學,2011.

