辛伐他汀抑制過表達HER2型結直腸癌的腫瘤血管生成
李 剛,鄭君華,徐 斌,凌 杰,邱 偉,王永兵
0 引言
結直腸癌(CRC)是世界范圍內最常見的惡性腫瘤之一[1],早期診斷發現,大約有25%的CRC患者出現轉移,另有50%的患者會發展為轉移[2]。雖然新的細胞毒性和分子靶向試劑可以改善CRC患者的整體存活率,但是復發和失敗的速率仍然很高。
血管生成不僅為腫瘤的生長提供氧氣和營養物質,以促進癌細胞的增殖,其對于轉移、腫瘤細胞向附近組織或遠處器官的遷移也是必需的[3]。抗血管生成的治療策略已經成為重要的抗腫瘤(尤其是轉移性腫瘤)治療方法之一。血管內皮生長因子(VEGF)在大多數癌細胞中過度表達,已成為抗血管生成治療的主要靶點[4]。人表皮生長因子受體-2(HER2)是表皮生長因子受體家族的一員,與VEGF誘導的實體腫瘤血管形成呈正相關[5]。血管生成生長因子HER2-VEGF在許多不同類型的惡性腫瘤中過表達,促進了多種類型細胞的腫瘤血管生成[6-7]。
他汀類藥物是3-羥基-3-甲基戊二醛輔酶A(HMG-CoA)還原酶抑制劑,通過阻止HMG-CoA轉化為甲戊二酸酯來降低膽固醇合成。他汀類藥物主要用于治療高脂血癥,以減少心血管疾病,但近年研究表明,他汀類藥物對包括癌癥在內的多種疾病都有治療作用,通過參與血管生成、增殖、凋亡和轉移相關途徑發揮抗癌作用。有報道,辛伐他汀通過抑制NF-κB調控胃癌血管生成和轉移,強化卡培他濱對胃癌的治療效果[8];通過阻止HIF-1誘導的血管生成因子抑制乳腺癌的血管生成[9]。然而,辛伐他汀是否會影響CRC的血管生成未見相關研究。本研究旨在探討辛伐他汀對CRC細胞血管生成的影響,并初步探討其分子機制。
1 材料與方法
1.1 主要材料 CRC細胞株(HCT116、HT-29、LoVo、SW480、Caco-2)以及人類臍帶內皮細胞(HUVECs)均購于上海中科院細胞庫。HCT-116和HT-29細胞培養于RPMI-1640培養基中;SW480、LoVo和Caco-2細胞在DMEM培養基中培養;HUVECs在內皮細胞生長培養基2中培養。所有細胞株都在37 ℃、5% CO2的恒溫箱中培養。
1.2 裸鼠移植瘤模型 本實驗方案經上海健康醫學院附屬上海市浦東新區人民醫院批準。將2.0×106HCT-116和LoVo細胞通過皮下注入BALB/c小鼠左后側。9 d后,將小鼠隨機分為2組(每組8只),治療組小鼠注射辛伐他汀50 mg/(kg·d),對照組每日注射0.1 ml磷酸鹽緩沖鹽水。每4 d用卡尺監測腫瘤體積,根據下列公式計算:體積=長度×寬度2×0.5。4周后處死小鼠,對腫瘤組織進行免疫組化分析。
1.3 收集腫瘤細胞培養基(TCM) 1.0×106個HCT-116或LoVo細胞接種于6孔板中,采用0.2 μg辛伐他汀或HRG-β1(50 ng/ml)或辛伐他汀+HRG-β1共同預處理72 h。孵育后,腫瘤細胞培養基在2 000 r/min下離心10 min,去除細胞碎片,-80 ℃儲存用于實驗分析。
1.4 Matrigel小管形成實驗 Matrigel基質膠在96孔板上涂覆30 min。將含12 000個HUVECs的無血清培養基或75% TCM加入到各個小室中孵育12 h。采用垂直顯微鏡記錄小管圖像,使用ImageJ 2x軟件測量血管網絡的長度。
1.5 MTT實驗 HUVECs接種于含有200 μl TCM的96孔小室中。過夜孵育后,每個小室加入20 μl MTT試劑。4 h后移除培養基,并加入150 μl二甲基亞砜,使紫色沉淀物完全溶解。輕輕搖動10 min后,使用微板讀出器測定每個孔490 nm處的光學密度值。
1.6 遷移和侵襲實驗 采用傷口愈合試驗來評估細胞遷移。當細胞達到90%匯合時,用無菌移液管尖端在細胞單層上建立一個傷口。細胞洗2次后,用含有50 μg辛伐他汀的無血清培養基,或者含有50 ng/ml HRG-β1的無血清培養基,或者含有辛伐他汀和HRG-β1的無血清培養基重新培養,預處理12 h。最后用光學顯微鏡觀察傷口閉合情況并拍照。
Transwell實驗檢測細胞侵襲能力。稀釋Matrigel基質膠添加到小室中孵化。然后將懸浮在150 μl無血清培養基中的細胞添加到上室中,將含50 μm辛伐他汀的無血清培養基,或50 ng/ml HRG-β1的無血清培養基,或其混合物添加到下室。24 h后,用棉簽刮掉上室中的非侵入細胞。侵入細胞用4%的聚氧甲基苯乙烯固定15 min,然后用晶體紫色染色10 min。最后,6個隨機區域的染色細胞在顯微鏡下計數并拍照。
1.7 Western blot 腫瘤組織或細胞在液氮中粉碎,RIPA裂解液裂解蛋白提取上清液。提取蛋白質并使用BCA法進行蛋白質定量。進行SDS-PAGE并轉膜后孵育抗體,ECL化學發光檢測抗體。
1.8 免疫組織化學分析 將腫瘤標本嵌在石蠟中,隨后切成4 μm厚的切片,用內皮細胞標記物CD31對腫瘤切片進行免疫標記,觀察腫瘤組織中的血管形成情況。
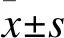
2 結果
2.1 HER2和VEGF蛋白在CRC細胞株中的表達 Western blot結果顯示,p-HER2、VEGF在LoVo、SW480、HCT116細胞中表達升高,在HT-29和Caco-2細胞中表達降低。見圖1。結果表明,致癌因子HER2表達與VEGF表達呈正相關,提示HER2參與CRC血管生成可能與VEGF相關。
2.2 辛伐他汀抑制CRC血管生成 TCM中培養的HUVECs比在無血清培養基培養具有更長的管狀結構(圖2A)。然而,辛伐他汀預處理的TCM培養的HUVECs小管的長度較未處理的小管產生明顯減少,但比在無血清培養基中產生的小管稍長。HUVEC的增殖是血管生成的一個關鍵因素,通過MTT法檢測HUVEs活力,結果顯示,辛伐他汀能夠顯著阻斷CRC細胞培養基,促進HUVECs增殖(圖2B)。結果提示,辛伐他汀可能抑制HER2+CRC細胞中血管生成信號的分泌。
2.3 辛伐他汀對腫瘤血管生成和HER2活性的抑制作用 與對照組相比,辛伐他汀治療組中CD31染色明顯降低(圖3A)。辛伐他汀治療可以抑制腫瘤的血管生成,降低微血管密度。辛伐他汀明顯降低p-HER2在腫瘤組織中表達水平(圖3B)。Western blot結果進一步證實辛伐他汀能夠降低p-HER2在細胞中蛋白表達(圖3C)。然而,HER2 mRNA分子水平沒有受到影響(圖3D)。此外,辛伐他汀治療后,腫瘤重量和腫瘤體積明顯低于對照組(圖3E、圖3F)。結果表明,HER2參與了辛伐他汀抑制腫瘤生長和血管生成過程。
2.4 辛伐他汀體外阻斷HRG-β1/HER2-誘導的血管生成 辛伐他汀顯著抑制HUVECs遷移、侵襲、血管生成和增殖能力,而HRG-β1處理HCT-116細胞培養基誘導HUVECs遷移、侵襲、血管生成和增殖能力。辛伐他汀明顯阻止了HRG-β1對細胞遷移、侵襲、血管生成和增殖能力的影響。結果表明,辛伐他汀能夠阻斷HRG-β1/HER2-誘導的體外血管生成。見圖4。
2.5 VEGF抑制劑參與辛伐他汀誘導減少血管生成過程 圖5A、圖5B結果顯示,VEGF在辛伐他汀處理組的表達較對照組明顯降低;VEGF在HRG-β1處理組的表達較對照組升高,而辛伐他汀降低了HRG-β1誘導的VEGF表達。貝伐單抗(BEV)、HRG-β1或者兩者共同處理CRC細胞,其細胞培養基培養HUVECs,即使HG-β1存在,BEV也能夠顯著抑制HUVECs增殖(圖5C)。此外,辛伐他汀可以阻斷VEGF誘導的HUVECs增殖(圖5D)。
3 討論
近年來,有學者認為,他汀類藥物是潛在的癌癥治療藥物。多項研究表明,他汀類藥物的抗癌活性是通過抑制內皮細胞的增殖和遷移以及誘導細胞凋亡來實現的。例如,洛伐他汀降低胰腺癌的腫瘤生長以及抑制胃癌細胞增殖[10-11];甲伐他汀抑制黑色素瘤細胞的增殖和侵襲[12];辛伐他汀抑制甲狀腺癌細胞增殖和遷移[13]。辛伐他汀通過上調PEA3、降低HER2表達而誘導HER2陽性乳腺癌細胞凋亡[14]。辛伐他汀可能通過激活HIF-1缺氧的上游調控者,促進或抑制血管生成,其還會干擾炎癥下游的血管生成信號[15]。
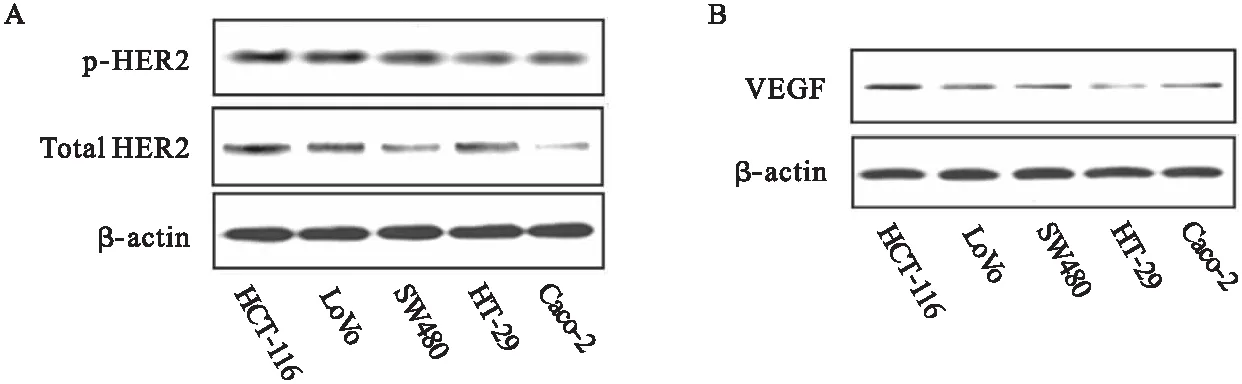
圖1 HER2和VEGF蛋白在CRC細胞中的表達
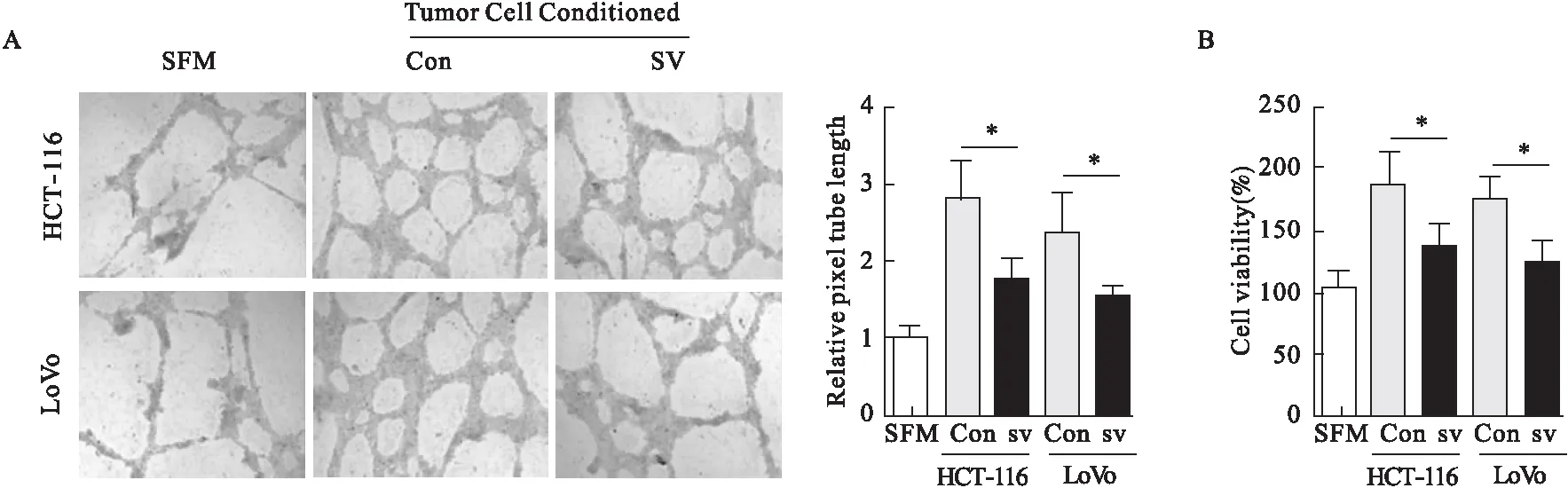
圖2 辛伐他汀抑制CRC血管生成
圖3 辛伐他汀對腫瘤血管生成及HER2活性的影響
注:A.免疫組化染色CD31+在腫瘤組織中表達,定量腫瘤切片微血管密度;B、C.p-HER2在腫瘤組織(B)和腫瘤細胞(C)中蛋白表達;D.檢測p-HER2 mRNA在腫瘤組織中表達;E.腫瘤重量;F.腫瘤體積
HER2屬于EGFR家族的一員,在CRC細胞系中表達上調,與腫瘤內VEGF相關的血管形成呈正相關。VEGF是一種生理和病理上的新血管化的關鍵調節劑,參與HER2引起的腫瘤細胞血管生成[16]。在本研究中,我們首先檢測了HER2和VEGF在CRC細胞系中的表達,發現HER2和VEGF在這些細胞中表達均上調,特別是在HCT-116和LoVo細胞中。此外,本研究顯示辛伐他汀在體內和體外抑制HER2信號通路以及腫瘤血管生成。結果表明,辛伐他汀抑制血管生成可能是通過抑制HER2的表達而發生。
HRG-β1是表皮生長因子家族中的一員,由間充質細胞分泌,并能通過轉運和磷酸化促進HER3或HER4形成異二聚體來間接激活HER2[17]。HER2過表達通過降低配體分離率大大增強了HRG與受體的結合親和力,而HER2降低則減弱了配體結合親和力與HER2信號。本研究發現,辛伐他汀通過抑制高水平p-HER2腫瘤細胞的血管生成細胞因子的分泌,顯著損害了HRG-β1誘發的血管生成。即使在低HER2水平下,HRG-β1也可以通過上調VEGF表達促進腫瘤血管生成。此外,在HRG-β1的孵育下,BEV可以顯著抑制CRC細胞培養基誘導的HUVEC細胞增殖。在腫瘤細胞培養基中加入辛伐他汀,可以阻斷VEGF對細胞增殖的抑制作用。研究表明,VEGF參與了HER2誘導的CRC細胞血管生成過程,這可能使其成為辛伐他汀抑制腫瘤血管生成的重要靶點。
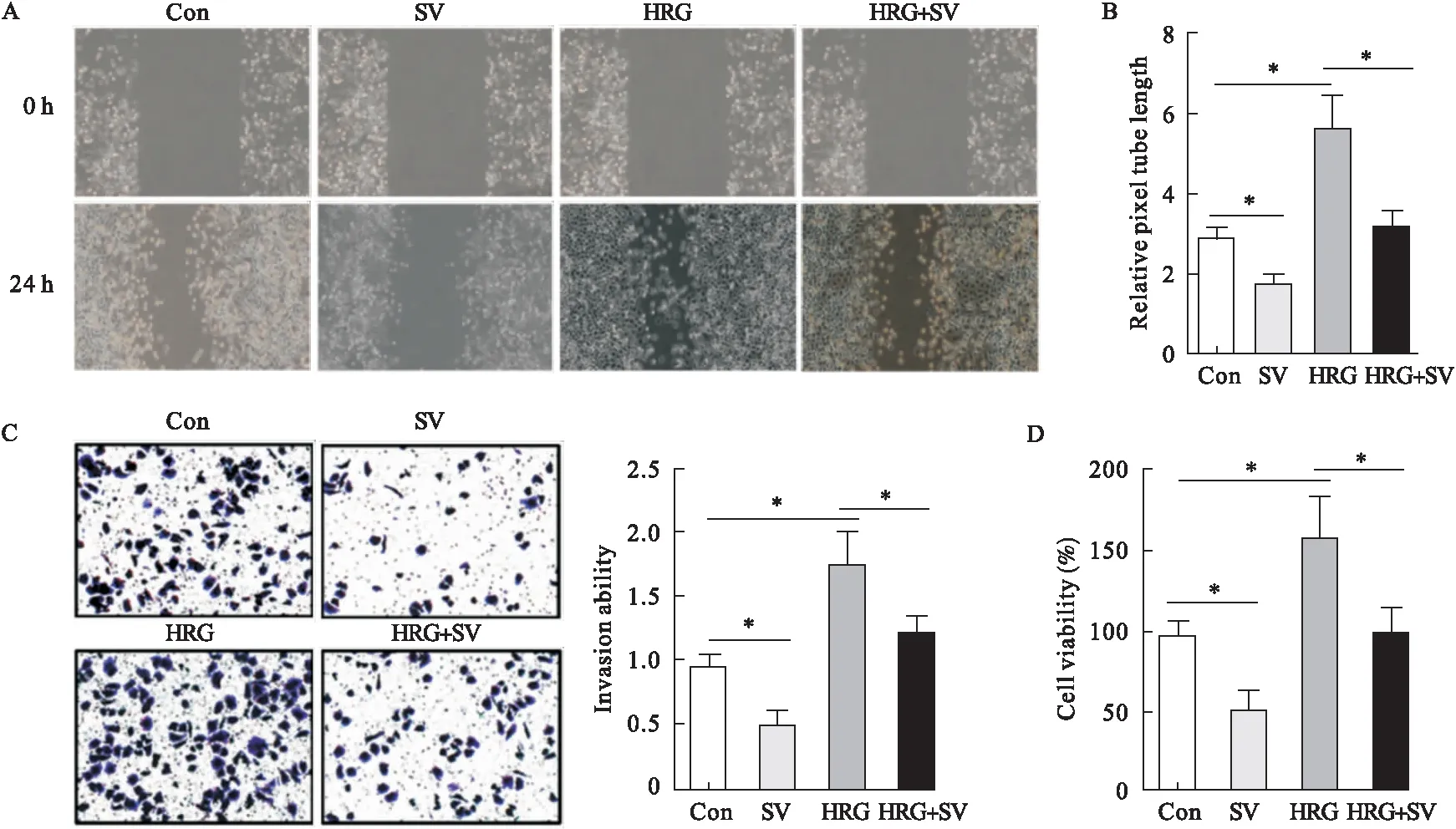
圖4 辛伐他汀體外阻斷HRG-β1/HER2-誘導的血管生成
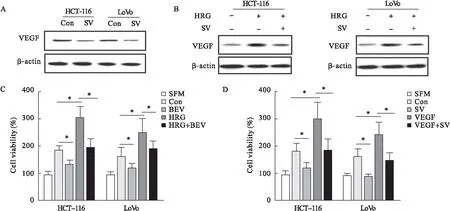
圖5 VEGF抑制劑參與辛伐他汀誘導減少血管生成過程
總之,本研究結果表明,辛伐他汀通過調節HER2/VEGF軸來抑制腫瘤的血管再生。抗血管生成可以通過阻礙血管生成過程以及使腫瘤血管正常化而使腫瘤細胞對化療藥物敏感,提示辛伐他汀對異常腫瘤血管的重塑可增強許多現有治療方法的效果。

