預熱處理大豆蛋白對鯉魚肌原纖維蛋白凝膠和流變學特性的影響
杜洪振,陳 倩,楊 振,孫欽秀,孔保華*
(東北農(nóng)業(yè)大學食品學院,黑龍江 哈爾濱 150030)
對于魚肉加工制品,特別是魚糜類制品,產(chǎn)品的質(zhì)構特性被認為是最重要的品質(zhì)特性之一。鯉魚由于其生長快、產(chǎn)量高、價格低、且味道鮮美而廣受歡迎。其中魚肉中的肌原纖維蛋白(myofibrillar isolate protein,MPI)在魚糜制品中起到凝膠和結合水的作用,決定了魚肉制品的品質(zhì)特性。近年來,非肉蛋白質(zhì)廣泛應用于肉制品中,以提高肉制品的產(chǎn)量和質(zhì)地,改善肉制品的乳化穩(wěn)定性和熱誘導凝膠特性。大豆分離蛋白(soy protein isolate,SPI)是一種廣泛用于肉制品中的蛋白質(zhì)添加劑,常用作乳化劑、保濕劑和填料/黏合劑,以改善碎肉和乳化肉制品的功能特性[1-2]。
SPI在加工肉制品中作為功能性添加劑的用途,在很大程度上由其與肌肉蛋白質(zhì)(特別是肌球蛋白)的相互作用和相容性決定。據(jù)報道,SPI中的7S和11S組分起主要凝膠作用,但是一般來說天然的SPI直接加入肉糜類制品中會降低肉糜的凝膠特性,這主要與SPI中蛋白質(zhì)的變性溫度有關。大豆蛋白中的7S和11S組分的變性溫度分別在73~82 ℃和76~96 ℃之間[3-5],而肌肉中的主要蛋白質(zhì)MPI變性溫度大約在67~72 ℃之間[6]。因此,當天然SPI加入肉糜制品中加熱時,MPI會先發(fā)生變性形成凝膠,而此時SPI尚未到達變性溫度,會奪取肌肉中的水分,從而造成蛋白凝膠結構疏松,彈性較差等問題。Peng等[7]研究發(fā)現(xiàn)天然大豆蛋白和肌球蛋白之間沒有發(fā)生相互作用,且β-伴大豆球蛋白的存在抑制了肌球蛋白重鏈在50 ℃和100 ℃之間的聚集[8]。有研究[9-10]進一步證實大豆蛋白中7S球蛋白在MPI凝膠中的拮抗作用,其中β-伴大豆球蛋白的存在能夠阻礙肌球蛋白重鏈的自聚集。另一方面高濃度的天然SPI也不利于MPI凝膠的形成[11]。因此,改善SPI的天然結構以增強其在肉制品中的功能性變得十分必要。
為克服天然SPI與肉蛋白之間相互作用存在的缺陷,可以通過對天然SPI改性以改變其功能特性。盧巖[12]將SPI添加到MPI中發(fā)現(xiàn),隨著SPI添加量的增加,添加天然SPI的蛋白凝膠強度顯著減小,而添加經(jīng)過羥基自由基氧化后的SPI蛋白凝膠強度顯著增大。耿蕊[13]和Niu Haili等[14]在極端酸性(pH 1.5)條件下結合適當加熱(60 ℃)處理SPI 5 h,并將改性后的SPI與MPI復配制成凝膠,結果表明添加經(jīng)過改性后的SPI蛋白凝膠強度顯著增大,而添加天然SPI的蛋白凝膠強度顯著降低。同樣,Jiang Jiang等[15]在極端酸性(pH 1.5)或堿性(pH 12)條件下處理SPI并添加到MPI中,結果顯示添加改性的SPI在加熱時能提高MPI的膠凝能力。
本實驗研究SPI在經(jīng)過不同時間預熱處理后與MPI復配,通過測定凝膠強度、白度、持水性、流變特性以及熱穩(wěn)定性的變化,研究不同預熱處理時間的SPI與MPI作用效果,為提高魚糜類制品的凝膠特性提供一定的理論支持。
1 材料與方法
1.1 材料與試劑
新鮮鯉魚(平均質(zhì)量1.5 kg)購于哈爾濱市好又多超市,保藏運至實驗室,宰殺去皮及內(nèi)臟后,4 ℃放置4 h,取魚背部肌肉提取MPI。
SPI 臨沂山生物制品有限公司;牛血清蛋白美國Sigma公司;哌嗪-N,N-雙(2-乙磺酸)(piperazine-N,N’-bis(2-ethanesulfonic acid),PIPES) 源葉生物科技有限公司;氯化鈉、氫氧化鈉、五水硫酸銅、磷酸氫二鈉、磷酸二氫鈉(均為分析純) 國藥集團化學試劑沈陽有限公司。
1.2 儀器與設備
T18 basic型高速勻漿機 德國IKA公司;TA-XT plus型質(zhì)構分析儀 英國Stable Micro System公司;ZE6000色差計 日本色電工業(yè)株式會社;GL-21M高速冷凍離心機 湖南湘儀實驗室儀器開發(fā)有限公司;TU-1800紫外-可見光分光光度計 北京普析通用儀器有限公司;722-2000分光光度計 山東高密彩虹儀器有限公司;DK-S24型電熱恒溫水浴鍋 上海森信實驗儀器有限公司;MAL1038384流變儀 英國馬爾文儀器有限公司;Q20差示掃描量熱(differential scanning calorimeter,DSC)儀 美國TA公司。
1.3 方法
1.3.1 鯉魚MPI提取及處理
根據(jù)Chin等[16]的方法并稍加修改,提取MPI。先將魚肉切碎并立刻稱取200 g,加入800 mL的蛋白提取液(20 mmol/L pH 7.5的冰磷酸鹽緩沖溶液),用勻漿機勻漿4 次,每次30 s,間隔10 s,得到的勻漿液在4 ℃、9 500×g離心15 min后,除去上清液。沉淀物中再加入800 mL的4 ℃ NaCl溶液(0.1 mol/L),重復以上步驟洗滌離心3 次。最后一次勻漿離心前用4 層紗布過濾,所得濾液在4 ℃、9 500×g離心15 min,沉淀即為鯉魚MPI。MPI濃度采用雙縮脲法測定,以牛血清蛋白做標準曲線。
1.3.2 實驗設計
將提取的MPI(蛋白質(zhì)質(zhì)量分數(shù)大約為7%)懸浮在含有0.6 mol/L NaCl(pH 6.25)的50 mmol/L PIPES緩沖液中,使溶液中的最終蛋白質(zhì)量濃度為40 mg/mL。用蒸餾水將SPI配制成40 mg/mL,置于水浴鍋中加熱待溫度達到90 ℃,分別保持30 min和180 min,然后在室溫冷卻備用。將經(jīng)過不同時間熱處理的SPI溶液分別與MPI溶液以不同體積比(0∶1、1∶1、1∶2、1∶3、1∶4)混合均勻,所有混合溶液的總蛋白質(zhì)量濃度均為40 mg/mL。
1.3.3 凝膠的制備
將20 mL攪拌均勻的蛋白溶液置于30 mm×50 mm磨口玻璃稱量瓶中,80 ℃水浴鍋中加熱30 min,取出迅速置于冰水中冷卻,然后放置在4 ℃冰箱中貯藏12 h。制備好的凝膠每次測定前在室溫(20~25 ℃)平衡30 min,然后用于測定凝膠持水性、白度和質(zhì)構。
1.3.4 凝膠硬度和彈性的測定
根據(jù)Buamard等[17]的方法進行凝膠質(zhì)構測定。測試時將樣品置于測定平臺上固定好,室溫條件下利用TA-XT plus型質(zhì)構分析儀進行測量。探頭型號選擇P/0.5(直徑為12 mm),下壓得到的穿透力即為蛋白的凝膠強度。選用的物性儀測定參數(shù)如下:測試前速率3.0 mm/s;測試速率0.3 mm/s;觸發(fā)力5 g;測試后速率3.0 mm/s;穿刺距離10.0 mm。每個樣品進行3 次平行實驗,取平均值。
1.3.5 凝膠白度值的測定
根據(jù)Park[18]的方法測定凝膠亮度L*值、紅度a*值和黃度b*值。白度值計算如式(1)所示:
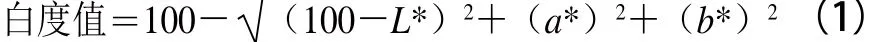
1.3.6 凝膠持水性的測定
MPI凝膠持水性的測定參考Salvador等[19]的方法。稱取5 g蛋白凝膠置于50 mL離心管中,4 ℃、1 600×g離心10 min后除去離心出的水分,測定離心管中凝膠離心前后的質(zhì)量。所有樣品重復3 次取平均值。持水性按照公式(2)計算:
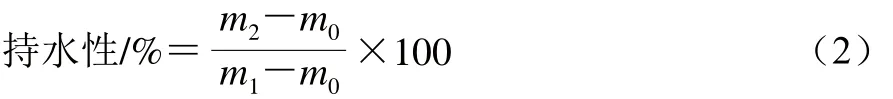
式中:m0為離心管質(zhì)量;m1為離心前離心管和凝膠質(zhì)量;m2為離心后離心管和凝膠質(zhì)量。
1.3.7 凝膠流變學性質(zhì)的測定
混合蛋白凝膠流變學特性的測定參考Niu Haili等[14]的方法并略作修改。使用配備有兩個平行板(直徑40 mm)的流變儀測量混合蛋白樣品熱凝膠化過程的流變性質(zhì),兩平板間距為1 mm。通過1 ℃/min的升溫速率將溶液從20 ℃加熱至80 ℃生產(chǎn)凝膠。每個樣品在固定頻率0.1 Hz下以振蕩模式連續(xù)剪切,最大應變?yōu)?.02,為防止脫水,在樣品的暴露邊緣涂上一薄層硅油。
1.3.8 蛋白質(zhì)熱穩(wěn)定性的測定
SPI經(jīng)過預熱處理后按照不同添加比例與MPI混合,通過DSC測定混合蛋白穩(wěn)定性的變化情況。精確稱量MPI 10~15 mg放入樣品池,放置DSC儀器的樣品支持器上,調(diào)整好儀器,用空盒作對照。實驗采用的測定溫度范圍為20~90 ℃,加熱速率為10 ℃/min。采用pyris6.0軟件進行數(shù)據(jù)記錄和處理得到DSC曲線,峰值點溫度為變性溫度,曲線形成的峰面積理論上為蛋白質(zhì)變性所吸收熱量。每個樣品重復3 次取平均結果。
1.4 統(tǒng)計分析
所得數(shù)據(jù)均為3 次重復的平均值,結果表示為 ±s。采用Statistix 8.1(分析軟件,St Paul,MN)軟件包中Linear Models程序進行數(shù)據(jù)統(tǒng)計分析,平均數(shù)之間顯著性差異(P<0.05)分析使用Tukey HSD程序,采用Sigmaplot 12.5軟件作圖。
2 結果與分析
2.1 SPI對MPI凝膠硬度和彈性的影響
如圖1A所示,純MPI凝膠硬度為58.73 g,隨著SPI-MPI比例1∶1~1∶4,蛋白凝膠強度顯著增高(P<0.05),這是因為形成熱誘導的凝膠網(wǎng)絡結構與MPI有更大的關系,MPI占比越高,凝膠硬度相對越大。此外高質(zhì)量濃度的SPI在加熱時其本身的自締合增加從而形成較弱的混合凝膠[14]。Jiang Jiang等[15]向MPI中添加天然SPI發(fā)現(xiàn),在總蛋白含量相同的情況下,隨著SPI添加量的增加蛋白凝膠強度顯著降低,且天然SPI的亞基不參與MPI的凝膠化過程。另一方面,在SPI添加量相同時,經(jīng)過較長時間預熱處理的SPI(180 min預熱),添加到MPI中獲得的蛋白凝膠強度顯著增大(P<0.05),且當SPI-MPI比例為1∶4,加熱時間為180 min時蛋白凝膠強度達到最大值47.60 g,說明熱處理后的SPI中β-伴大豆球蛋白的功能得到部分改善[9],從而具有增加肌肉蛋白凝膠強度的作用。此外SPI熱處理后可能發(fā)生共價交聯(lián)及疏水相互作用,從而提高了蛋白凝膠的強度。Liu Qian等[20]研究了pH值偏移結合熱處理對SPI凝膠結構的影響,結果表明SPI在加熱過程中形成二硫鍵。而O'Kane等[21]認為豆類蛋白凝膠網(wǎng)絡的形成主要依靠氫鍵和疏水鍵,而預熱處理可以增加這種作用力。
如圖1B所示,添加SPI對MPI凝膠彈性影響的變化趨勢與凝膠硬度一致。純MPI凝膠彈性為0.96,在總蛋白含量相同的情況下,隨著天然SPI-MPI比例1∶1~1∶4,混合蛋白的凝膠彈性分別下降了16.78%、15.22%、12.92%、10.79%(P<0.05),這可能是因為在SPI的含量相對較低時,MPI所占的比例較大,而MPI更有利于形成蛋白凝膠網(wǎng)絡,進而增大了蛋白的凝膠彈性[22]。在相同的SPIMPI比例下,經(jīng)過預熱處理的SPI與MPI混合,其凝膠彈性顯著高于添加天然SPI組(P<0.05)。經(jīng)過較長時間預熱處理SPI(180 min)與MPI混合后獲得的凝膠的彈性值高于短時間預熱處理的SPI(30 min)(P<0.05),且與單獨由MPI形成的凝膠相比無顯著差異。MPI中的肌球蛋白與易于與經(jīng)過預熱改性的SPI相互作用[7,9],并且熱處理有利于SPI中的組分參與凝膠形成[11],增強了凝膠結構的形成。這一點也可以從下面實驗結果中持水性的增強得到證實。
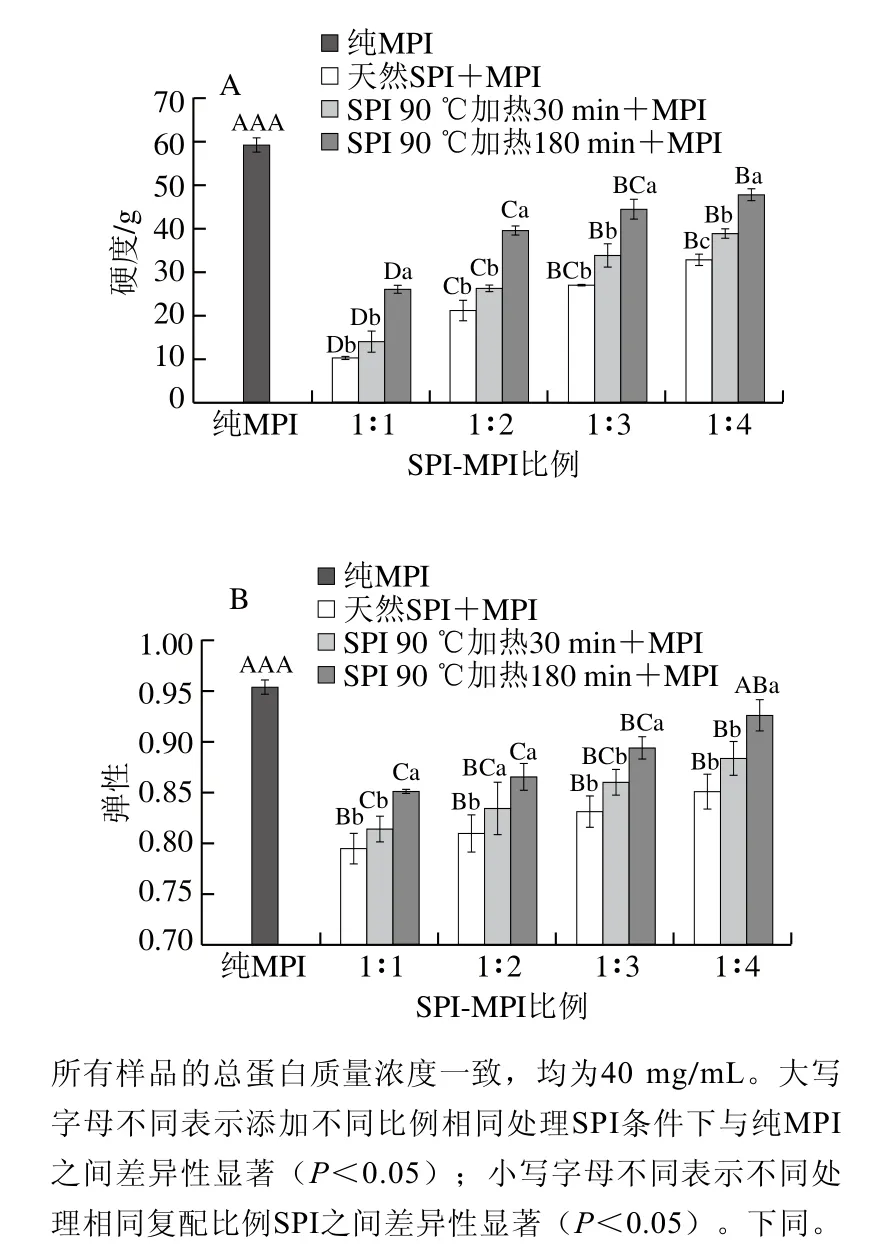
圖1 SPI對MPI凝膠硬度(A)和彈性(B)的影響Fig. 1 Effect of SPI on hardness (A) and springiness (B) of common carp MPI gel
2.2 SPI對MPI凝膠白度值的影響
如圖2所示,天然SPI與MPI混合后,蛋白凝膠白度值顯著降低(P<0.05),隨著SPI-MPI比例1∶1~1∶4,混合蛋白凝膠白度值顯著增加(P<0.05)。這可能是因為SPI本身為淡黃色,與MPI混合后降低了混合蛋白的凝膠白度值,當MPI所占混合凝膠的占比增大時,SPI含量相對降低,使得凝膠白度值增加。而經(jīng)過預熱處理后的SPI與MPI混合所得到的蛋白凝膠白度值均高于天然SPI混合蛋白凝膠;經(jīng)過較長時間預熱處理SPI(180 min),其與MPI形成的混合蛋白的凝膠白度值顯著高于短時間預熱處理的SPI(30 min)(P<0.05),并且經(jīng)過90 ℃熱處理180 min的SPI-MPI比例為1∶4時,蛋白凝膠的白度值與純MPI凝膠相比無顯著差異(P>0.05)。這可能是因為經(jīng)過熱處理后7S和11S組分變性,導致混合蛋白凝膠光反射增強,從而增強了凝膠白度值。Saeed[23]和Niu Haili[24]等認為白度值降低可能是由于色素蛋白的變化引起的,特別是肌肉蛋白質(zhì)氧化色素。
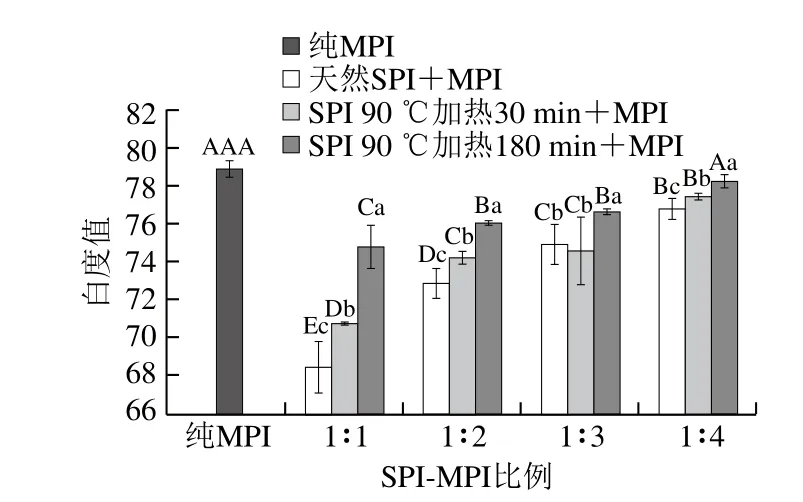
圖2 SPI對MPI凝膠白度值的影響Fig. 2 Effect of SPI on whiteness of common carp MPI gel
2.3 SPI對MPI凝膠持水性的影響
凝膠的持水性是蛋白凝膠體系中最重要的功能特性之一[25]。不同SPI-MPI比例蛋白凝膠持水性如圖3所示,純MPI凝膠持水性為89.34%,當天然SPI與MPI混合后,蛋白凝膠持水性顯著降低(P<0.05),而隨著SPI-MPI比例由1∶1~1∶4,蛋白凝膠持水性顯著增加(P<0.05)。當SPI-MPI比例為1∶1時形成的混合蛋白凝膠網(wǎng)絡結構較差,這是由于SPI添加量過多時,兩種蛋白質(zhì)的疏水相互作用增強,凝膠網(wǎng)絡束縛水分子的能力降低,在離心條件下,水分子很容易游離出來[26];當SPI添加量較小,也就是MPI比例增大時,會在一定程度上增強形成凝膠網(wǎng)絡結構。這些結果與凝膠強度的變化趨勢相似,它們都與蛋白質(zhì)形成凝膠能力有關,而凝膠形成能力的增強與MPI中肌球蛋白有關,這些蛋白的利用效率增加便會強化熱誘導形成致密的凝膠網(wǎng)絡結構,不但提高了凝膠的強度,而且提高了凝膠的持水能力。當SPI經(jīng)過熱處理后與MPI按比例混合后,持水性顯著高于天然SPI形成的凝膠(P<0.05),且熱處理時間越長增加越明顯。這可能是由于SPI經(jīng)過熱處理后,7S和11S組分結構發(fā)生改變,帶電氨基酸殘基數(shù)變多,水合能力增強。此外SPI熱處理180 min后,隨著MPI比例增加,呈現(xiàn)先增加后減小的趨勢,且在SPI-MPI比例1∶3時凝膠持水性為91.02%,與純MPI凝膠持水性差異不顯著(P>0.05)。此時混合蛋白間的凝膠網(wǎng)絡結構增強、空隙更加致密,通過虹吸截留的水分增多[27],從而提高了蛋白凝膠的持水性。
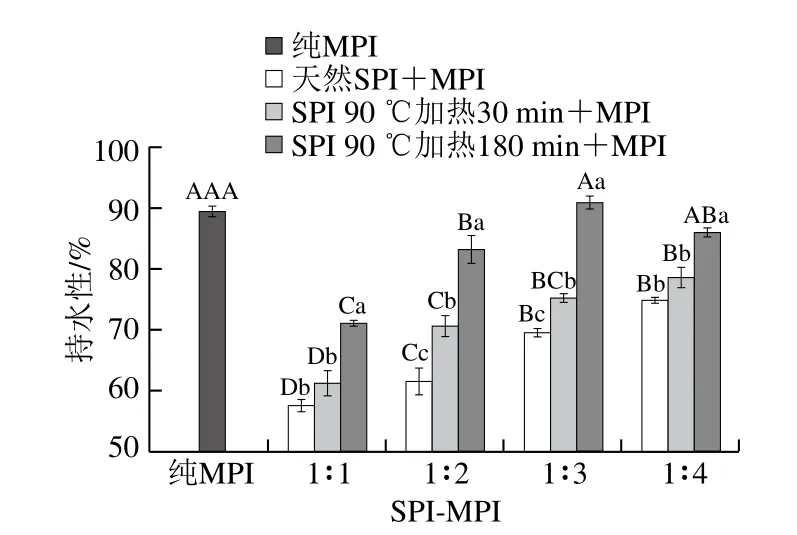
圖3 SPI對MPI凝膠持水性的影響Fig. 3 Effect of SPI on WHC of common carp MPI gel
2.4 SPI對MPI凝膠流變學性質(zhì)的影響
根據(jù)2.1節(jié)及2.3節(jié)等相關結果可知SPI-MPI比例為1∶3時混合蛋白硬度和持水性與純MPI差異不顯著(P>0.05)。因此選取SPI-MPI比例為1∶3的混合蛋白作為研究對象(下同),并與純MPI溶液進行比較,研究混合蛋白熱誘導凝膠流變性質(zhì)(儲能模量G’)的變化。如圖4所示,純MPI在初始階段(20~30 ℃),G’隨溫度變化非常緩慢,說明此溫度范圍內(nèi)蛋白間的相互作用比較弱,不足以形成預凝膠狀態(tài)。當溫度升至30 ℃以上時,G′迅速升高,43 ℃左右時達到第1個峰值,此時肌球蛋白頭部區(qū)域展開形成頭對頭的疏水結構[28]。當溫度繼續(xù)升高至53 ℃左右時,G’曲線迅速下降,說明此時預凝膠狀態(tài)形成,肌球蛋白尾結構發(fā)生改變,從而暴露了疏水性區(qū)域和特定的側(cè)鏈基團[28]。Egelandsdal[29]和Liu Gang[30]等認為,當溫度低于50 ℃時,重肌球蛋白變性(展開)及肌球蛋白細絲交聯(lián)是導致G’初始增加的原因,而在溫度升至50 ℃以上后,輕肌球蛋白的變性和細絲“流動性”增加導致G’下降。Wu Wei等[31]則認為G’的減少是由于形成凝膠網(wǎng)絡速率常數(shù)的動力學限制造成的。隨著溫度的繼續(xù)升高,G’又開始不斷升高,說明此時更持久的不可逆的肌球蛋白絲或復合物的形成導致G’的穩(wěn)定增加[11]。而Niu Haili等[14]認為是由于大部分肌球蛋白分子展開并形成無規(guī)卷曲結構,從而導致蛋白質(zhì)聚集體之間的交聯(lián)數(shù)量增加。
當SPI與MPI混合后,G’第1個峰值的出現(xiàn)溫度與純MPI相比升高了2~4 ℃。這是因為SPI的變性溫度比MPI高,加入SPI相當于降低了MPI的含量從而導致G’峰值溫度增加。這一點從蛋白熱穩(wěn)定性結果得到證實。此外,對于經(jīng)過預熱處理180 min的SPI組而言,G’第1個峰值由純MPI的88.2 Pa降至70.6 Pa,而熱處理30 min組和天然蛋白組則分別降至38.9 Pa和28.0 Pa。這是因為天然SPI中的β-伴大豆球蛋白能夠減少從50 ℃加熱到80 ℃期間肌球蛋白重鏈的自聚集,從而干擾MPI凝膠網(wǎng)絡的形成;而預熱處理實質(zhì)上減少了11S酸性和堿性亞單位的聚集,使得堿性亞單位在隨后的膠凝過程中保持解離形式與肌球蛋白相互作用[9]。另一方面,蛋白質(zhì)凝膠的強度由摻入凝膠網(wǎng)絡中的顆粒(聚集體)的量以及這些顆粒之間相互作用的強度決定[32]。SPI與MPI之間的相互作用不如MPI蛋白分子間的相互作用強,故而降低了G’峰值,但SPI通過預熱處理改性后在一定程度上增強SPI與MPI之間的相互作用強度。
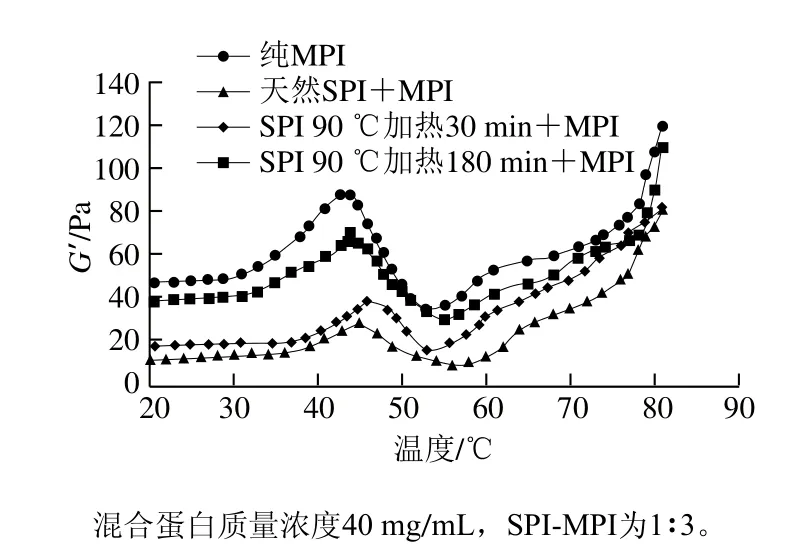
圖4 SPI對MPI凝膠G’的影響Fig. 4 Effect of different types of SPI on storage modulus of common carp MPI
2.5 SPI對MPI熱穩(wěn)定性的影響
DSC技術適用于研究蛋白質(zhì)的熱變性[33]。如圖5及表1所示,純MPI的DSC掃描圖譜呈現(xiàn)3 個主要峰值記為Tmax1(53.15 ℃)、Tmax2(63.48 ℃)和Tmax3(73.95 ℃),分別代表肌球蛋白重鏈、肌球蛋白輕鏈和肌動蛋白熱變性溫度。MPI中加入天然SPI后,Tmax1并沒有顯著改變(P>0.05);而加入熱處理30 min和180 min的SPI后,Tmax1顯著降低(P<0.05)。這可能是由于天然SPI與MPI之間不發(fā)生交聯(lián),而SPI分別熱處理30 min和180 min后與肌球蛋白頭部發(fā)生交聯(lián)導致MPI凝膠熱穩(wěn)定性顯著降低[34]。此外MPI中加入天然SPI后其DSC掃描圖譜呈現(xiàn)4 個主要峰值Tmax1(53.30 ℃)、Tmax2(63.54 ℃)、Tmax3(71.60 ℃)和Tmax4(92.73 ℃),由圖5可知,天然SPI組與純MPI及熱處理SPI組相比Tmax3峰較寬。這是由于7S和11S組分的變性溫度分別在73~82 ℃和76~96 ℃之間[3],結合流變結果添加天然SPI后第1個峰值延后2~4 ℃可知,7S組分與肌動蛋白熱變性溫度較接近從而造成添加天然SPI組Tmax3峰較寬,而Tmax4對應SPI中11S組分變性溫度。綜合以上兩點可知在混合蛋白中天然SPI與MPI分別獨立存在。
當MPI中添加SPI后,Tmax2均無顯著改變(P>0.05),說明肌球蛋白輕鏈與SPI間不發(fā)生交聯(lián)或相互作用。而Niu Haili等[24]在極端酸性(pH 1.5)條件下結合適當加熱(60 ℃)處理SPI 5 h,并將改性后的SPI與MPI復配也得到類似的結果。相反MPI中添加天然SPI和熱處理30 min SPI后與純MPI組相比Tmax3顯著降低(P<0.05);而MPI中添加熱處理180 min SPI后,Tmax3顯著增大(P<0.05)。這是由于肌動蛋白與SPI發(fā)生交聯(lián),形成緊湊、有序構象的高分子質(zhì)量生物聚合物,從而導致肌動蛋白變性溫度升高[16]。另一方面,MPI中添加熱處理30 min的SPI后,Tmax4顯著降低(P<0.05),而添加熱處理180 min的SPI后,Tmax4消失。從而進一步說明熱處理有利于SPI與肌動蛋白之間發(fā)生交聯(lián),導致肌動蛋白的變性溫度升高及Tmax4消失。
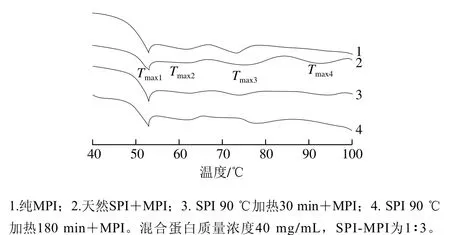
圖5 SPI對MPI凝膠熱穩(wěn)定性的影響Fig. 5 Effect of different types of SPI on thermal stability of common carp MPI
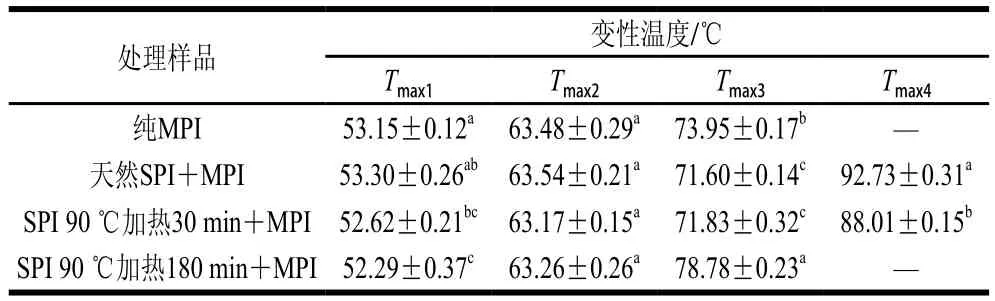
表1 SPI對MPI凝膠最大變性溫度的影響Table 1 Effect of different types of SPI on maximum transition temperatures (Tmax) of common carp MPI
3 結 論
經(jīng)過預熱處理的SPI與MPI復配能夠改進混合蛋白凝膠性和流變性。預熱處理(90 ℃加熱30 min和180 min)的SPI與MPI混合形成的凝膠,其硬度、彈性、白度和持水性顯著高于天然SPI與MPI混合蛋白凝膠,這表明預熱處理后的SPI在一定添加比例下具有改善蛋白凝膠特性的作用。流變學研究結果表明,添加SPI會提高蛋白變性溫度。經(jīng)過預熱處理的SPI與MPI混合后,其G’盡管低于純的MPI,但是顯著高于未經(jīng)過預熱處理的SPI。熱穩(wěn)定性結果表明,天然SPI與MPI之間不發(fā)生交聯(lián)而熱處理能夠促進SPI與MPI之間發(fā)生交聯(lián)。以上結果表明,SPI經(jīng)過預熱處理后與鯉魚MPI按一定比例復配能夠顯著改善混合蛋白質(zhì)的凝膠性、流變性和熱穩(wěn)定性。綜上,在魚糜生產(chǎn)中,添加經(jīng)過預熱處理的SPI對于提高魚糜制品的凝膠品質(zhì)具有很大的應用潛力。

