OPO乳脂粉對腸道微生物體外發酵的影響
侯愛香,成 煥,李宗軍,*,李 月
(1.湖南農業大學食品科學技術學院,湖南 長沙 410128;2.湖南農業大學 國家植物功能成分利用工程技術研究中心,湖南 長沙 410128)
1,3-二油酸-2-棕櫚酸甘油三酯(1,3-dioleoyl-2-palmitoyl triglyceride,OPO)是棕櫚酸位于sn-2位、油酸位于sn-1,3位的三酰基甘油酯。OPO是人乳脂和豬油的重要成分,也是添加在嬰幼兒配方奶粉中的營養補充劑。添加在嬰幼兒奶粉中的OPO是以植物油為原料,在脂肪酶催化作用下進行酯交換,使sn-2位上的棕櫚酸含量達到40%以上,從脂肪酸組成和分布上接近母乳脂肪[1-3]的結構脂。動物實驗和臨床調查研究發現,OPO結構脂的添加,可以減少嬰兒糞鈣流失,降低能量損失,激活免疫細胞,提高嬰幼兒的抵抗力[4-5]。因此,OPO作為一種有效的營養功能成分已被廣泛添加到嬰幼兒配方乳粉中[6]。通常,OPO以干法或濕法兩種形式添加到嬰幼兒配方奶粉中:一是用棕櫚油和酶作用制成富含OPO的植物乳脂油,濕法加入奶粉中;二是在富含OPO的植物乳脂油中加入乳糖等成分,經乳化干燥,制成粉劑營養補充劑[7],即富含OPO的植物乳脂粉,簡稱OPO乳脂粉,干法加入配方奶粉中。目前中國嬰幼兒配方奶粉中,很多采用干法加入的方式[8]。近年來,隨著學習壓力的增大,生活節奏的變快,電子產品的增多和戶外運動量的減少,我國青少年身體素質呈持續下降趨勢[9]。大學生是國家的人才后備主力,但很大一部分由于遠離家庭監管,飲食和作息不規律,學業競爭激烈,就業和深造壓力大,身體素質也大不如前,現已經引起社會的廣泛關注[10]。OPO乳脂粉作為嬰幼兒配方奶粉的營養補充劑,是否可用于青少年的膳食補充,也成為青少年營養食品開發需要關注的新問題。
研究發現腸道微生物與人類健康密切相關,它在人體疾病發生、免疫調控、膳食因子互作等方面都起著至關重要的作用[11-14]。近年來有大量研究從腸道微生物和代謝組角度關注食品添加劑、食品乳化劑、益生元、功能性成分、微量元素、多酚類化合物等膳食因子對機體的影響[15-17]。腸道微生物與膳食因子互作已成為人類闡釋膳食因子調控健康研究的熱點和著眼點。OPO乳脂粉與人體腸道微生物的互作效應也成了闡釋OPO乳脂粉營養機制的有效途徑。同時,研究發現,腸道微生物體外厭氧發酵和腸道內發酵在細菌數量、組成、多樣性和代謝產物等方面都相似,體外厭氧發酵模型已被越來越多研究者采納[18-19]。周笑犁等[20]通過體外發酵模式,研究發現大豆寡糖提高了發酵液微生物的多樣性。謝旻皓等[21]通過體外發酵模式,發現苦丁茶冬青苦丁茶及3,5-diCQA具有一定的調節腸道微生態的作用。Guergoletto等[22]利用體外發酵模型探討了Euterpe edulis的體外發酵特性。因此,OPO乳脂粉與腸道微生物的互作研究也可以嘗試采用體外發酵模式來實現。
目前,OPO乳脂粉的應用范圍相對較小,主要集中在嬰幼兒奶粉中,為進一步發揮OPO乳脂粉的營養作用,拓寬應用范圍,強健青少年體魄,本研究以富含OPO的植物乳脂粉為原料,以健康普通大學生的新鮮糞便為菌源,采用體外厭氧發酵模式,研究不同含量OPO的添加在不同發酵階段對pH值、微生物結構數量及代謝產物短鏈脂肪酸的影響,為OPO乳脂粉產品在青少年食品中的推廣應用提供基礎數據,為大學生營養食品的開發提供前期研究。
1 材料與方法
1.1 材料與試劑
OPO乳脂粉:含有50%植物精煉油(精煉油為含40%OPO的棕櫚油)、41.63%乳糖、4.21%蛋白質、3.72%水,穩定劑、乳化劑、維生素、和礦物質等成分合計為0.44%,由中國無錫某食品添加劑公司提供。
糞便樣品:20~22 歲3 名健康女大學生志愿者的新鮮糞便,所選志愿者飲食正常,兩個月內未服用或注射過抗生素、未患腹瀉及腸炎等疾病,且采樣時未在生理期。
含氮基礎發酵液:1 L純凈水,酵母粉2 g,蛋白胨2 g,NaHCO32 g,L-半胱氨酸0.5 g,膽汁酸鹽0.5 g,吐溫-80 2 mL,NaCl 0.l g,氯化血紅素0.05 g,K2HPO40.04 g,MgSO4·7H2O 0.01 g,CaCl2·7H2O 0.01 g,VK 10 μL,0.025 g/100 mL刃天青4 mL。
選擇性培養基:Wilkins and Chalgren瓊脂用于計數總厭氧菌[23];BBL培養基用于計數雙歧桿菌[24];Rogosa培養基用于計數乳酸桿菌[25];Sulfite-polymyxin-milk瓊脂用于計數梭狀芽孢桿菌[26];擬桿菌礦物鹽瓊脂用于計數擬桿菌[27];紫紅膽鹽葡萄糖瓊脂用于計數腸桿菌科菌[28];營養瓊脂用于計數總需氧菌[29]。培養基均購于北京陸橋技術股份有限公司。
酵母粉、蛋白胨、L-半胱氨酸、膽汁酸鹽、吐溫-80 國藥集團化學試劑有限公司;NaHCO3、NaCl、K2HPO4、MgSO4·7H2O、CaCl2·7H2O 成都市科龍化工試劑廠;氯化血紅素、刃天青、VK 天津市密歐化學試劑有限公司;除特殊規定外,本研究所用試劑均為分析純,水為蒸餾水。
1.2 儀器與設備
HH-8電熱恒溫水浴鍋 上海浦東物理光學儀器廠;TP-213分析天平 北京賽多利斯儀器系統有限公司;SP500高壓蒸氣滅菌鍋 日本Yamato公司;SW-CJ-2D超凈工作臺 蘇州凈化設備有限公司;YQX-I厭氧培養箱 上海躍進醫療器械廠;SPX-250B-Z恒溫生化培養箱 上海博迅實業有限公司醫療設備廠;TG16-WS高速臺式離心機 長沙湘儀離心機儀器有限公司;C-43圓底立式培養袋、C-1厭氧產氣袋 日本三菱瓦斯化學株式會社;7890A氣相色譜儀美國安捷倫科技有限公司;Testo205 pH計 德國Testo AG集團;旋渦振蕩器 邁菱貿易(上海)有限公司。
1.3 方法
1.3.1 糞便處理
糞便取樣器、壓舌板、一次性手套、鑷子、牛皮紙、自封袋、EP管離心管、試劑瓶等采樣工具提前滅菌,部分塑料取樣用具再用DEPC水浸泡24 h以上;采集每位志愿者的新鮮糞便10 g,在厭氧操作箱中將3 名志愿者的糞樣混勻,取混合糞樣10 g加入到100 mL無菌的稀釋液中按1∶10稀釋,加幾粒無菌玻璃珠渦旋,使糞便充分分散。稀釋的糞液用4 層無菌紗布過濾取濾液為菌源液,所有新鮮糞便樣品的采集和處理需在1 h內完成。
1.3.2 OPO厭氧發酵
參考Li Yanqi[30]和Zhang Xin[31]等體外發酵研究方法進行改進,用于OPO對人體腸道微生物的影響研究。37 ℃條件下,模擬人體腸道環境,配制發酵液,加入菌源靜態厭氧發酵24 h,檢測各發酵階段(0、4、8、12、24 h)短鏈脂肪酸、pH值、微生物指標等。
將菌源液按接種量10%分別加入空白組和實驗組發酵液中。以含氮基礎發酵液為空白組。由于目前沒有成人食用OPO的相關標準,借鑒參照GB 14880—2012《食品安全國家標準 食品營養強化劑使用標準》[32],嬰幼兒配方奶粉OPO添加量為24~96 g/kg的要求,選擇上限96 g/kg、下限24 g/kg和中間值50 g/kg OPO含量為實驗組梯度,分別在含氮基礎發酵液中加入不同量OPO乳脂粉達到3 個OPO含量梯度,再結合沖泡奶粉時一般奶粉與水稀釋比為4.5 g/30 mL,發酵液中折算成OPO質量濃度分別為0.36、0.75、1.44 g/100 mL。將空白組和各實驗組分別分裝在Hungate厭氧滾管,置于37 ℃厭氧培養箱培養發酵,所有實驗進行3 次生物學重復。
1.3.3 pH值的測定
本研究采用pH計對發酵液進行pH值的測定。厭氧箱內把探頭插入裝有發酵液的厭氧滾管中,顯示所測溫度和pH值,讀數每秒更新2 次,AUTO HOLD閃爍直到點亮,讀數固定后記錄,即為所測樣液pH值,重復3 次。
1.3.4 短鏈脂肪酸的檢測
1.3.4.1 氣相色譜條件
HP-5毛細管柱(30 m×0.32 mm,0.25 μm);進樣口溫度200 ℃;氫火焰離子檢測器,溫度220 ℃;載氣N2,流速1 mL/min,分流比40∶1;燃氣H2,流速30 mL/min;助燃氣空氣,流速300 mL/min;隔墊掃吹為3 mL/min;進樣體積1 μL;柱箱升溫程序:初始溫度30 ℃,保持3.5 min,以5 ℃/min升溫至40 ℃,再以15 ℃/min升溫至150 ℃。
1.3.4.2 標準曲線的制作
將6 種短鏈脂肪酸標準樣品分別配制成不同濃度的標準溶液(10~60 mmol/L),氣相色譜分析得到標準曲線。以3 倍的信噪比計算6 種短鏈脂肪酸的檢出限。
1.3.4.3 樣品前處理
從-80 ℃冰箱取出發酵液解凍,后轉移至潔凈離心管中,10 000 r/min離心20 min,除去其他微粒及菌體,取清液,以25%偏磷酸-清液9∶1比例加入25%偏磷酸,反應30 min,經0.22 μm膜過濾后測定。短鏈脂肪酸的檢測在中國科學院亞熱帶農業生態研究所完成。
1.3.5 微生物檢測計數
參考趙蘭濤[33]和Palframan等[34]所用的計數方法,用10 倍梯度稀釋法(稀釋液為0.85%生理鹽水),選取合適梯度稀釋液100 μL均勻涂布于7 種選擇性培養基上,從取樣至涂布結束在2 h內完成。涂布后乳酸桿菌、腸桿菌和總需氧菌在37 ℃需氧培養24~48 h后分別計數,而總厭氧菌、擬桿菌、雙歧桿菌和梭狀芽孢桿菌在37 ℃厭氧培養48~96 h分別計數。
1.3.6 益生元指數計算
益生元指數是評價腸道菌群是否正常、平衡的一個重要指標,其中Palframan等[34]采用的計算方法為眾多研究者所采納。該指數用來衡量體外模型中低聚果糖益生元作用,由此避免因取樣接種不均衡、初始菌數量和總菌數量不一致所導致的實驗結果偏差。Palframan通過比較益生元指數的大小,定量描述各類低聚糖的益生元作用。本研究借鑒使用益生元指數,用以評價不同濃度OPO乳脂粉的益生作用。計算公式如下:
益生元指數=Bif/Total-Bac/Total+Lac/Total-Clos/Total
式中:Total表示取樣時發酵液中總腸道菌數量和接種時發酵液中其數量的比值;Bif表示取樣時發酵液中雙歧桿菌數量和接種時發酵液中其數量的比值;Lac表示取樣時發酵液中乳酸桿菌數量和接種時發酵液中其數量的比值;Bac表示取樣時發酵液中擬桿菌數量和接種時發酵液中其數量的比值;Clos表示取樣時發酵液中梭狀芽孢桿菌數量和接種時發酵液中其數量的比值。
1.3.7 B/E(Bifidobacterium/Enterobacter)值的計算
在上個世界70年代,Van Der Waaij等[35]就將B/E值作為腸道菌群定植抗力的指標,反映腸道菌群結構,其為腸道內雙歧桿菌和腸桿菌數量的比值。B/E>1表示腸道菌群中雙歧桿菌的水平高于腸桿菌科的水平,可改善腸道菌群結構,有利腸道有益菌定植;B/E<1表示腸道菌群中雙歧桿菌的水平低于腸桿菌科的水平,沒有特殊的改善腸道菌群作用。
1.4 數據統計與分析
本研究實驗均進行3 次生物學重復,結果數據采用Excel 2010進行統計,數據以 ±s表示;并運用SPSS 21.0軟件的單因素分析方法(ANOVA)進行顯著性分析;通過OriginPro 8.1軟件完成數據折線圖的繪制。
2 結果與分析
2.1 發酵過程中pH值的變化
pH值反映微生物生境酸堿度,腸道微生物通過代謝營養物質,產生有機酸、短鏈脂肪酸等代謝產物,會改變腸道生境的酸堿度,添加OPO乳脂粉發酵液pH值測定結果如表1所示。
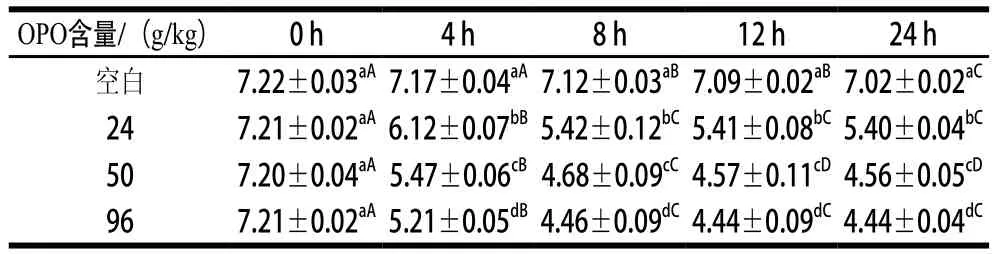
表1 發酵液樣品pH值Table 1 pH values of fermented liquid samples
由表1可知,實驗組pH值都隨著發酵時間的延長而降低,且添加量越高,其pH值下降幅度越大;空白組pH值也呈下降趨勢,但通過24 h 的體外發酵總體下降僅0.2左右,下降幅度不大。所有實驗組和空白組的起始pH值幾乎一致,說明沒有通過腸道微生物的發酵,只添加OPO乳脂粉不會引起生境pH值的改變。實驗組pH值在發酵的前8 h階段大幅度下降,而8 h以后,所有實驗組的酸堿度下降幅度不大,趨于平穩。推測在分批培養的密閉厭氧發酵過程中,前8 h階段,腸道微生物快速生長,積累大量有機酸、短鏈脂肪酸類代謝產物,導致發酵體系的pH值快速下降;而發酵后期營養物質開始缺乏,部分有機酸、短鏈脂肪酸作為能量或碳源不斷被消耗,使發酵后期pH值下降幅度不大,此外發酵后期營養物質缺乏,微生物生長代謝緩慢也使發酵體系后期的pH值保持相對較低水平,變化波動不明顯。因此,OPO乳脂粉能迅速降低腸道菌群生境中的pH值,促進腸道菌群生長,使其產生酸性物質,從而使體外發酵環境保持酸性。
2.2 發酵過程中短鏈脂肪酸的變化
以外標法定量,分析樣品中乙酸、丙酸、異丁酸、丁酸、異戊酸和戊酸的含量。6 種酸都可以被色譜柱有效分離,標準品氣相色譜圖如圖1所示,其保留時間分別為10.852、11.437、11.618、12.039、12.314 min和12.794 min,各短鏈脂肪酸區分清楚,該方法可以用于樣品檢測。
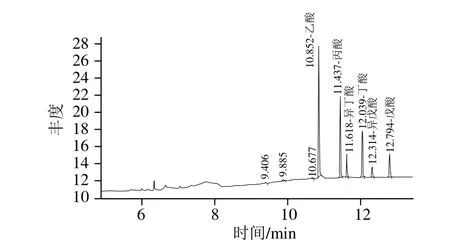
圖1 標準樣品氣相色譜圖Fig. 1 GC chromatograms of short-chain fatty acid standards

表2 各發酵體系不同發酵時間短鏈脂肪酸質量濃度Table 2 Concentrations of SCFAs produced at different time points of fermentation in the presence of different concentrations of OPO μg/mL
由表2可以看出,24 h體外發酵過程中總短鏈脂肪酸的含量都隨時間的延長而持續增加。空白組的總短鏈脂肪酸增速平穩,增加幅度不大,初始含量從僅(99.55±0.68)μg/mL增長到(398.67±1.04)μg/mL。3 個實驗組在發酵過程中總短鏈脂肪酸含量均呈大幅度增加,且OPO含量越大,增幅越大,在發酵體系中的含量越多。整個發酵過程的24 h內,96 g/kg組,總短鏈脂肪酸由初始(271.70±0.72)μg/mL增加到(4 869.49±4.30)μg/mL;50 g/kg組,總短鏈脂肪酸由初始(192.15±1.18)μg/mL增長到(4 024.62±4.97)μg/mL;24 g/kg組,總短鏈脂肪酸由初始(152.50±0.82)μg/mL增長到(2 744.25±4.29)μg/mL。由以上數據比較可以看出,OPO乳脂粉的添加,可以大幅度增加腸道微生物生境中總短鏈脂肪酸的含量,且短鏈脂肪酸含量與OPO含量呈正相關。
由表2可知,體外發酵過程中6 種短鏈脂肪酸,乙酸含量遠遠高于其他短鏈脂肪酸,其次是丙酸含量,之后是丁酸含量,還含有少量的戊酸,而異丁酸和異戊酸質量濃度最低均在10 μg/mL以下。由于乙酸是本研究中腸道微生物代謝產生的最主要的短鏈脂肪酸,其在體外發酵過程中的變化規律與總短鏈脂肪酸一致,OPO乳脂粉的添加可以大幅度增加腸道微生物生境中的乙酸含量,增加幅度與添加量呈正比。丙酸含量明顯低于乙酸,但高于其他4 種短鏈脂肪酸。空白組隨著發酵時間的延長,丙酸含量不斷增加,發酵結束時的丙酸含量達到最高(95.42±0.06)μg/mL。實驗組發酵結束時的丙酸質量濃度都只略大于初始質量濃度,但OPO的添加對丙酸含量的影響沒有統一的變化規律,96 g/kg組和50 g/kg組在均在4 h階段達到最大,隨后下降,且96 g/kg組的下降幅度大于50 g/kg組;24 g/kg組呈曲折上升趨勢,分別在0~4、8~12 h兩個階段呈上升趨勢,在4~8、12~24 h兩個階段呈下降趨勢。丁酸質量濃度在空白組發酵過程中變化很小,下降幅度不到2 μg/mL;實驗組均呈整體上升趨勢,即96 g/kg組和50 g/kg組先呈大幅度上升后略微下降,均在發酵12 h階段達到最大值;24 g/kg組則在發酵全過程呈穩定上升趨勢,上升幅度略小于另外兩組,實驗組中丁酸含量和上升幅度均與OPO含量呈正比。戊酸質量濃度空白組整個發酵過程都在1 μg/mL以下,含量極為微小;實驗組沒有明顯的一致規律,24 g/kg組呈曲折上升趨勢,上升幅度不大,由初始的(4.81±0.01)μg/mL上升到(9.09±0.04)μg/mL;96 g/kg組和50 g/kg組在發酵結束時的戊酸質量濃度都略低于初始質量濃度,均在0~8 h階段呈上升趨勢,12~24 h階段明顯下降。異丁酸含量占比很小,空白組呈上升趨勢,實驗組均在0~4 h階段迅速降到1 μg/mL左右,之后變化不大。異戊酸含量占總短鏈脂肪酸含量的比例很小,空白組和實驗組均較初始質量濃度有所增加。
綜上所述,OPO乳脂粉體外發酵產生的短鏈脂肪酸以乙酸、丙酸和丁酸為主,且OPO乳脂粉的添加能顯著提高發酵體系中總短鏈脂肪酸、乙酸和丁酸的含量。
2.3 體外發酵過程中微生物變化
2.3.1 體外發酵過程中微生物數量變化
根據益生元指數和B/E值的計算公式,采用傳統選擇性培養基,對涉及的腸道微生物進行培養計數,即體外發酵過程中的總厭氧菌、總需氧菌、雙歧桿菌、乳酸桿菌、擬桿菌、腸桿菌和梭狀芽孢桿菌,它們的數量變化規律如圖2所示。
由圖2可知,空白組中,在體外發酵過程中雙歧桿菌、乳酸桿菌、腸桿菌和梭狀芽孢桿菌數量相當,都在107數量級上,而擬桿菌相對少了其他菌1 個數量級。添加OPO乳脂粉的實驗組,雙歧桿菌和乳酸菌成為發酵過程中最主要的優勢菌,它們的數量在總菌數中占比相對較大。
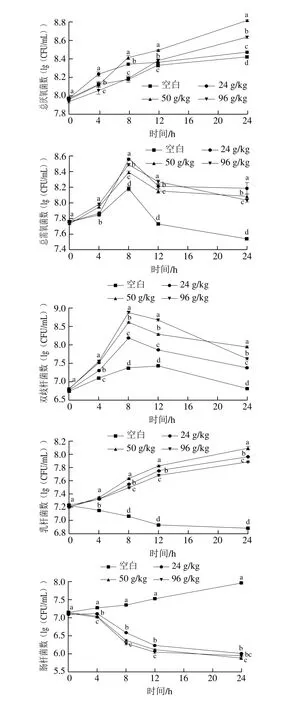

圖2 體外發酵過程中腸道微生物數量變化Fig. 2 Variation in intestinal microflora quantities during in vitro fermentation
傳統計數方法得出,實驗組的總厭氧菌數和總需氧菌數都高于空白組,說明OPO乳脂粉的添加總體上促進了腸道微生物的生長繁殖。空白組和實驗組的總厭氧菌在體外發酵過程中均呈上升趨勢,其中OPO含量50 g/kg組上升幅度最大,菌數最多。空白組和實驗組的總需氧菌均呈先上升后下降趨勢,都在8 h階段達到最大值,但空白組發酵結束時的菌數小于初始菌數,實驗組的均高于初始菌數,最終以24 g/kg組的(8.19±0.07)(lg(CFU/mL))最大。空白組和實驗組的雙歧桿菌均呈先上升后下降趨勢,都在8 h階段達到最大值,且實驗組均高于空白組,8 h階段,96 g/kg組雙歧桿菌數最多,達(8.88±0.01)(lg(CFU/mL));24 h結束時,50 g/kg組雙歧桿菌數最多,達(7.94±0.00)(lg(CFU/mL))。乳酸桿菌,空白組呈持續下降趨勢,而所有實驗組均呈持續上升趨勢,且50 g/kg組上升幅度最大,菌數最多,達到(8.09±0.03)(lg(CFU/mL))。腸桿菌,在空白組中呈明顯持續上升趨勢,而在所有實驗組中呈現持續大幅度下降趨勢,且實驗組腸桿菌數遠小于空白組。擬桿菌,所有實驗組數量均少于空白組,實驗組和空白組均呈先上升后下降趨勢,均在發酵4 h階段達到最大值,發酵結束時的菌數均少于初始菌數。梭狀芽孢桿菌,空白組呈緩慢持續上升趨勢,實驗組均是先下降后上升,其中96 g/kg組上升幅度較大,其次為空白組,24 g/kg組和50 g/kg組低于空白組,說明這兩個OPO添加量可以減緩梭狀芽孢桿菌的增長速度,但96 g/kg組只在發酵前4 h表現出抑制作用。
綜上所述,OPO乳脂粉的添加可以明顯增加體外厭氧發酵體系中總厭氧菌、總需氧菌、雙歧桿菌和乳酸桿菌的數量,大幅度減少腸桿菌的數量,還能在一定程度上減少擬桿菌和梭狀芽孢桿菌的數量,調節了腸道菌群的結構。
2.3.2 益生元指數變化
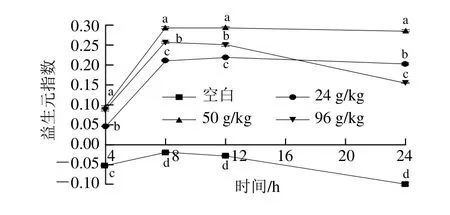
圖3 體外發酵過程的益生元指數變化Fig. 3 Variation in PI during in vitro fermentation
以總厭氧菌和總需氧菌之和計算總菌數。將圖2數據帶入益生元指數計算公式,將計算結果作成直觀的折線圖,如圖3所示。如圖3所示,空白組和實驗組的益生元指數都呈先上升后下降趨勢,均在8 h階段達到最大值。但空白組益生元指數在體外發酵過程的各個時間段均為負值,所有實驗組的益生元指數在各個時間段均為正值,說明3 個不同含量OPO乳脂粉的添加,都在體外發酵系統中表現出益生作用,且益生元指數最高的一組為50 g/kg組,以此評判該組益生效果最好。這結果與微生物計數中雙歧桿菌數和乳酸桿菌數的結果類似,它們與OPO乳脂粉的添加量不成嚴格的正比關系。
2.3.3 B/E值變化

表3 體外發酵過程的B/E值的變化Table 3 Variation in B/E ratio during in vitro fermentation
由表3可知,空白組的B/E值只有在發酵8 h階段略大于1,雙歧桿菌水平略高于腸桿菌水平,其他發酵時間均小于1,說明沒有添加OPO乳脂粉的基礎發酵液體系中雙歧桿菌沒能形成優勢菌。由表3發現,所有實驗組的B/E值在同一發酵時間均大于空白組,說明3 個添加量OPO乳脂粉均能夠改善腸道菌群結構。同時,空白組在發酵8 h時B/E值最大,而實驗組均在發酵12 h時達到最大,推測OPO乳脂粉的添加能夠促進雙歧桿菌對數生長期和穩定期的延長。在所有實驗組中,只有0 h的B/E值小于1,其他發酵時間段均大于1,說明糞便樣品作為菌源,雙歧桿菌沒有在菌源中占據優勢地位,這與多數研究成人糞便的結果一致[22]。但隨著OPO乳脂粉的添加,發酵時間的延續,雙歧桿菌逐漸在實驗組的發酵體系中積累增多,且在4~12 h階段,B/E值與OPO含量呈正比,90 g/kg組的B/E值最大,顯示出明顯的改善腸道菌群的作用。隨后,在發酵結束的24 h階段,發現50 g/kg組的B/E值最大。
3 討論與結論
通過體外厭氧發酵,本研究中腸道微生物所產的短鏈脂肪酸最主要是乙酸、丙酸和丁酸,蛋白分解所產的異丁酸、戊酸和異戊酸含量很少,這與眾多國內外學者研究結果一致[36-37]。其中乙酸含量最多,它是多數細菌的主要代謝產物,本研究中所檢測的擬桿菌、雙歧桿菌、乳酸桿菌和梭狀芽孢桿菌等碳水化合物代謝菌都產生乙酸,且本研究實驗組中雙歧桿菌是優勢微生物,因此發酵液中乙酸含量相對最大,其主要在肌肉、心臟、肝臟和腦內代謝,其是膽固醇合成的最主要底物,大部分被吸收,進入血液或進入肝臟代謝,能作為周邊組織的能源[38]。丙酸主要為擬桿菌等菌群的代謝產物,進入血液,吸收后在肝臟中分解代謝,參與丙酮酸逆轉化葡萄糖的過程,同時可能抑制脂肪的合成過程。丁酸主要為厚壁菌門的代謝產物,被譽為最重要短鏈脂肪酸之一,血液中能夠吸收,但主要被上皮細胞利用,是上皮細胞的主要能量來源,目前丁酸被充分證實的還有抗炎癥、抗癌變效果,基于丁酸在維持腸道健康過程中所起的作用,甚至有研究者認為新型益生元的設計要尋找可以提高丁酸產量的營養物質。而本研究所添加的營養物質OPO乳脂粉,不僅能顯著提高短鏈脂肪酸總量,還能提高大幅度提高乙酸和丁酸含量,OPO或OPO乳脂粉的營養功效可能與其代謝產物丁酸、乙酸的增加密切相關,同時這些代謝產物也可能對腸道微生物起到調節作用。
關于OPO、OPO乳脂粉與腸道微生物互作的研究相對較少,發現腸道微生物體外發酵OPO乳脂粉的結果與梁效[39]采用體外模式研究肉桂精油對大鼠腸道微生物影響的結果有一定相似性。兩種不同的含有三甘酯的物質體外發酵,都對腸桿菌、擬桿菌的抑制作用明顯,對梭狀芽孢桿菌有一定的抑制作用,能使乳桿菌成為主要的優勢菌群;但肉桂精油對雙歧桿菌有一定的抑制作用,OPO乳脂粉則能促進雙歧桿菌的生長,這可能與OPO乳脂粉中含有大量的乳糖有關。要進一步探明OPO的營養機制,后續還需要用OPO結構脂質的標準品與其他普通三甘酯進行對照研究。
短鏈脂肪酸含量與腸道微生物的數量結構密切相關,腸道微生物是維系人體內微生態系統的重要組成部分。研究發現,OPO乳脂粉的添加,大幅度促進雙歧桿菌及乳桿菌等有益菌增長,迅速降低發酵液中的pH值,有效抑制腸桿菌、擬桿菌的增長,明顯增加了益生元指數和B/E值,在腸道微生物的調控中,所添加的OPO乳脂粉發揮了積極作用。但通過益生元指數和雙歧桿菌、乳酸桿菌的增長情況,發現國標范圍內,中劑量的50 g/kg組益生效率更高。但由于傳統培養方法本身的局限,糞便中還存在大量未被培養的腸道微生物,且傳統培養計數操作繁瑣,工作量大,培養效率和精準性都有待提高,同時,OPO乳脂粉對腸道微生物多樣性的影響作用無法體現,后續還可進一步通過MiSeq平臺進行高通量測序來探究OPO、OPO乳脂粉對腸道微生物的影響。

