海藻糖保護植物組織和動物細胞的作用機制綜述
王一雯 權(quán)淑靜 馬煥
摘要:海藻糖是一種由α-糖苷鍵聯(lián)結(jié)葡萄糖分子組成的非還原性雙糖,這種可溶性物質(zhì)在綠藻及其他低等植物中發(fā)揮著重要的抗壓保護作用。它能幫助植物應對嚴寒、干旱、高鹽漬等極端環(huán)境,調(diào)節(jié)植物的氣孔導度和水利用率,并作為信號分子參與植物的生長發(fā)育和代謝調(diào)節(jié)。作為一種非滲透性冷凍保護劑,海藻糖因無毒、高效而被廣泛應用于各種動物細胞和組織器官的冷藏保護中。根據(jù)近年國內(nèi)外相關(guān)研究成果,將海藻糖對植物組織和動物細胞的保護、調(diào)節(jié)及作用機制加以概述,以期為海藻糖的深入開發(fā)利用提供理論依據(jù)。
關(guān)鍵詞:海藻糖;非生物脅迫;信號分子;凍存劑;作用機制
中圖分類號: S188 ?文獻標志碼: A ?文章編號:1002-1302(2019)02-0014-05
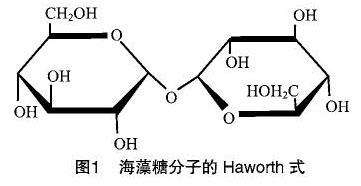
海藻糖化學全稱為α-D-吡喃葡糖基-α-D-吡喃葡糖苷,是由2個葡萄糖分子通過半縮醛羥基縮合而成的非還原性雙糖,分子式為C12H22O11,分子量大小為342.3,分子結(jié)構(gòu)式見圖1[1]。這種對稱的雙葡萄糖分子結(jié)構(gòu)所具有的穩(wěn)定性遠超麥芽糖、蔗糖、葡萄糖等其他糖類小分子,使其成為保持細胞活性、保濕類化妝品中的重要組成成分,更可作為防止食品劣化、保持食品新鮮風味、提升食品品質(zhì)的獨特食品配料。海藻糖存在于所有生命體內(nèi),是一種應急代謝產(chǎn)物和信號分子,在細胞處于高溫、冷凍、輻射、干燥、高滲透壓等不良環(huán)境時會在細胞內(nèi)大量合成,危機解除后作為能源物質(zhì)迅速分解[2],可幫助細菌、真菌、低等植物以及無脊椎動物等生命體抵抗環(huán)境壓力,確保在高鹽、酸性等極端環(huán)境中長久生存[3-4],從而保護生命體原有的形態(tài)結(jié)構(gòu)[5]。因此,保護性是海藻糖除作為甜味劑使用外的一個最主要功能,它可長效維持生物膜、蛋白質(zhì)等各種組織和生物大分子在非生物脅迫等極端環(huán)境下的穩(wěn)定性[6-7],保護二者結(jié)構(gòu)完整、不發(fā)生降解或變性。這種保護特性備受關(guān)注,有關(guān)其作用機制的研究更是爭議不斷、層出不窮。筆者將對海藻糖在植物組織中的調(diào)控作用及增強植物抗逆的作用機制、海藻糖對動物細胞的冷凍保護作用機制進行總結(jié)論述,更新海藻糖在種植、養(yǎng)殖、冷凍運輸?shù)刃袠I(yè)中的理論研究進展和應用范圍,為深入開發(fā)海藻糖提供理論依據(jù)和參考。
1 海藻糖在植物組織中的調(diào)控作用及抗逆保護機制
1.1 海藻糖作為代謝物調(diào)控植物的生長和發(fā)育過程
在微生物和無脊椎動物中,海藻糖主要參與碳水化合物的儲存、運輸及逆境保護等生理過程;植物中的海藻糖不僅直接參與代謝,還可作為植物生長發(fā)育的重要代謝產(chǎn)物參與到植物的代謝調(diào)控及基因表達調(diào)控當中[8]。其代謝前體物質(zhì)海藻糖-6-磷酸(T6P)能夠維持植物體內(nèi)碳含量平衡,延緩葉片衰老,影響果實坐果率,T6P參與的SnRK1信號通路對植物呼吸、淀粉合成、淀粉和蔗糖等多種代謝進行雙向調(diào)控,對不同植物的生長環(huán)境、生長時期均會作出相應的生長調(diào)節(jié)響應方式,確保植物生長發(fā)育正常進行,同時提高植物對旱害、冷害等逆境環(huán)境的適應性[9-10]。
1.2 海藻糖作為脅迫保護劑提高植物抵抗非生物脅迫的能力
非生物脅迫是指在特定環(huán)境下,任何非生物因素對植物造成的不利影響。如鹽堿、干旱、高溫、嚴寒、洪澇、礦物質(zhì)缺乏以及不利的pH值等。其中,鹽堿和干旱是制約植物生長的2個主要的脅迫因素。而在非生物脅迫條件下,海藻糖可充當碳源和脅迫保護劑用來提高植物的抗逆性,減少逆境脅迫對植物組織的傷害,維持植物正常生長[11]。
1.2.1 海藻糖提升植株高鹽漬脅迫的適應性 鹽脅迫對植物生長發(fā)育及生理代謝均會造成影響。種子萌發(fā)時,土壤中的鹽分濃度越高,種子發(fā)芽率、發(fā)芽指數(shù)和活力指數(shù)都減小,最終抑制其萌發(fā)和幼苗長大;在植物生長發(fā)育過程中,鹽脅迫會造成植物發(fā)育遲緩,抑制植物組織和器官的生長和分化,使植物的發(fā)育進程提前,最終抑制植物生長。鹽脅迫下,植物吸收不到足夠水分和礦質(zhì)營養(yǎng),葉片中葉綠素含量降低,也會間接影響光合性能。此外,鹽脅迫還會打亂植株正常的呼吸代謝、破壞植株體內(nèi)蛋白質(zhì)的合成等[12]。因此,提高植株耐鹽性對于促進作物的高產(chǎn)穩(wěn)產(chǎn)具有重要意義。
研究證實,將海藻糖合成酶相關(guān)基因轉(zhuǎn)入到不合成海藻糖的水稻、小麥等植株內(nèi),可提高這些植株對鹽脅迫的適應性,而外源海藻糖浸泡植株也同樣能減輕鹽脅迫對幼苗生長的抑制。閆道良等以揚麥19為材料,研究低濃度海藻糖對鹽脅迫下?lián)P麥19幼苗生長及生理特性的影響,試驗表明,經(jīng) 2 mmol/L的海藻糖浸種處理可提高揚麥19幼苗干物質(zhì)的合成與積累,促進揚麥19植株碳水化合物的合成,緩解鹽脅迫對幼苗葉綠素的破壞,降低鹽害對葉片光合作用的抑制,使植物更快適應鹽脅迫[13]。由此可見,海藻糖可作為植物適應脅迫的一種誘導劑,誘導植物通過基因表達及生理變化以適應后期的鹽脅迫;同時,作為一種信號分子,它可誘導揚麥19植株內(nèi)某些氨基酸合成及吸收鉀離子,以平衡鈉離子積累對細胞造成的傷害,從而提高植株對鹽脅迫的適應性。
1.2.2 海藻糖增強植株的抗旱脅迫能力 擴展生長是環(huán)境和植物內(nèi)部代謝活動相互作用的結(jié)果,在各種和植物有關(guān)的環(huán)境因素中,水的有效性占主導地位。不論是細胞分裂分化或體積擴大,都與水分吸收、溶質(zhì)積累和胞壁松弛有關(guān),任何能直接或間接影響三者之一的因素均能影響植物生長。缺水環(huán)境下,短期內(nèi)植物通過降低葉的生長速率和使老葉脫落等途徑來減少葉面積從而減少蒸騰失水,長期缺水則會引起根系生長速率降低、各莖間活動受抑、伸長遲緩、株高降低、稈變細等。干旱還會對植物的碳循環(huán)、氮代謝以及信息傳遞等物質(zhì)代謝過程造成不同程度的干擾破壞[14]。因此,提高植物遭受干旱逆境后的生存能力有助于減少作物的產(chǎn)量損失。
在實時熒光定量PCR檢測木薯海藻糖合成酶基因(MeTPS1-3)干旱脅迫下的表達試驗中[15],木薯遭受干旱脅迫時,其根部海藻糖合成酶基因上調(diào)表達最為明顯,說明木薯在受到抗干旱脅迫時海藻糖發(fā)揮了重要的調(diào)控作用。將該基因轉(zhuǎn)錄至本生煙草葉片中,并對該植株葉片進行海藻糖含量測定,發(fā)現(xiàn)MeTPS1-3基因已經(jīng)在受體植株中實現(xiàn)轉(zhuǎn)錄并開始表達合成海藻糖。抗旱性試驗證實,轉(zhuǎn)基因本生煙草株系在干旱脅迫下的保水能力和復水后的恢復能力增強,電解質(zhì)滲出率低于對照,種子萌發(fā)力強于對照,自然抗旱能力得到增強[16]。由此可見,海藻糖對于提升植物的抗旱能力具有十分重要的意義。
1.2.3 海藻糖提高植株耐高溫脅迫的抗性 高溫脅迫易破壞光合機構(gòu),降低光合能力,從而抑制光合作用并造成作物減產(chǎn)。在作物的生長季節(jié),溫度平均每提升1 ℃,作物產(chǎn)量將下降17%。生物體在熱脅迫條件下會產(chǎn)生熱激反應,對溫度的升高作出應答,具有一定的耐熱特性。但隨著脅迫程度的不斷增強,高溫會破壞葉綠體結(jié)構(gòu),降解葉綠素,降低CO2的溶解度,最終影響植物的光合速率;持續(xù)高溫更是直接影響了呼吸酶的活力,使其發(fā)生不可逆失活,抑制植物的呼吸作用;同時,當溫度升高到對植物造成脅迫時,葉片上的氣孔開度減小,蒸騰作用下降,降低植物對礦質(zhì)離子的運輸和對水分的需求。此外,高溫對植物的細胞膜系統(tǒng)、滲透壓和植物體內(nèi)的抗氧化系統(tǒng)也會產(chǎn)生不同程度的破壞[17]。因此,高溫脅迫是限制植物分布、生長和生產(chǎn)力的一個主要的環(huán)境脅迫因子。
在高溫脅迫下,植物細胞產(chǎn)生過量超氧陰離子( O-2 · ?)、過氧化氫(H2O2)等活性氧(ROS),這些成分會損傷細胞DNA、蛋白質(zhì)、脂膜等組分,引起脂質(zhì)過氧化[18-21]。研究發(fā)現(xiàn),適量濃度的活性氧在細胞中作為信號分子可以抵御疾病或者調(diào)控生理過程,如病原體防御、細胞程序性死亡。但當其濃度達到毒性水平后,如果不及時清除就會對機體造成氧化性損傷,卷柏復蘇過程中其抗氧化系統(tǒng)含量隨脫水上升、隨復水下降[22]正是應對活性氧的及時體現(xiàn)。海藻糖則可有效抵御這些氫氧自由基的傷害。試驗發(fā)現(xiàn),當海藻糖磷酸合成酶1基因(TPS1)在煙草和番茄中過表達后,植株明顯提高了氧脅迫下的耐受性。毫克分子級別的海藻糖含量就可以保護超氧化物歧化酶免遭熱激失活[23],這種保護機制能夠很好推廣在小麥作物等農(nóng)業(yè)生產(chǎn)中,提升農(nóng)作物抗高溫、抗氧脅迫的能力。
1.2.4 海藻糖提升植株的抗寒性 植物遭受零上低溫傷害,生理脫水引起生物膜脂從液晶相變?yōu)槟z相,使膜出現(xiàn)孔道和龜裂,膜的透性增大,膜內(nèi)電解質(zhì)及其他可溶性物質(zhì)大量外滲,細胞內(nèi)酶反應系統(tǒng)及物質(zhì)失去平衡,造成一系列代謝紊亂,從而引起組織嚴重損害或死亡。鄧如福等發(fā)現(xiàn),經(jīng)0.1%海藻糖處理植株2 d后,水稻幼苗在低溫下細胞內(nèi)電解質(zhì)滲漏率遠低于對照,游離于細胞質(zhì)內(nèi)的淀粉酶活性則遠高于對照,低溫傷害后修復也比對照快[24]。由此認為,水稻在低溫脫水時,海藻糖可能在細胞膜表面形成類似的水取代層結(jié)構(gòu),從而維持低溫脫水時細胞膜結(jié)構(gòu)的完整性,保護細胞內(nèi)酶反應系統(tǒng)及物質(zhì)平衡,使植物顯示出較強的抗寒性。
外源性海藻糖對植物在抗逆環(huán)境中的保護作用,應與其較高的玻璃態(tài)轉(zhuǎn)變溫度(Tg)和脂膜互作有關(guān)[25]。當植物個體和組織表面應對高溫或嚴寒環(huán)境時,海藻糖較小的自由體積、受限制的分子流動性、抵抗相互分離和結(jié)晶能力等固有特性使被其包圍的樣品避免發(fā)生結(jié)構(gòu)破壞、細胞脫水等各種不可逆性損害;當個體應對鹽堿地、洪澇、礦物質(zhì)缺乏等惡劣環(huán)境時,海藻糖固有的對稱性穩(wěn)定結(jié)構(gòu)幫助樣品穩(wěn)定組織內(nèi)外滲透壓,避免內(nèi)環(huán)境發(fā)生紊亂;當植物遭遇干旱等缺水環(huán)境時,海藻糖與脂膜的親水端互作共同保護細胞膜結(jié)構(gòu)完整,避免發(fā)生形變等機械性損害。
2 海藻糖作為冷凍劑提高動物細胞低溫凍存的存活率
精子的低溫保存是保障雄性動物生殖能力的一種重要技術(shù)手段。低溫凍存過程中會產(chǎn)生大量活性氧,這些物質(zhì)會破壞細胞膜結(jié)構(gòu)和能動性,對精子具有致命性破壞[26]。海藻糖具有穩(wěn)定脂膜、蛋白以及生物膜系統(tǒng)的特性,在精細胞低溫保存過程中海藻糖作為保護劑能夠減少胞內(nèi)冰晶的形成、維持蛋白結(jié)構(gòu),顯著提高精細胞的流動性、頂體和細胞膜的穩(wěn)定性,減少精細胞畸變或者病變[27]。因此,在冷凍保護劑中添加抗氧化劑有助于保護精細胞免受活性氧迫害,提高精細胞復蘇存活率。目前,海藻糖已被加入到兔子、公羊、野豬、山羊、公牛[26,28-31]等各種哺乳動物精細胞的低溫凍存保護中,用于提高生殖細胞復蘇的成活率。
除了生殖細胞,海藻糖也會用于原生生物以及其他細胞的低溫保護中[32]。研究結(jié)果表明,海藻糖存在于所有生命體內(nèi)[2,33],是一種應急代謝產(chǎn)物,在細胞處于高溫、冷凍、輻射、干燥、高滲透壓等不良環(huán)境時會在胞內(nèi)大量合成,危機解除后可作為能源物質(zhì)迅速分解。因此,保護性成為海藻糖除作為甜味劑使用外的最主要功能,它可長效維持生物膜、蛋白質(zhì)等各種生物組織和生物大分子的穩(wěn)定性[6]。有關(guān)海藻糖對動物細胞保護作用機制的研究主要體現(xiàn)在以下兩大類:一是玻璃化的海藻糖因其黏性特點抑制脂膜分子動能產(chǎn)生、防止脂膜分子運動,維護生物膜系統(tǒng)的完整性[34-35];二是一定濃度的海藻糖與脂質(zhì)特異性結(jié)合,保護脂質(zhì)體在冷凍干燥環(huán)境中不發(fā)生有害相變,維持生物膜通透性與穩(wěn)態(tài)[36-37]。經(jīng)過多年的反復研究,科學家們發(fā)現(xiàn),玻璃態(tài)的海藻糖并不能改變脂膜脫水時的相變溫度且高濃度保護劑極易產(chǎn)生細胞毒性[38],同時認定只有抑制膜脂相變、保證細胞膜的選擇透過性才是海藻糖發(fā)揮保護功能的主要因素。
至于糖類小分子如何發(fā)揮保護作用避免生物膜系統(tǒng)發(fā)生相變,科學家又相繼提出了水替代假說、優(yōu)先排阻假說和水合力作用等三大學說[39]。在水替代假說中,假定生命體處于干燥缺水環(huán)境,細胞膜完全失水。原先與磷脂極性頭部結(jié)合的水分子被糖分子替代,使親水性的頭部基團與糖分子發(fā)生互作維持原有的膜脂形態(tài)[40-42]。如在有側(cè)向壓力(大小為 0.1~25 MPa)、海藻糖濃度為2 mol/L時[43],或者在增大單分子膜層表面張力[44]等條件下,部分海藻糖分子可置換出通過氫鍵與脂膜親水基團相連的水分子,進而將自身與脂膜極性頭部特異性結(jié)合,維持脂膜水合狀態(tài)來防止脂膜相變。但在以上相關(guān)所描述的試驗中,沒有試驗是在完全失水條件下完成且單分子膜型不足以代表真實生物膜系統(tǒng)中的多層膜結(jié)構(gòu)構(gòu)造;同時,試驗結(jié)論也局限于一些推斷或可能性原因,這些推測性結(jié)論難以讓人完全信服。優(yōu)先排阻假說通常用來解釋海藻糖與蛋白質(zhì)大分子之間的互作關(guān)系,該學說通過分子動力學模擬試驗證實了蛋白質(zhì)更易于與水分子結(jié)合,海藻糖用于穩(wěn)定天然態(tài)的蛋白質(zhì)結(jié)構(gòu),避免其化學勢升高發(fā)生變性[45]。但此類模擬試驗構(gòu)建的三肽分子與實際溶液中的蛋白質(zhì)結(jié)構(gòu)差別較大,且生物膜的主要成分為磷脂雙分子層而非蛋白分子,因而該學說無法有力支持海藻糖的膜保護機制。另外一種解釋——水合作用力,是目前最有說服力的作用機制研究理論:當脂膜親水面的水分子發(fā)生波動時,兩性分子聚合物會自然地產(chǎn)生張力去黏結(jié)水分子,成百上千的水分子被嵌入到雙分子層的極性表面,科學家稱這種張力為水合力。這種位于多層脂膜間的水合力作用范圍長達20或更遠,主要用來阻止不同脂膜間因彼此過分靠近而發(fā)生交叉識別。在脫水狀態(tài)下,不斷增大的水合力會加大脂雙層內(nèi)部的橫向壓力,導致相鄰的脂分子相互靠近,使液態(tài)的磷脂雙分子層變?yōu)槟z態(tài)。此時位于膜系統(tǒng)之間的糖分子(糖環(huán) ∶ 脂=1 ∶ 1),憑借其非特異性的滲透效應和體積結(jié)構(gòu),可有效減小膜脂間水合力的大小以及膜脂受壓產(chǎn)生的抗壓應力,進而降低膜發(fā)生相變所需的轉(zhuǎn)變溫度,盡可能維持液相脂膜間距,以此達到保護生物膜的目的[46]。因此,水合力作用認為,一定濃度下,海藻糖能夠?qū)Ρ鶅錾锲鸬接行ПWo作用,這種保護主要來源于海藻糖非特異性的滲透壓和體積效應,它與脂膜的親水端結(jié)合以替代水分子的關(guān)系并不大。
有關(guān)海藻糖對蛋白質(zhì)等生物大分子或與脂膜互作的凍存保護機制的研究通常需借助電子顯微鏡、X射線衍射技術(shù)以及電子順磁共振等設備對低溫下的脂膜和小分子糖的分子運動軌跡進行觀察,評估和計算相應的動力學參數(shù)以分析它們的運動軌跡和變化[47],進而闡釋其可能的保護機制。近期動力學研究發(fā)現(xiàn),在海藻糖水溶液中,蛋白分子周圍的水分子數(shù)量明顯減少,海藻糖環(huán)繞成籠狀結(jié)構(gòu),使陷入其中的水分子移動速率降低,避免蛋白結(jié)構(gòu)在降溫過程中發(fā)生結(jié)晶等形態(tài)變化[48],從而起到冷凍保護效應。這種新的保護機制再次否定了優(yōu)先排阻假說。
3 結(jié)論與展望
植物海藻糖信號途徑被認為是連接代謝與生長發(fā)育信號網(wǎng)絡的中樞,它通過介導植物內(nèi)部與外部信號來調(diào)控植物的生長發(fā)育進程,其前體物質(zhì)T6P信號調(diào)節(jié)途徑直接參與多種植物生理活動,逐步闡明T6P信號調(diào)節(jié)方式、分子機制與植物信號響應等,可以更清晰地了解植物對逆境的多種適應性。
近年來,土壤鹽漬度升高成為農(nóng)業(yè)種植方面的主要威脅,海藻糖在植物遭受鹽脅迫時起到很好的保護作用。低濃度海藻糖可減少鈉離子在細胞中的積累,高濃度時則能預防由氯化鈉引起的葉綠素缺失、保護植物根部的完整性[49-51]。當植株受到鹽脅迫時,海藻糖酶表達量降低,使得機體內(nèi)海藻糖不斷積累,發(fā)揮雙糖具有的保護性來抵抗高鹽腐蝕。
耐旱類植物體內(nèi)通常儲存大量的海藻糖,這類植物可以暫停新陳代謝幾年之久,直至遇到水源。在代謝停滯期間,海藻糖用于保護細胞膜、蛋白質(zhì)以及其他細胞成分[52]。但在農(nóng)作物中,海藻糖的含量卻少之又少,幾乎檢測不到濃度變化或者差異。因此,通過轉(zhuǎn)基因技術(shù)外源添加海藻糖[53]或者借助海藻糖合成酶生物合成海藻糖[54]以提高植物抗逆性是目前較為有效的植物保護方式。研究人員培育出的轉(zhuǎn)基因水稻,能有效抵御干旱、寒冷和多鹽,且產(chǎn)量高、產(chǎn)值高[55]。王彬等通過RNA干擾技術(shù),利用葉盤侵染法將帶有擬南芥海藻糖酶基因干擾載體(iTre-1285)的農(nóng)桿菌導入花煙草中,成功干擾海藻糖酶基因的表達,抑制了花煙草中海藻糖酶的活性,以此來減少海藻糖的降解,從而增加內(nèi)源海藻糖含量,提高轉(zhuǎn)基因植株的抗脅迫能力,有效地保護農(nóng)作物抵抗環(huán)境災害,提高作物產(chǎn)量[56]。這些應用對種植業(yè)尤其在應對北方寒冷干燥氣候?qū)r(nóng)作物的影響,具有顯著的經(jīng)濟效益。
在植物應對溫度壓力時,其內(nèi)生性海藻糖在發(fā)生新陳代謝過程中會產(chǎn)生不同形式的變化,植物也相應被引發(fā)復雜的生理生化反應,如轉(zhuǎn)錄因子和蛋白分子表達量的增減、代謝物糖類和脂質(zhì)以及次級代謝物含量的改變、膜結(jié)構(gòu)和組成上的改變等。此時海藻糖會與其他溶質(zhì)分子相互結(jié)合共同抵抗嚴寒或高溫環(huán)境。蛋白組數(shù)據(jù)分析顯示,高溫時海藻糖磷酸合成酶5(TPS5)和轉(zhuǎn)錄輔激活子MBF1c蛋白發(fā)生互作反應,MBF1c蛋白是植物抵抗高溫的關(guān)鍵調(diào)控因子,TPS5缺失則會導致植物對高溫敏感。而在低溫環(huán)境中,AtTPPA基因的高表達又會引發(fā)海藻糖、海藻糖-6-磷酸含量的增加[4,57]。由此可見,海藻糖在植物應對極寒或高溫氣候時會參與到植物的新陳代謝和各種理化反應中,幫助植物應對極端溫度。
海藻糖作為保護劑參與動植物細胞或組織的低溫保存過程已廣為人知,但因其是雙糖分子結(jié)構(gòu),不能快速擴散、任意進出細胞而未能取代二甲基亞砜或甘油作為獨立保護劑單獨使用。目前,借助高分子材料等載體或電穿孔技術(shù)介導海藻糖穿過細胞膜[58-60],使其均勻分布于細胞內(nèi)外已成為現(xiàn)階段研究較為關(guān)注的保護劑應用領(lǐng)域,攻克該項難題不僅能減小海藻糖凍存液對細胞造成的滲透壓、提升細胞凍存復蘇的存活率,更能有效解決醫(yī)藥、生態(tài)養(yǎng)殖、食品加工等行業(yè)中的運輸和保藏問題,有望實現(xiàn)海藻糖取代二甲基亞砜作為一種獨立的新型無毒保護劑應用于細胞、組織、酶制劑保護等凍存行業(yè)[61-62]。有關(guān)海藻糖對高等植物、脊椎動物、工業(yè)酶制劑在代謝調(diào)節(jié)、抗逆、抗病原體、毒性大小、凍存保護等相關(guān)性質(zhì)與功能的研究依然在繼續(xù)[33,63],不斷深入探究海藻糖在動植物保護過程中的作用機制對其在凍存保護劑產(chǎn)業(yè)的開發(fā)、應用、推廣等領(lǐng)域都將產(chǎn)生重要現(xiàn)實意義。
參考文獻:
[1]姚 林.Pseudomonas putida S1海藻糖合成酶基因在大腸桿菌中的表達及其條件研究[D]. 無錫:江南大學,2008.
[2]Feofilova E P,Usov A I,Mysyakina I S,et al. Trehalose:chemical structure,biological functions,and practical application[J]. Microbiology,2014,83(3):184-194.
[3]Park M,Mitchell W J,Rafii F. Effect of trehalose and trehalose transport on the tolerance of Clostridium perfringens to environmental stress in a wild type strain and its Fluoroquinolone-Resistant mutant[J]. International Journal of Microbiology,2016,48:29716.
[4]Lunn J E,Delorge I,F(xiàn)igueroa C M,et al. Trehalose metabolism in plants[J]. Plant Journal,2014,79(4):544-567.
[5]Tian T,Zhao G,Han D,et al. Effects of vitrification cryopreservation on follicular morphology and stress relaxation behaviors of human ovarian tissues:sucrose versus trehalose as the non-permeable protective agent[J]. Human Reproduction,2015,30(4):877-883.
[6]Malferrari M,Savitsky A,Lubitz W,et al. Protein immobilization capabilities of sucrose and trehalose glasses:the effect of protein/sugar concentration unraveled by High-Field EPR[J]. The Journal of Physical Chemistry Letters,2016,7(23):4871-4877.
[7]王 羽,云雪艷,張曉燕,等. 海藻糖對蛋白質(zhì)的抗逆保護及其在食品領(lǐng)域中的應用[J]. 食品科技,2015(10):229-232.
[8]陳素麗,彭 瑜,周 華,等. 植物海藻糖代謝及海藻糖-6-磷酸信號研究進展[J]. 植物生理學報,2014,50(3):233-242.
[9]Fernandez O,Vandesteene L,F(xiàn)eil R,et al. Trehalose metabolism is activated upon chilling in grapevine and might participate in Burkholderia phytofirmans induced chilling tolerance[J]. Planta,2012,236(2):355-369.
[10]張 雯,王宇斐,郭延平. 高等植物6-磷酸海藻糖信號調(diào)控研究進展[J]. 植物生理學報,2016,52(4):394-400.
[11]王 迪,羅 音,高亞敏,等. 外施海藻糖對高溫脅迫下小麥幼苗膜脂過氧化的影響[J]. 麥類作物學報,2016,36(7):925-932.
[12]李 彥,張英鵬,孫 明,等. 鹽分脅迫對植物的影響及植物耐鹽機理研究進展[J]. 中國農(nóng)學通報,2008,24(1):258-265.
[13]閆道良,鄭炳松. 海藻糖浸種對鹽脅迫下?lián)P麥19生理特性的影響[J]. 浙江農(nóng)業(yè)學報,2016,28(8):1271-1276.
[14]孫梅霞,祖朝龍,徐經(jīng)年. 干旱對植物影響的研究進展[J]. 安徽農(nóng)業(yè)科學,2004,32(2):365-367,384.
[15]張 丹,付莉莉,彭 明,等. 實時熒光定量PCR檢測木薯海藻糖合成酶基因(MeTPS1-3)干旱脅迫下的表達[J]. 熱帶作物學報,2013,34(7):1274-1277.
[16]陳 強. 木薯海藻糖合成酶基因的表達及抗旱功能研究[D]. 海口:海南大學,2014:38-41.
[17]屠小菊,汪啟明,饒力群. 高溫脅迫對植物生理生化的影響[J]. 湖南農(nóng)業(yè)科學,2013(13):28-30.
[18]Wahid A,Gelani S,Ashraf M,et al. Heat tolerance in plants:an overview[J]. Environmental and Experimental Botany,2007,61(3):199-223.
[19]Madan S Y,Reena B R,Munjal R. Trehalose mitigates heat stress-induced damages in wheat seedlings[J]. Journal of Wheat Research,2015,7(1):74-78.
[20]王 迪. 外源海藻糖在高溫脅迫下保護光系統(tǒng)II的結(jié)構(gòu)和功能[D]. 上海:華東師范大學,2016:34-35.
[21]Gill S S,Tuteja N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry,2010,48(12):909-930.
[22]李紅芳,谷 巍,席彩彩,等. 卷柏復蘇過程中抗氧化系統(tǒng)響應機制及海藻糖含量變化[J]. 植物生理學報,2016,52(12):1872-1876.
[23]Luo Y,Li W M,Wang W. Trehalose:protector of antioxidant enzymes or reactive oxygen species scavenger under heat stress[J]. Environmental and Experimental Botany,2008,63(1/2/3):378-384.
[24]鄧如福,裴 炎,王瑜寧,等. 海藻糖對水稻幼苗抗寒性研究[J]. 西南農(nóng)業(yè)大學學報,1991,13(3):347-349.
[25]符 雪,王凌峰,陳 吉,等. 海藻糖在低溫保存組織中的應用研究現(xiàn)狀[J]. 中國醫(yī)療前沿,2013,8(14):12-13.
[26]Zhu Z,F(xiàn)an X,Pan Y,et al. Trehalose improves rabbit sperm quality during cryopreservation[J]. Cryobiology,2017,75:45-51.
[27]Wang Y,Dong S. Glutathione in combination with trehalose has supplementary beneficial effects on cryopreserved red deer (Cervus elaphus) sperm[J]. American Journal of Reproductive Immunology,2017,77(1):e12610.
[28]Aisen E G,Medina V H,Venturino A. Cryopreservation and post-thawed fertility of ram semen frozen in different trehalose concentrations[J]. Theriogenology,2002,57(7):1801-1808.
[29]Gómez-Fernández J,Gómez-Izquierdo E,Tomás C,et al. Effect of different monosaccharides and disaccharides on boar sperm quality after cryopreservation[J]. Animal Reproduction Science,2012,133(1/2):109-116.
[30]Aboagla E M,Terada T. Trehalose-enhanced fluidity of the goat sperm membrane and its protection during freezing[J]. Biology of Reproduction,2003,69(4):1245-1250.
[31]Tuncer P B,Sarlzkan S,Bucak M N,et al. Effect of glutamine and sugars after bull spermatozoa cryopreservation[J]. Theriogenology,2011,75(8):1459-1465.
[32]Wen Y Z,Su B X,Lyu S S,et al. Trehalose,an easy,safe and efficient cryoprotectant for the parasitic protozoan Trypanosoma brucei[J]. Acta Tropica,2016,164:297-302.
[33]Argüelles J C. Why cant vertebrates synthesize trehalose?[J]. Journal of Molecular Evolution,2014,79(3/4):111-116.
[34]Koster K L,Lei Y P,Anderson M,et al. Effects of vitrified and nonvitrified sugars on phosphatidylcholine fluid-to-gel phase transitions[J]. Biophysical Journal,2000,78(4):1932-1946.
[35]Koster K L,Webb M S,Bryant G,et al. Interactions between soluble sugars and POPC (1-palmitoyl-2-oleoylphosphatidylcholine) during dehydration:vitrification of sugars alters the phase behavior of the phospholipid[J]. Biochimica et Biophysica Acta,1994,1193(1):143-150.
[36]Crowe J H,Crowe L M,Chapman D. Preservation of membranes in anhydrobiotic organisms:the role of trehalose[J]. Science,1984,223(4637):701-703.
[37]Crowe L M,Crowe J H,Rudolph A,et al. Preservation of freeze-dried liposomes by trehalose[J]. Archives of Biochemistry and Biophysics,1985,242(1):240-247.
[38]Crowe J H,Hoekstra F A,Nguyen K H,et al. Is vitrification involved in depression of the phase transition temperature in dry phospholipids?[J]. Biochimica et Biophysica Acta,1996,1280(2):187-196.
[39]Kent B,Hunt T,Darwish T A,et al. Localization of trehalose in partially hydrated DOPC bilayers:insights into cryoprotective mechanisms[J]. Journal of the Royal Society Interface,2014,11(95):20140069.
[40]Crowe J H,Hoekstra F A,Crowe L M. Anhydrobiosis[J]. Annual Review of Physiology,1992,54:579-599.
[41]Sun W Q,Leopold A C,Crowe L M,et al. Stability of dry liposomes in sugar glasses[J]. Biophysical Journal,1996,70(4):1769-1776.
[42]Crowe J H,Crowe L M,Oliver A E,et al. The trehalose myth revisited:introduction to a symposium on stabilization of cells in the dry state[J]. Cryobiology,2001,43(2):89-105.
[43]Pereira C S,Hünenberger P H. Effect of trehalose on a phospholipid membrane under mechanical stress[J]. Biophysical Journal,2008,95(8):3525-3534.
[44]Lambruschini C,Relini A,Ridi A,et al. Trehalose interacts with phospholipid polar heads in Langmuir monolayers[J]. Langmuir,2000,16(12):5467-5470.
[45]白 姝,常 穎,劉小娟,等. 海藻糖和氨基酸之間相互作用的分子動力學模擬[J]. 物理化學學報,2014,30(7):1239-1246.
[46]Lenné T,Garvey C J,Koster K L,et al. Effects of sugars on lipid bilayers during dehydration-SAXS/WAXS measurements and quantitative model[J]. Journal of Physical Chemistry B,2009,113(8):2486-2491.
[47]Konov K B,Isaev N P,Dzuba S A. Low-temperature molecular motions in lipid bilayers in the presence of sugars:insights into cryoprotective mechanisms[J]. Journal of Physical Chemistry B,2014,118(43):12478-12485.
[48]Corradini D,Strekalova E G,Stanley H E,et al. Microscopic mechanism of protein cryopreservation in an aqueous solution with trehalose[J]. Scientific Reports,2013,3(2):1218.
[49]Garcia A B,Engler J,Iyer S,et al. Effects of osmoprotectants upon NaCl stress in rice[J]. Plant Physiology,1997,115(1):159-169.
[50]López M,Herrera-Cervera J A,Iribarne C,et al. Growth and nitrogen fixation in Lotus japonicus and Medicago truncatula under NaCl stress:nodule carbon metabolism[J]. Journal of Plant Physiology,2008,165(6):641-650.
[51]López M,Tejera N A,Iribarne C,et al. Trehalose and trehalase in root nodules of Medicago truncatula and Phaseolus vulgaris in response to salt stress[J]. Physiologia Plantarum,2008,134(4):575-582.
[52]El-Bashiti T,Hamamci H,Oktem H A,et al. Biochemical analysis of trehalose and its metabolizing enzymes in wheat under abiotic stress conditions[J]. Plant Science,2005,169(1):47-54.
[53]Jang I C,Oh S J,Seo J S,et al. Expression of a bifunctional fusion of the Escherichia coli genes for trehalose-6-phosphate synthase and trehalose-6-phosphate phosphatase in transgenic rice plants increases trehalose accumulation and abiotic stress tolerance without stunting growth[J]. Plant Physiology,2003,131(2):516-524.
[54]Delorge I,Janiak M,Carpentier S,et al. Fine tuning of trehalose biosynthesis and hydrolysis as novel tools for the generation of abiotic stress tolerant plants[J]. Frontiers in Plant Science,2014,5(7):147.
[55]Li H W,Zang B S,Deng X W,et al. Overexpression of the trehalose-6-phosphate synthase gene OsTPS1 enhances abiotic stress tolerance in rice[J]. Planta,2011,234(5):1007-1018.
[56]王 彬,周 靖,趙文博,等. 海藻糖酶基因RNA干擾載體對花煙草的轉(zhuǎn)化[J]. 中國農(nóng)學通報,2014,30(15):282-285.
[57]Suzuki N,Bajad S,Shuman J,et al. The transcriptional co-activator MBF1c is a key regulator of thermotolerance in Arabidopsis thaliana[J]. Journal of Biological Chemistry,2008,283(14):9269-9275.
[58]Mercado S A,Slater N K. Increased cryosurvival of osteosarcoma cells using an amphipathic pH-responsive polymer for trehalose uptake[J]. Cryobiology,2016,73(2):175-180.
[59]Dovgan B,Barli cˇ A,Kneevi c′ M,et al. Cryopreservation of human Adipose-Derived stem cells in combination with trehalose and reversible electroporation[J]. The Journal of Membrane Biology,2017,250(1):1-9.
[60]Uchida T,F(xiàn)urukawa M,Kikawada T,et al. Intracellular trehalose via transporter TRET1 as a method to cryoprotect CHO-K1 cells[J]. Cryobiology,2017,77(17):50-57.
[61]Du T,Chao L,Zhao S,et al. Successful cryopreservation of whole sheep ovary by using DMSO-free cryoprotectant[J]. Journal of Assisted Reproduction and Genetics,2015,32(8):1267-1275.
[62]蒙健宗,高秀巖,馬少敏,等. 海藻糖對纖維素酶的干燥保護作用[J]. 食品工業(yè)科技,2005,26(12):164-166.
[63]Fernandez O,Béthencourt L,Quero A,et al. Trehalose and plant stress responses:friend or foe[J]. Trends in Plant Science,2010,15(7):409-417.

