鋁熱還原鈦氧化物直接合金化機理研究
尚德禮
(鞍鋼集團鋼鐵研究院海洋裝備用金屬材料及其應用國家重點實驗室,遼寧 鞍山114009)
鋼的直接合金化就是指用含有合金元素的氧化物作為合金化劑,煉鋼過程直接將含有合金元素的氧化物加入鋼液,通過合金化劑配加的還原劑,或用鋼液中已存在的脫氧元素將合金元素還原出來,達到合金化的目的。傳統上冶煉含鈦鋼時主要采用添加鈦鐵的方式進行合金化,主要原因是鈦鐵在鋼液中的溶解速度較快,同時具有較高的收得率。但是制備鈦鐵需要消耗大量的能源,且造成環境污染,因此鈦鐵合金化成本較高。由于鈦氧化物較鈦鐵在價格上存在優勢,有學者就鈦氧化物直接合金化的可行性進行了熱力學分析[1],但并沒有進行深入研究,僅就反應速度進行動力學分析,直接合金化的具體形式也并未提及;加之鈦氧化物穩定性較強,不易被還原,且還原出的金屬鈦又易被氧化,在反應機理不甚明確的條件下,簡單的工業應用難度較大,因此鮮有該方面的應用報道。隨著用戶對含鈦鋼需求的增大,考慮到節能環保及成本問題,用鈦氧化物直接合金化技術來替代采用鈦鐵合金化技術是必要的。本文以TiO2和金屬鋁為直接合金化劑原料,分析了鈦氧化物直接合金化可行性機理,并對影響條件行了探討。
1 還原鈦氧化物的熱力學機制
鋁熱還原鈦氧化物的體系中,鈦元素可能出現的化合價有0、+2、+3、+4價,對應四種價態的純凈物存在方式為:金屬鈦、TiO、Ti2O3以及TiO2。鋁還原鈦氧化物過程可能出現的相關關鍵熱力學方程如下[2]:

將以上各式的標準吉布斯能與溫度的關系制成曲線,圖1為鋁還原氧化鈦的標準吉布斯能變化情況。
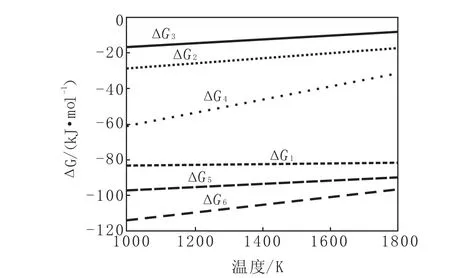
圖1 鋁還原氧化鈦的標準吉布斯能變化情況
由圖1看出,用鋁作還原劑時,在煉鋼溫度條件下,鋁均能將鈦礦中的TiO2還原成金屬鈦,進而可對鋼液進行鈦合金化。該體系中所有反應都是具備自發傾向的反應,但隨著溫度的升高,其自由能也隨之增高,所以溫度升高不利于反應的進行,降低溫度有利于提高金屬鈦的收得率。因此在直接合金化時,控制鋼液溫度,不僅有利于提高鈦收得率,還可以防止因鋼液溫度過高而導致的耐材損毀、鋼液二次氧化等問題。
2 還原鈦氧化物的動力學變化機制
從熱力學分析可知,在煉鋼溫度條件下鋁完全可以還原TiO2實現鈦直接合金化,因此在平衡態時鋁可以還原鈦氧化物。但是煉鋼時,合金化過程時間不允許過長,否則會引起一系列問題,如連鑄斷澆、鋼水溫降過大等。由于動力學條件等制約,鋁能否還原鈦氧化物或還原率水平是多少還需通過理論驗證。
首先了解TiO2+4/3Al=Ti+2/3Al2O3反應的宏觀過程,鋁還原TiO2反應示意圖如圖2所示。
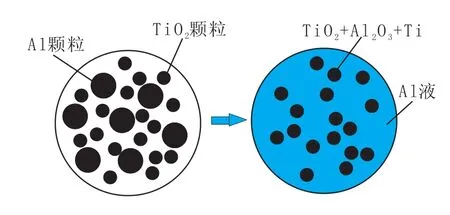
圖2 鋁還原TiO2反應示意圖
反應過程如下:
(1)細鋁粉與細小的TiO2均勻混合組成均勻混合物;
(2)混合物加入鋼液后,隨著溫度升高到大于鋁的熔點(660.4℃),混合物中的鋁顆粒開始熔化,鋁液擴散到TiO2顆粒表面;
(3)鋁液與TiO2表面發生化學反應,生成了Ti和Al2O3,該反應微觀過程可采用未反應核模型理論描述。
圖3為TiO2與Al反應的未反應核模型。用該模型可計算鋁還原氧化鈦的這一多相反應的速度。模型假定氧化鈦為致密的球體,反應TiO2+4/3Al=Ti+2/3Al2O3只發生在產物層與未反應核的界面上,而且已達到反應平衡。總的反應速度受鋁液與氧化鈦之間的外擴散,鋁在反應產物層中的內擴散和界面化學反應控制,速率方程[3]為:
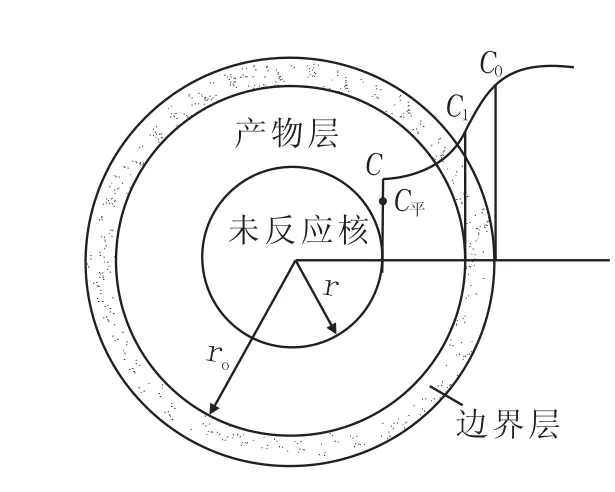
圖3 TiO2與Al反應的未反應核模型

式中,J為速率;De為擴散系數;ro為初始TiO2球體半徑;r為反應后TiO2球體半徑;C1為球體外表面的濃度;C為反應界面上的濃度;k為反應的速率常數;K為反應的平衡常數;C平為反應的平衡濃度;Co為初始濃度;β為外擴散的傳質系數。
代入 r=ro(1-R)1/3,則式(10)變為:
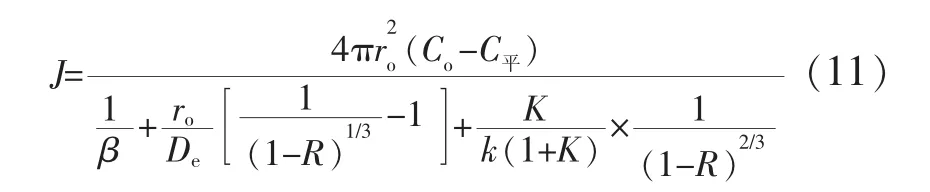
式中,R為氧化鈦的還原率,即氧化鈦顆粒質量去除氧量后與原顆粒質量之比,%。
據未反應核的質量衡算可得:
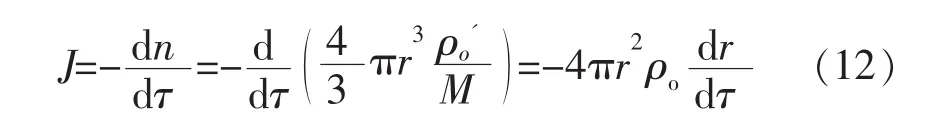
式中,n為氧化鈦摩爾量;τ為時間;ρo為氧化鈦中的氧密度,kg/m3;為氧化鈦中的氧密度,mol/m3,而為氧的摩爾質量,再帶入r=ro(1-R)1/3,則(12)式變為:

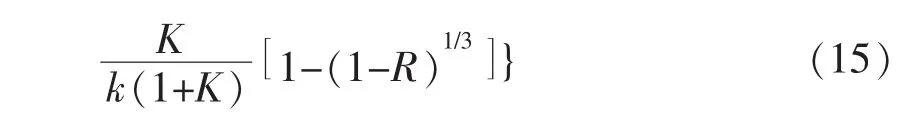
由于鋁的還原性高于鈦,因此界面反應速度較快,另外鋁在邊界層的外擴散速度要遠高于鋁在致密的還原產物(氧化鋁)中的擴散速度,即De<<k,De<<β。則整個反應過程由還原層的內擴散所控制。而式(15)可簡化為:

根據 TiO2密度(4.26 g/cm3)可計算出 ρo,Al在產物層中的有效擴散系數De取決于產物層的致密度。1 500℃時,Al在 CaO44%-Al2O312%-SiO244%三元渣中的擴散系數為 7×10-7cm2/s[4],Al在固相產物層中的擴散系數肯定小于此值。但Al在固態致密的鋼中擴散系數可達到1×10-8cm2/s[5],Al在固相產物層中的擴散系數肯定又大于此值。 假定 De=0.7×10-7cm2/s、C平=0,按式(16)計算,使 10 μm 的 TiO2全部轉變成 Al2O3的時間僅為1.27 s。也就是在鋁粉和氧化鈦粉混合物加入鋼液瞬間,鈦就會被鋁還原。實際應用中,可采用粒徑為10 μm的鈦氧化物細粉為原料制備合金化劑,也可以通過增加或減少鈦氧化物細粉粒徑調整反應速度。
鋁粉和氧化鈦粉混合物加入鋼液后,反應瞬間完成,由于金屬鈦密度為4.54 g/cm3,氧化鈦密度為 4.26 g/cm3,金屬鋁密度為 2.7 g/cm3,氧化鋁密度為3.97 g/cm3,顯然金屬鈦的密度最大,因此還原反應發生后,被還原出的金屬鈦會下沉到混合物的底部,即金屬鈦可以直接與鋼液接觸,顯著增強了合金化效果。
鈦氧化物直接合金化的效果還取決于鋼液的條件及熔渣狀況。由于直接合金化劑反應速度極快,因此在實際生產中,直接合金化劑的加入時機可參照鈦鐵合金合金化時機,必須滿足如下條件:精煉鋼水快要結束前,鋼水氧含量小于0.002 5%,鋼水中的Al控制在0.025%以上,這時加入直接合金化劑可保證提高并穩定鈦的回收率。直接合金化時,鋼水溫度的控制應低于鈦鐵合金化時的鋼水溫度,一方面防止鋼水溫度過高加速金屬鈦氧化,另一方面鋼水溫度過高不利于還原反應進行。鋼包渣氧化性及堿度也應嚴格控制,生產實踐表明,隨著鋼包渣氧化性的增加,鈦收得率呈明顯下降趨勢;同時鋼包渣中SiO2含量的增加也將導致鈦收得率降低(鋼渣存在Ti+SiO2=TiO2+Si的反應)。因此,要保證鈦有較高的收得率,渣中(FeO+MnO)含量控制在5%以下,同時減少轉爐下渣量,防止渣中SiO2含量增加,渣中SiO2含量應控制在10%以下。
3 結論
(1)熱力學分析表明,在煉鋼條件下,鋁完全可以還原TiO2,被還原出的金屬鈦可對鋼液實現鈦直接合金化,該過程不僅降低鈦鐵消耗成本,還避免了制備鈦鐵造成的環境污染問題。
(2)動力學變化機制表明,粒徑為10 μm的TiO2全部轉變成Al2O3的時間小于1.27 s,鋁粉和氧化鈦粉混合物加入鋼液瞬間氧化鈦就會被鋁還原,從而實現鈦直接合金化。由于反應在瞬間完成,對整個冶煉體系環節不會造成不良后果。
(3)鋁粉和氧化鈦粉混合物加入鋼液后,反應瞬間完成,由于金屬鈦密度分別大于氧化鈦密度、金屬鋁密度和氧化鋁密度,因此還原反應發生后金屬鈦會下沉到混合物的底部,即金屬鈦可以直接和鋼液接觸,顯著增強了合金化效果。

