茉莉酸甲酯處理對獼猴桃軟腐病菌作用機制及果實品質的影響
黎曉茜,龍友華,2,*,尹顯慧,2,吳小毛,2,趙志博,樊 榮,莫飛旭,蔣艷玲,黃亞欣,唐靖文
(1.貴州大學農學院,貴州 貴陽 550025;2.貴州大學作物保護研究所,貴州 貴陽 550025;3.修文縣獼猴桃產業發展局,貴州 貴陽 550200)
獼猴桃為獼猴桃科(Actinidiaceae)獼猴桃屬(Actinidia)植物的漿果果實,富含VC、多種礦物、氨基酸等營養物質,是三大新興水果之一[1-3]。近年來,獼猴桃軟腐病發生較為嚴重,造成采前落果、貯藏期果實腐爛率升高,嚴重影響獼猴桃果實品質及市場銷售[4]。獼猴桃軟腐病主要由葡萄座腔菌(Botryosphaeria dothidea)、擬莖點霉菌(Phomopsis sp.)等真菌單獨或復合侵染引起[4-6];周游[7]研究發現B. dothidea、可可毛色二孢(Lasiodiplodia theobroma)和小新殼梭孢(Neofusicoccum parvum)可引起獼猴桃軟腐;Lee[8]、Thomidis[9]等研究表明間座殼屬(Diaporthe sp.)真菌亦能引起獼猴桃軟腐病。目前獼猴桃軟腐病的防治研究以化學防治和生防菌株篩選為主[10-12],長期施用化學農藥容易使真菌產生抗藥性,破壞生態環境安全及影響農產品質量安全;生防菌株對貯藏期果實防治效果較好,但田間施用限制因素較多,防控效果往往不穩定;因此,迫切需要開發利用綠色、安全、高效的植物源藥劑防控獼猴桃軟腐病[13]。
茉莉酸甲酯(methyl jasmonate,MeJA)作為植物體內的一種天然化學物質,可調節植物的生長發育,誘導植物防御性基因表達[14-16]。目前MeJA已廣泛應用于蘋果[17]、梨[18]、桃[19]、芒果[20]、辣椒[21]、番茄[22]、小麥[23]等農林經濟作物的病害防控,也能有效地控制一些果蔬的釆后真菌性病害[24-25],改善果實品質[26]。MeJA可誘導寄主植物產生一系列防御反應,例如誘導病害防御基因的表達,誘導幾丁質酶、β-1,3-葡聚糖酶等植物防御酶活力的提高,以及植保素的合成等[27-32]。還有研究表明,MeJA可以提高果實中的蛋白質和糖含量[33-34]。但目前尚不清楚MeJA能否有效防控獼猴桃軟腐病、是否影響獼猴桃果實產量和品質。
本研究利用不同濃度的MeJA處理獼猴桃軟腐病致病菌葡萄座腔菌,通過檢測菌絲的電導率、蛋白質和核酸外滲、細胞壁主要酶活力以及細胞結構變化等方面,探究MeJA對獼猴桃軟腐病菌的抑制活性及相關機制;使用0.50 mmol/L MeJA處理不同生長期的獼猴桃果實,探究MeJA對獼猴桃軟腐病防控效果及其對果實品質的影響,以期為葡萄座腔菌引起的獼猴桃軟腐病的綠色防控提供參考。
1 材料與方法
1.1 材料與試劑
B. dothidea菌種由貴州大學農產品質量安全實驗室提供。
以選取種植于貴州省修文縣久長鎮和小菁鄉實驗基地的‘貴長’獼猴桃為供試品種,樹齡4 年,‘T’型架栽培,樹勢整齊一致,除實驗處理的差異外,其他農事操作、管理水平均一致,在果實采收期,選擇晴朗天氣時集中采收。
MeJA(純度≥95%)、N-乙酰-D-氨基葡萄糖、Tris-HCl緩沖液(pH 7.5)、醋酸鈉緩沖液(pH 5.0)、昆布多糖 北京索萊寶科技有限公司;質量分數0.3%四霉素水劑 遼寧微科生物有限公司;幾丁質粉上海生工生物工程有限公司;二甲胺基甲硼烷(dimethylaminoborane,DMAB) 上海百舜生物科技有限公司;3,5-二硝基水楊酸(3,5-dinitrosalicylic acid,DNS) 國藥集團化學試劑有限公司。
1.2 儀器與設備
SW-CJ-1BU型潔凈工作臺 蘇州安泰空氣技術有限公司;生物顯微鏡 寧波舜宇儀器有限公司;DDSJ-319L型電導率儀 上海儀電科學儀器股份有限公司;T6新世紀紫外-可見分光光度計 北京普析通用儀器有限公司;GY-4數顯式果實硬度計 樂清市艾德堡儀器有限公司;PAL-1型折光儀 北京陽光億事達貿易有限公司。
1.3 方法
1.3.1 MeJA處理對獼猴桃軟腐病葡萄座腔菌的作用機制
1.3.1.1 MeJA對葡萄座腔菌室內毒力測定
采用菌絲生長速率抑制法[35],先將MeJA配制成濃度為0(對照)、0.50、1.00、2.00、4.00、8.00 mmol/L的母液,再以母液、培養基體積比1∶9制成含0(對照)、0.05、0.10、0.20、0.40、0.80 mmol/L MeJA的PDA平板。利用打孔器打取直徑5 mm、培養4 d后的新鮮菌餅,置于含不同濃度MeJA的PDA平板中央,每培養皿接1 個菌餅,每個處理組4 次重復。接菌后將PDA平板置入28 ℃培養箱培養。待對照平板菌落直徑長至5~6 cm,利用十字交叉法測量菌落直徑,按式(1)計算抑菌率。根據抑菌率及藥劑濃度之間的線性關系計算得出毒力回歸方程、相關系數及有效抑制中濃度(concentration for 50% of maximal effect,EC50)。

1.3.1.2 細胞膜通透性的測定
真菌細胞膜受到抑菌劑的破壞時,菌體的天然屏障被打破,使其細胞內含物質滲出,從而導致菌體培養液的電導率上升;因此菌體培養液相對電導率的改變、內含物質的相對泄漏度可作為反映真菌細胞膜的通透性重要指標[36-37]。本研究采用電導率法[38]測定不同濃度MeJA對葡萄座腔菌細胞膜通透性的影響。在PD培養液中接入1 塊直徑為5 mm的葡萄座腔菌菌餅,于28 ℃下靜置培養7 d。從中挑出菌絲球,用蒸餾水洗滌數次,5 000 r/min離心10 min,濾紙吸干水分,稱取菌絲0.8 g放入裝有20 mL濃度分別為0(對照)、0.05、0.10、0.20、0.40、0.80 mmol/L MeJA溶液的離心管中混勻,每個處理3 次重復。分別在混勻后0、1、3、6、12、24、48 h利用電導儀測定培養液電導率,并按式(2)計算相對電導率;取2.0 mL培養液,5 000 r/min離心5 min,測定上清液在280 nm(蛋白質)和260 nm(核酸)波長處的吸光度,按式(3)計算細胞蛋白質和核酸類物質相對泄漏度[38]。

1.3.1.3 掃描電子顯微鏡及透射電子顯微鏡觀察菌絲超微形態及結構
分別從含有0(對照)、0.80 mmol/L MeJA的PDA培養基上生長的葡萄座腔菌菌落邊緣取直徑為5 mm的菌餅。掃描電子顯微鏡組以質量分數2.5%戊二醛固定液(50 mL磷酸鹽緩沖液(pH 7.4)加10 mL質量分數25%戊二醛溶液蒸餾水定容至100 mL,下同)4 ℃固定12 h,然后用磷酸鹽緩沖液(pH 7.4)沖洗3 次,每次15 min,乙醇(體積分數30%、50%、70%、80%、90%)逐級洗脫,叔丁醇與無水乙醇按體積比1∶3、1∶1、3∶1逐級洗脫,每次10 min,再經過干燥、粘樣、鍍膜,于掃描電子顯微鏡下觀察拍片。
透射電子顯微鏡組以質量分數2.5%戊二醛固定液固定12 h,質量分數1%鋨酸固定液固定2~3 h,乙醇(體積分數30%、50%、70%、80%、90%)逐級梯度脫水,純丙酮、包埋液(體積比2∶1)進行包埋處理,質量分數3%醋酸鈾-枸櫞酸鉛雙染色法染色后,對切片進行透射電子顯微鏡觀察并拍照,每個樣品至少觀察10 份超薄切片[38]。
1.3.1.4 葡萄座腔菌幾丁質酶活力的測定
取1.3.1.2節培養的病原菌菌絲體,5 000 r/min離心5 min,將沉淀轉入研缽中,加Tris-HCl緩沖液(0.05 mol/L,pH 7.5),液氮研磨破碎,轉入離心管中,生物顯微鏡觀察,無完整細胞后,4 ℃、5 000 r/min離心15 min,上清液即為粗酶提取液。取兩支離心管,分別取200 μL粗酶液(以先煮沸5 min粗酶液作為對照)與200 μL膠狀幾丁質混勻后,37 ℃下保溫1 h,加入200 μL硼酸鉀(0.8 mol/L),沸水浴5 min,冷卻,加3 mL質量濃度1 g/100 mL DMAB溶液,37 ℃保溫20 min,冷卻,測定544 nm波長處吸光度,同時以N-乙酰-D-氨基葡萄糖繪制標準曲線,每分鐘催化生成1 μg N-乙酰-D-氨基葡萄糖時所用酶量定義為1 個酶活力單位(U)[39]。
1.3.1.5 葡萄座腔菌β-1,3-葡聚糖酶活力的測定
取1.3.1.2節培養的病原菌菌絲體,5 000 r/min離心5 min,棄上清液。稱取0.3 g菌絲,用液氮研磨后加入1 mL 0.05 mol/L醋酸鈉緩沖液(pH 5.0)轉入離心管。4 ℃、5 000 r/min離心20 min,上清液蒸餾水透析4 h,在4 ℃下二次水透析12 h后,即為粗酶提取液。取100 μL粗酶液(以加入100 μL沸水浴處理10 min的粗酶液為對照),加入質量濃度0.1 g/100 mL昆布多糖溶液400 μL,40 ℃水浴30 min,然后加入2 mL DNS,沸水浴10 min,立刻用流動水冷卻,用紫外-可見分光光度計測530 nm波長處吸光度,利用葡萄糖標準曲線計算β-1,3-葡聚糖酶活力,每分鐘催化昆布多糖產生1 μg葡萄糖所需的酶量為1 個酶活力單位(U)[40]。
1.3.2 MeJA處理對獼猴桃軟腐病防控效果和果實品質的影響
1.3.2.1 田間實驗設計
田間實驗選擇兩個實驗基地,分別為貴州修文縣久長鎮茶山村綠園獼猴桃種植基地(果園1)和貴州省修文縣小菁鄉農業科技實驗示范基地(果園2)。果園1:平均海拔為1 395 m,亞熱帶季風性濕潤氣候,年平均氣溫12.8 ℃,降雨量1 180 mm;果園2:平均海拔1 320 m,年平均氣溫13.6 ℃,降雨量1 185.8 mm。兩個果園的土壤均為黃棕壤。
采用隨機區組設計,處理A:幼果期(7月18日)噴施0.50 mmol/L MeJA水溶液(含質量分數0.1% Tween-80以增加MeJA的溶解,下同);處理B:壯果期(8月20日)噴施0.50 mmol/L MeJA水溶液;處理C:壯果期0.50 mmol/L MeJA水溶液進行浸果;處理D:幼果期、壯果期分別噴施0.50 mmol/L MeJA水溶液;CK1:壯果期噴施3.00 mg/L 0.3%四霉素水劑;CK2:噴施0.1% Tween-80溶液,每處理重復3 次。2 個果園均以此設計進行實驗。果實按小區采收,每小區100 個果,常溫(25 ℃)條件下貯藏直至果實完全軟化。
1.3.2.2 發病率、病情指數、防效的測定
果實軟腐病病害發生調查參照張承等[41]的方法。分級標準為:0級,未發病;1級,0 cm<病斑直徑≤1 cm;2級,1 cm<病斑直徑≤2 cm;3級,2 cm<病斑直徑≤3 cm;4級,3 cm<病斑直徑≤4 cm;5級,4 cm<病斑直徑≤5 cm;6級,病斑直徑>5 cm。分別按式(4)~(6)計算發病率、病情指數和防效。

1.3.2.3 果實品質及貯藏性能測定
果實品質測定參照張承等[41]研究方法。利用分析天平測定單果質量,利用游標卡尺測定單果橫徑(赤道長軸)、縱徑(果蒂至果臍距離)、側徑(赤道短軸);利用PAL-1型折射儀測定果實中可溶性固形物質量分數;可溶性糖質量分數采用蒽酮比色法測定;VC含量用2,6-二氯靛酚滴定法測定;可滴定酸質量分數采用酸堿滴定法測定;葉綠素采用體積分數98%乙醇提取,其含量采用紫外-可見分光光度計法測定;可溶性蛋白含量采用考馬斯亮藍染色法測定;硬度采用GY-4數顯式果實硬度計測定;質量損失率采用稱質量法測定,并按式(7)進行計算。

1.4 數據統計分析
基礎數據采用Microsoft Office 2010軟件進行統計分析并作圖,采用DPS 7.05數據處理系統計算殺菌劑的毒力回歸方程、EC50及95%置信限,應用Duncan's新復極差法進行差異性分析(P<0.05為差異顯著;P<0.01為差異極顯著)。
2 結果與分析
2.1 MeJA對葡萄座腔菌的抑菌活性
2.1.1 MeJA對葡萄座腔菌抑菌率的影響
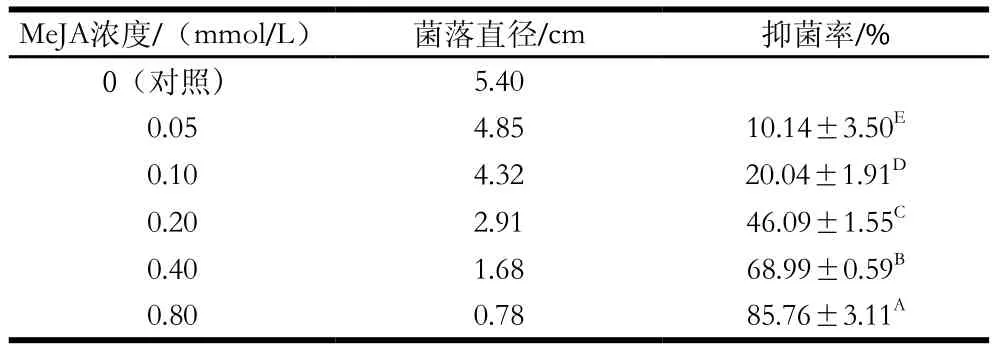
表1 MeJA對葡萄座腔菌的抑菌率Table 1 Inhibition rate of MeJA against Botryosphaeria dothidea
由表1可知,MeJA對葡萄座腔菌菌絲生長有明顯的抑制作用,培養4 d后隨著MeJA濃度的升高菌落直徑逐漸減小,抑菌率呈極顯著增加趨勢(P<0.01),說明在0~0.80 mmol/L范圍內,MeJA濃度越高,對獼猴桃軟腐病菌葡萄座腔菌抑制效果越好。計算MeJA對葡萄座腔菌的毒力回歸方程為y=6.272 05+2.009 16x,EC50為0.232 7 mmol/L,R2為0.997 6,95%置信限為(0.055 4,0.977 9)。
2.1.2 MeJA對葡萄座腔菌細胞膜通透性的影響
2.1.2.1 MeJA對葡萄座腔菌菌絲相對電導率的影響
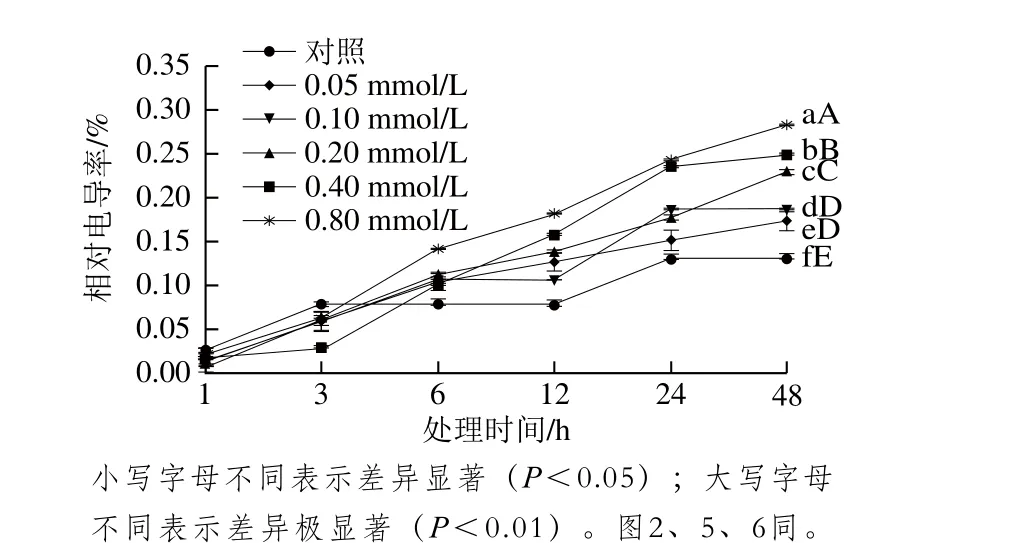
圖1 MeJA對葡萄座腔菌相對電導率的影響Fig. 1 Effect of MeJA on the relative conductivity of Botryosphaeria dothidea
從圖1可以看出,隨著MeJA處理時間延長和濃度升高,葡萄座腔菌相對電導率呈增加趨勢。在6 h后相對電導率差異較明顯,處理48 h后,0.05、0.10、0.20、0.40、0.80 mmol/L處理組葡萄座腔菌相對電導率分別比對照組高32.83%、42.78%、75.23%、89.89%、117.63%,同對照組相比,差異達極顯著水平(P<0.01)。表明MeJA可破壞葡萄座腔菌細胞膜穩定性,且隨MeJA濃度的升高和處理時間的延長,MeJA對葡萄座腔菌細胞膜破壞程度增強。
2.1.2.2 MeJA對葡萄座腔菌細胞蛋白質和核酸類物質外滲的影響
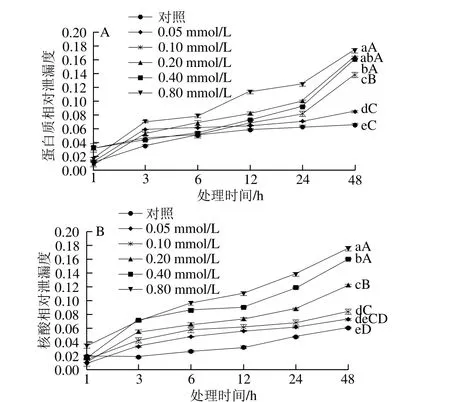
圖2 MeJA對葡萄座腔菌菌絲蛋白質(A)和核酸類物質(B)相對泄漏度的影響Fig. 2 Effect of MeJA on leakage of protein (A) and nucleic acid (B)from Botryosphaeria dothidea mycelia
由圖2A、B可知,隨著MeJA濃度的升高和處理時間的延長,葡萄座腔菌細胞蛋白質和核酸相對泄漏度呈逐漸升高的趨勢,48 h后蛋白質和核酸相對泄漏度同對照相比明顯升高,此時0.80 mmol/L MeJA處理組葡萄座腔菌細胞蛋白質、核酸相對泄漏度分別比對照分別高出1.65 倍和2.0 倍,差異極顯著(P<0.01)。結果表明,MeJA對葡萄座腔菌細胞膜破具有破壞作用,且處理濃度越高、處理時間越長,MeJA對葡萄座腔菌細胞膜破壞程度越嚴重。
2.1.3 MeJA對葡萄座腔菌菌絲超微形態的影響
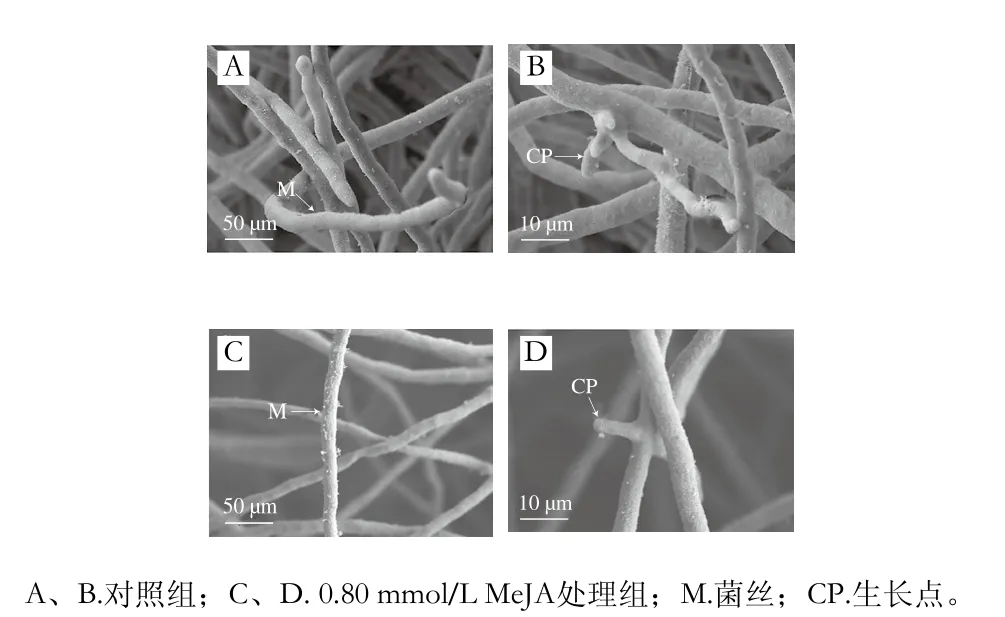
圖3 MeJA對葡萄座腔菌菌絲超微形態的影響Fig. 3 Effect of MeJA on morphology of Botryosphaeria dothidea mycelial
由圖3可知,對照組葡萄座腔菌菌絲形態正常且菌絲濃密,菌絲表面光滑且生長均勻,生長點多且飽滿。經0.80 mmol/L MeJA處理后,菌絲表面粗糙且菌絲稀疏,菌絲生長點少,表明菌絲生長受到抑制。
2.1.4 MeJA對葡萄座腔菌菌絲超微結構的影響
正常葡萄座腔菌的細胞壁光滑完整,細胞內空腔較少,細胞核、線粒體完整,顆粒蛋白較多,胞內細胞質顏色較深(圖4A、B);而經過0.80 mmol/L MeJA處理的葡萄座腔菌細胞壁有溶解現象,線粒體形狀變得不規則,部分細胞核有分解的趨勢(圖4C),空腔明顯增加,顆粒蛋白較少,且細胞質比正常細胞顏色淺(圖4D)。
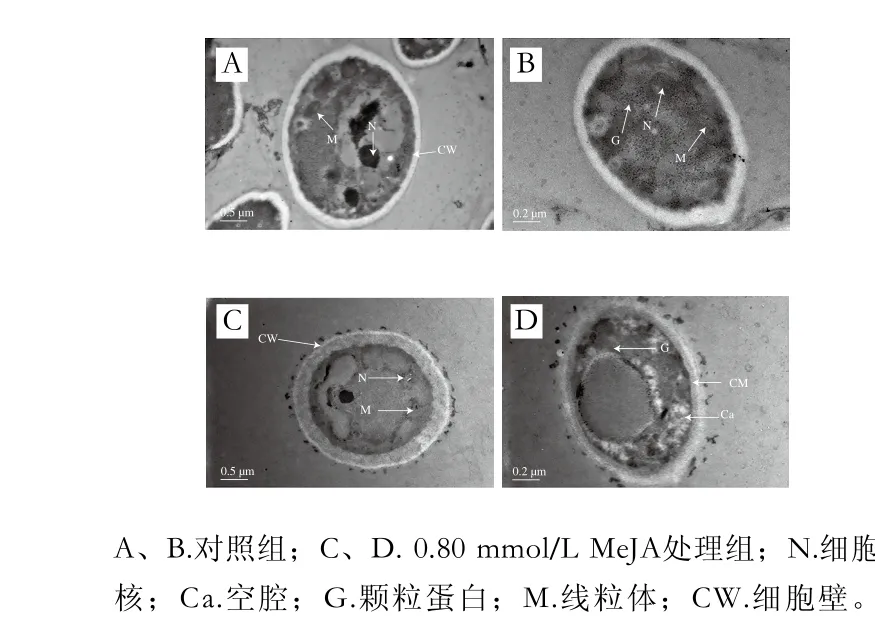
圖4 MeJA對葡萄座腔菌菌絲超微結構的影響Fig. 4 Effect of MeJA on ultrastructure of Botryosphaeria dothidea mycelial

圖5 MeJA對葡萄座腔菌幾丁質酶活力的影響Fig. 5 Effect of MeJA on chitinase activity fromBotryosphaeria dothidea mycelia
如圖5所示,隨著MeJA濃度的增加,葡萄座腔菌菌絲細胞壁幾丁質酶活力逐漸升高,同對照組相比差異極顯著(P<0.01)。結果表明,葡萄座腔菌經MeJA處理后,幾丁質酶活力增強,使病菌細胞壁幾丁質不斷降解,引起幾丁質組成成分N-乙酰-D-氨基葡萄糖含量升高,從而影響病原菌的生長,加速細胞死亡。
2.1.6 MeJA對葡萄座腔菌β-1,3-葡聚糖酶活力的影響
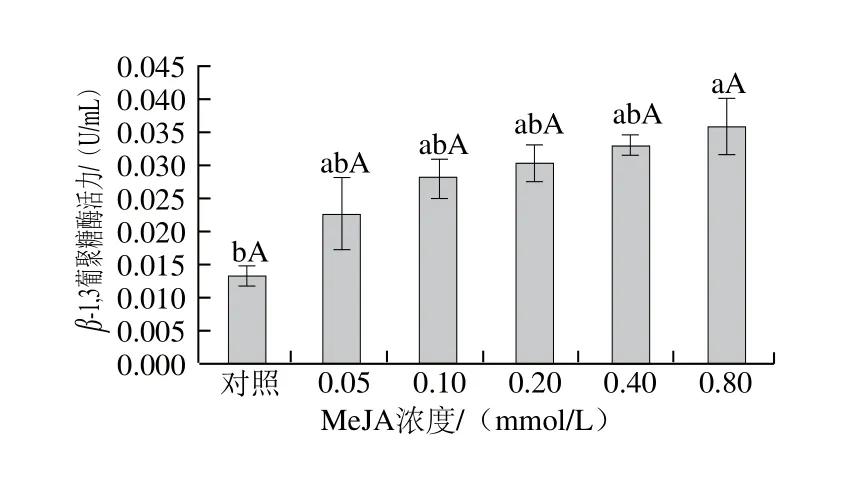
圖6 MeJA對葡萄座腔菌β-1,3葡聚糖酶活力的影響Fig. 6 Effect of MeJA on β-1,3-glucanase activity fromBotryosphaeria dothidea mycelia
β-1,3-葡聚糖是病原菌細胞壁主要成分,研究表明殼寡糖作用于菌絲細胞壁,可產生β-1,3-葡聚糖酶水解病原菌細胞壁,可使病原細胞死亡[42]。從圖6可以看出,隨MeJA濃度增加,葡萄座腔菌菌絲細胞壁β-1,3-葡聚糖酶活力逐漸增強;當濃度為0.80 mmol/L時,同對照組相比差異顯著(P<0.05),其余濃度處理組之間差異不顯著(P>0.05)。由此推斷,加入MeJA后,葡萄座腔菌細胞壁β-1,3-葡聚糖酶活力增強,導致病菌細胞壁β-1,3-葡聚糖水解,從而抑制病原菌的生長。
2.2 MeJA對獼猴桃果軟腐病的防控效果及品質的影響
2.2.1 MeJA對獼猴桃果軟腐病的防控效果
由表2可知,不同方式MeJA處理對獼猴桃軟腐病均有良好的防控效果,貯藏25 d后,果園1中,CK1、CK2平均發病率分別為48.39%、74.65%,除A處理組外,其余處理組平均發病率均極顯著低于2 個對照組(P<0.01),防效較好的為處理C,達49.14%,其次為處理A、D,防效分別達35.26%、45.97%;果園2中,CK1、CK2平均發病率分別為53.33%、72.50%,各處理組平均發病率均顯著低于2 個對照組(P<0.05),防效較好的為處理C,達77.70%,其次為處理A、D,防效分別達58.35%、69.46%。注:同一果園,同列肩標小寫字母不同表示差異顯著(P<0.05),同列肩標大寫字母不同表示差異極顯著(P<0.01)。下同。
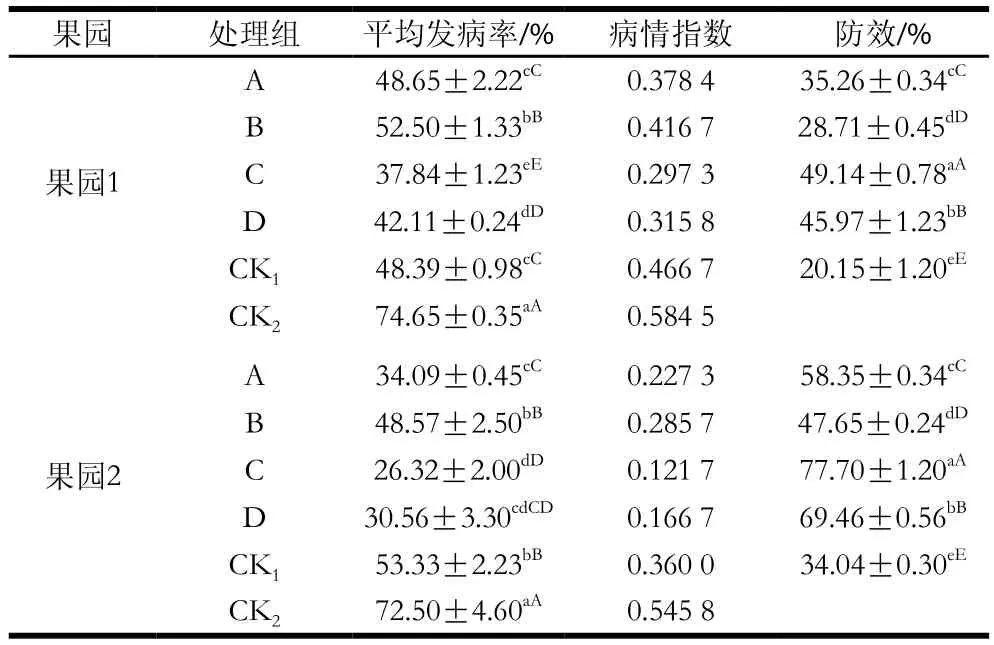
表2 MeJA對防控獼猴桃軟腐病的效果Table 2 Control efficiency of MeJA against soft rot of kiwifruits
2.2.2 MeJA對獼猴桃果實外觀品質的影響
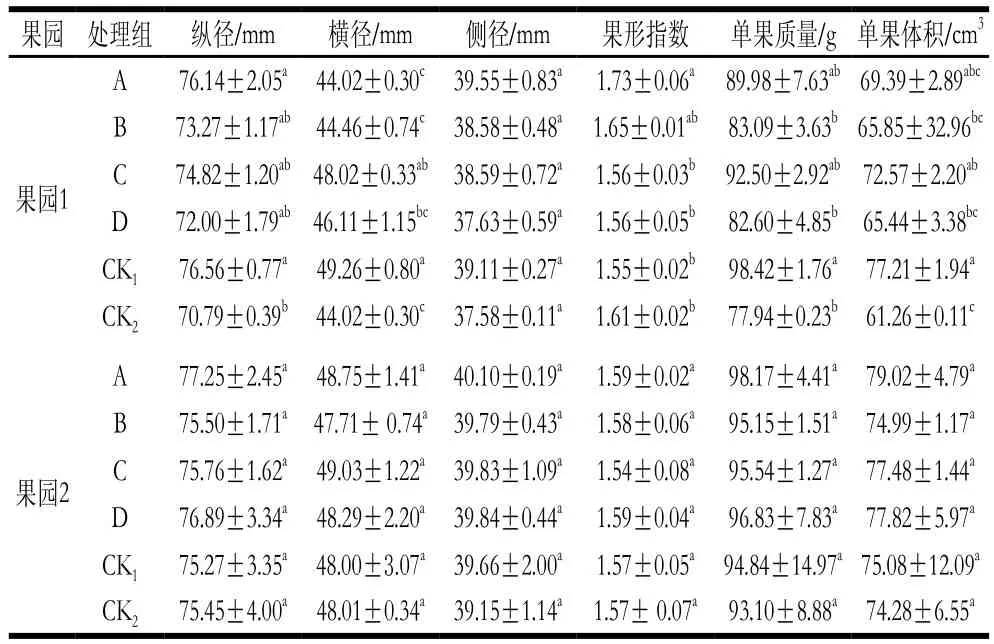
表3 MeJA對獼猴桃果實生長的影響Table 3 Effect of MeJA on the development of kiwifruits
從表3可看出,果園1中,獼猴桃幼果期噴施0.50 mmol/L MeJA(處理A)可顯著增加果實縱徑,改善果形指數(P<0.05),壯果期0.50 mmol/L MeJA浸果(處理C)可顯著增加果實橫徑、單果體積(P<0.05);果園2中,幼果期噴施0.50 mmol/L MeJA獼猴桃果實各指標同CK1、CK2相比增加,但差異未達顯著水平(P>0.05)。表明MeJA處理一定程度上可改善果實外觀品質。
2.2.3 MeJA對獼猴桃果實營養品質的影響
由表4可知,采前不同時期MeJA處理后,獼猴桃果實VC、葉綠素、可溶性蛋白含量和可溶性糖、可滴定酸質量分數同CK1、CK2相比有一定提高。表明MeJA處理對獼猴桃果實的品質有一定改善作用,壯果期0.50 mmol/L浸果處理(處理C)效果較好。
表4 MeJA對獼猴桃果實營養品質的影響Table 4 ffect of MeJA on nutritional quality of kiwifruits
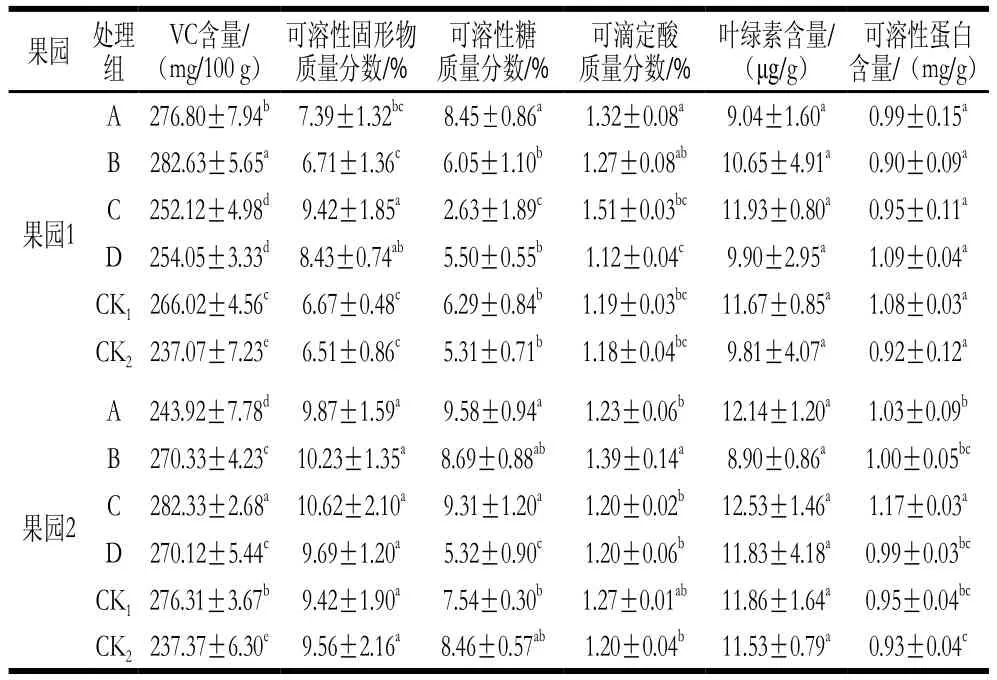
表4 MeJA對獼猴桃果實營養品質的影響Table 4 ffect of MeJA on nutritional quality of kiwifruits
果園 處理組VC含量/(mg/100 g)可溶性固形物質量分數/%可溶性糖質量分數/%可滴定酸質量分數/%葉綠素含量/(μg/g)可溶性蛋白含量/(mg/g)果園1 A 276.80±7.94b 7.39±1.32bc 8.45±0.86a 1.32±0.08a 9.04±1.60a 0.99±0.15a B 282.63±5.65a 6.71±1.36c 6.05±1.10b 1.27±0.08ab 10.65±4.91a 0.90±0.09a C 252.12±4.98d 9.42±1.85a 2.63±1.89c 1.51±0.03bc 11.93±0.80a 0.95±0.11a D 254.05±3.33d 8.43±0.74ab 5.50±0.55b 1.12±0.04c 9.90±2.95a 1.09±0.04a CK1266.02±4.56c 6.67±0.48c 6.29±0.84b 1.19±0.03bc 11.67±0.85a 1.08±0.03a CK2237.07±7.23e 6.51±0.86c 5.31±0.71b 1.18±0.04bc 9.81±4.07a 0.92±0.12a果園2 A 243.92±7.78d 9.87±1.59a 9.58±0.94a 1.23±0.06b 12.14±1.20a 1.03±0.09b B 270.33±4.23c 10.23±1.35a 8.69±0.88ab 1.39±0.14a 8.90±0.86a 1.00±0.05bc C 282.33±2.68a 10.62±2.10a 9.31±1.20a 1.20±0.02b 12.53±1.46a 1.17±0.03a D 270.12±5.44c 9.69±1.20a 5.32±0.90c 1.20±0.06b 11.83±4.18a 0.99±0.03bc CK1276.31±3.67b 9.42±1.90a 7.54±0.30b 1.27±0.01ab 11.86±1.64a 0.95±0.04bc CK2237.37±6.30e 9.56±2.16a 8.46±0.57ab 1.20±0.04b 11.53±0.79a 0.93±0.04c
2.2.4 MeJA對獼猴桃果實貯藏性的影響
2.2.4.1 MeJA對采后獼猴桃果實可溶性固形物質量分數的影響
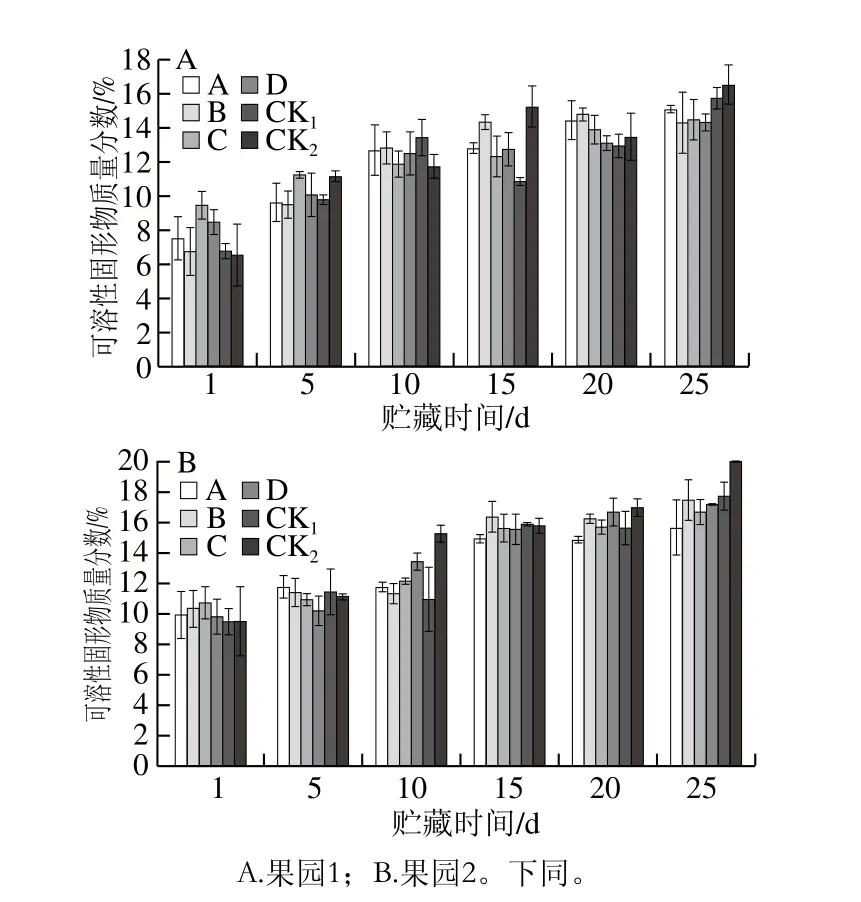
圖7 貯藏期獼猴桃果實可溶性固形物質量分數的變化Fig. 7 Changes in soluble solids content of kiwifruits during storage
可溶性固形物質量分數在獼猴桃成熟前會因果實成熟度升高而上升,是衡量果實成熟的標準之一[43]。如圖7A、B所示,隨著貯藏期的延長,可溶性固形物質量分數呈現逐漸上升的趨勢。貯藏25 d時,各MeJA處理組可溶性固形物質量分數均低于CK1、CK2組,果園1、果園2分別以處理D、A效果明顯。表明采前MeJA(0.50 mmol/L)處理可以提高獼猴桃果實可溶性固形物質量分數,同時延緩貯藏期間可溶性固形物質量分數的升高,起到延長獼猴桃果實貯藏時間的作用。
2.2.4.2 MeJA對采后獼猴桃果實可溶性糖質量分數的影響
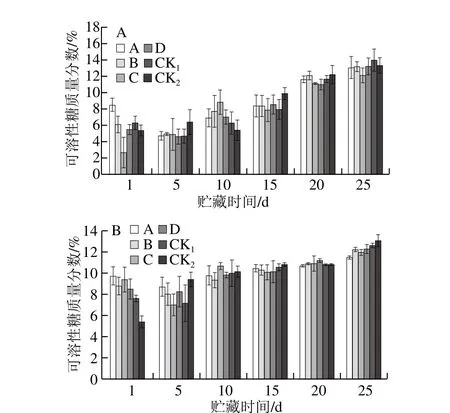
圖8 貯藏期獼猴桃果實可溶性糖質量分數的變化Fig. 8 Changes in soluble sugar content of kiwifruits during storage
如圖8A、B所示,隨貯藏時間的延長,可溶性糖質量分數逐漸升高。貯藏25 d時,果園1中CK1、CK2組可溶性糖質量分數分別為14.00%、13.29%,果園2中CK1、CK2組可溶性糖質量分數分別為12.19%、12.55%,且均高于各MeJA處理組,但差異不明顯;果園1、果園2均為處理A、C效果較好。表明以0.50 mmol/L MeJA進行幼果期噴施或壯果期浸果處理可以抑制獼猴桃果實可溶性糖質量分數的升高,有利于果實貯藏保鮮。
2.2.4.3 MeJA對采后獼猴桃果實VC含量的影響
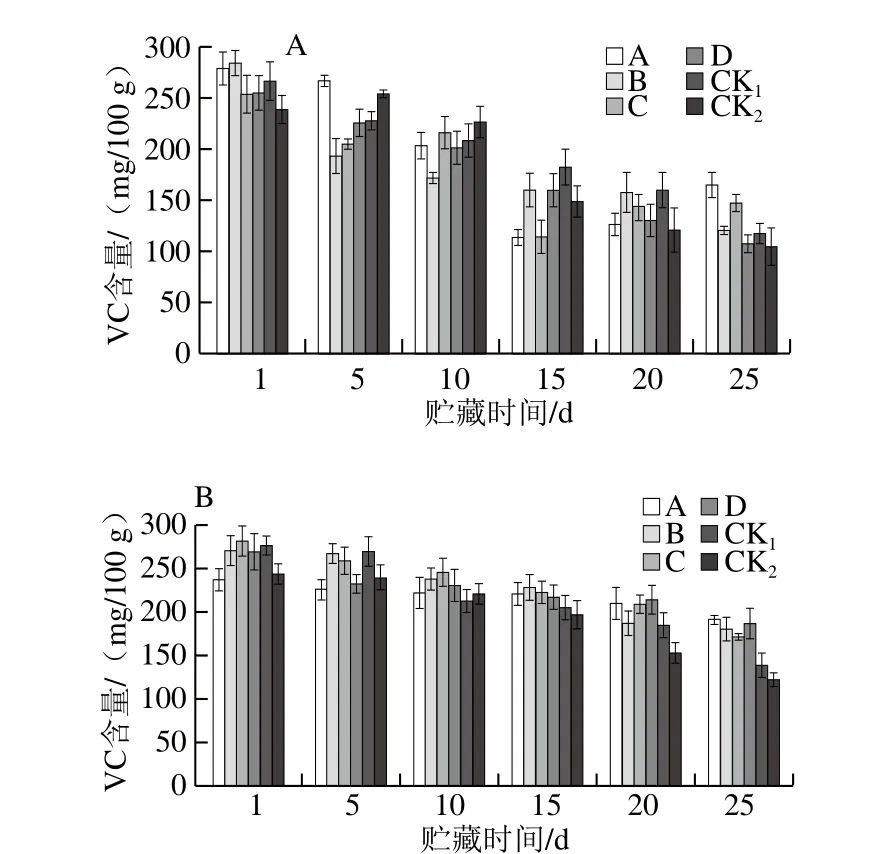
圖9 貯藏期獼猴桃果實VC含量的變化Fig. 9 Changes in vitamin C content of kiwifruits during storage
如圖9所示,貯藏期各處理組VC含量呈下降的趨勢。貯藏25 d,兩果園MeJA處理獼猴桃果實VC含量均高于對照組,且貯藏過程中VC含量損失均低于對照組。果園1、果園2均為處理A效果較好,VC含量分別為163.70、
191.85 mg/100 g,明顯高于兩個對照組,其次分別為處理C、D。表明幼果期噴施0.50 mmol/L MeJA可有效降低貯藏期果實VC的損失。
2.2.4.4 MeJA對采后獼猴桃果實可滴定酸質量分數的影響
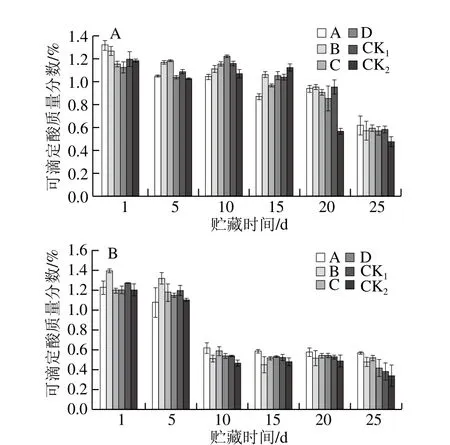
圖10 貯藏期獼猴桃果實可滴定酸質量分數的變化Fig. 10 Changes in titratable acid content of kiwifruits during storage
由圖10可知,隨貯藏時間的延長,可滴定酸質量分數呈下降趨勢。除果園1中的CK1組外,其余對照組可滴定酸質量分數下降速度明顯快于MeJA處理組,說明采前MeJA處理抑制了獼猴桃的軟化。果園1、果園2中均以處理A、C延緩效果較好。表明采前噴施MeJA可有效減少貯藏期可滴定酸質量分數的降低,使得獼猴桃果實保持適宜的糖酸比,有利于獼猴桃的貯藏品質和風味的保持。
2.2.4.5 MeJA對采后獼猴桃果實葉綠素含量的影響
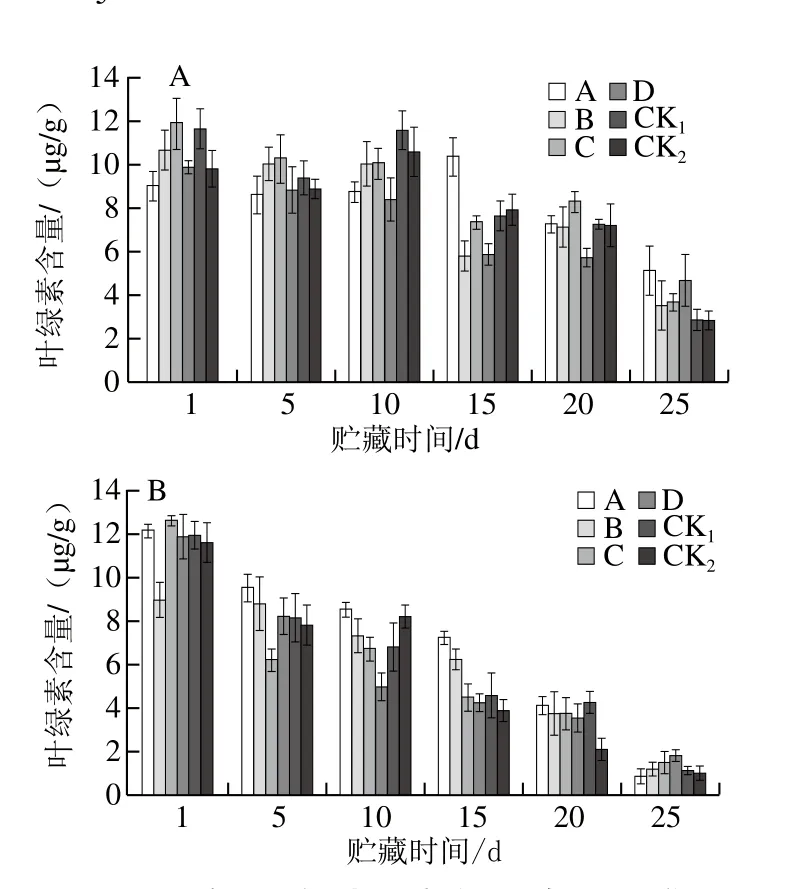
圖11 貯藏期獼猴桃果實葉綠素含量的變化Fig. 11 Changes in chlorophyll content of kiwifruits during storage
由圖11可知,隨著獼猴桃果實軟化衰老,果實中葉綠素含量不斷降低。貯藏25 d時,果園1中CK1、CK2組葉綠素含量分別為2.93、2.92 μg/g,低于各MeJA處理組;果園2中CK1、CK2葉綠素含量低于C、D處理組。表明適當的MeJA處理可延緩獼猴桃果實貯藏期間葉綠素的損失,對貯藏期果實品質維護起到輔助作用,其中果園1、果園2中分別以處理A、D效果較好。
2.2.4.6 MeJA對采后獼猴桃果實可溶性蛋白含量的影響
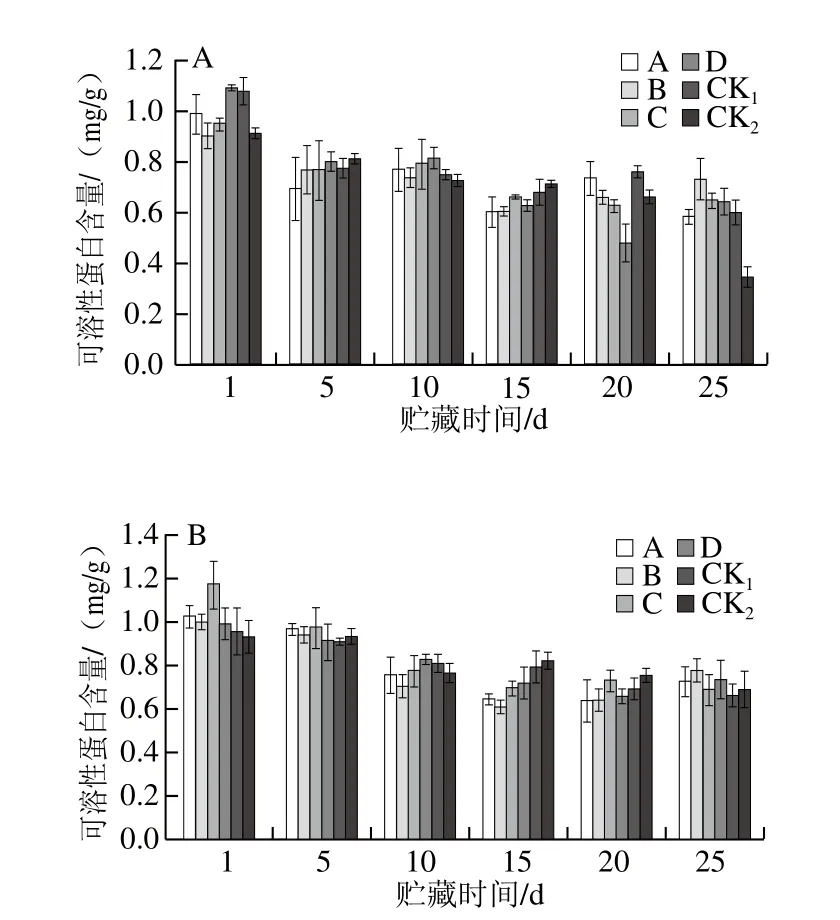
圖12 貯藏期獼猴桃果實可溶性蛋白含量的變化Fig. 12 Changes in soluble protein content of kiwifruits during storage
由圖12可知,隨貯藏時間延長,獼猴桃果實可溶性蛋白含量呈波動下降的趨勢。貯藏25 d時,2 個果園CK1組可溶性蛋白含量稍低于各MeJA處理組;果園1中CK2組可溶性蛋白含量為0.35 mg/g,明顯低于各MeJA處理組;果園2中CK2組可溶性蛋白含量均稍低于各MeJA處理組。表明MeJA處理可以有效延緩可溶性蛋白損失,在獼猴桃果實貯藏中對果實品質損失起到保護作用,其中,果園1、果園2均以B處理效果較好。
2.2.4.7 MeJA對采后獼猴桃果實硬度的影響
水果的硬度是衡量果實是否成熟的標準之一[43]。如圖13所示,隨著貯藏時間的延長,果實硬度呈下降趨勢,整個貯藏期各處理組獼猴桃果實硬度均高于2 個對照組。貯藏第25天,果園1、果園2中MeJA處理獼猴桃果實的最低硬度均高于2 個對照組。果園1中處理C效果較好,貯藏結束時硬度為3.90 kg/cm2;果園2中處理B效果較好,貯藏結束時硬度為1.84 kg/cm2。表明MeJA處理處理可有效延緩果實軟化,延長獼猴桃貨架期。
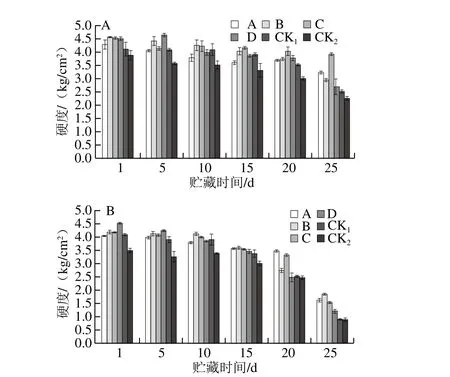
圖13 貯藏期獼猴桃果實硬度變化Fig. 13 Changes in firmness of kiwifruits during storage
2.2.4.8 MeJA對采后獼猴桃果實質量損失率的影響
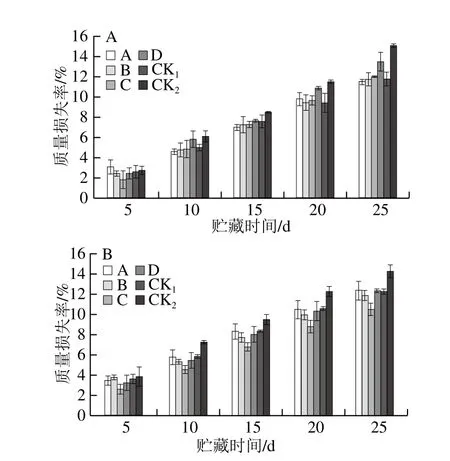
圖14 貯藏期獼猴桃果實質量損失率變化Fig. 14 Changes in mass loss rate of kiwifruits during storage
如圖14所示,整個貯藏過程中獼猴桃果實質量損失率呈上升趨勢。貯藏5 d后,果園1、果園2 中CK2組質量損失率逐漸上升,且上升速率明顯高于MeJA處理組;貯藏25 d后,果園1、果園2中效果較好的分別為處理A、C,但CK1組質量損失率與MeJA處理組差異不明顯。表明采前MeJA處理可在一定程度上抑制果實水分蒸發和果實內含物質的損失,降低獼猴桃果實質量損失率。
3 討 論
大量研究結果表明,MeJA可有效地抑制番茄、芒果和蘋果等果蔬釆后真菌性病害發生[22,24-26]。本研究表明,0~0.80 mmol/L MeJA對獼猴桃軟腐病菌葡萄座腔菌有均有一定抑制作用,且抑制效果隨MeJA濃度升高而增強,其EC50為0.232 7 mmol/L。與盤柳依等[44]在獼猴桃軟腐病葡萄座腔菌上的研究結果類似,同時李燦嬰[19]、孫嘉曼[45]等研究證實離體MeJA具有抑菌作用。此外,本研究發現0.80 mmol/L MeJA處理葡萄座腔菌菌絲體48 h后,可致菌絲細胞細胞壁溶解、胞內細胞器增多且形狀變得不規則;同時不同濃度MeJA處理會引起菌絲體相對電導率、蛋白質與核酸相對泄漏度升高,細胞壁主要酶活力增強,從而破壞葡萄座腔菌菌絲細胞膜,影響葡萄座腔菌細胞代謝,達到抑菌或殺菌的作用;但MeJA對葡萄座腔菌是否存在其他方面的影響有待進一步研究。
茉莉酸類化合物處理植物可系統誘導多酚氧化酶、過氧化物酶、脂氧合酶、蛋白酶抑制劑和殼聚糖酶等防御蛋白的活力升高[18]。王英珍等[18]研究表明,采前MeJA處理可有效提高果實中抗病性相關酶的活性,激活果實抗病防御系統,抑制成熟梨果實發病,李燦嬰等[46]研究發現MeJA可有效抑制病斑擴展,抑制病害的發生與蔓延。本實驗通過果實生長發育期進行MeJA處理,結果表明采前一個月(壯果期)0.50 mmol/L MeJA浸果處理獼猴桃,對軟腐病的防效可達77.70%。獼猴桃軟腐病是由一種或幾種病原菌侵染引起,MeJA處理仍可有效防控其發生,認為MeJA直接抑制葡萄座腔菌引起的軟腐病發生的同時可能抑制其他病原菌的生長,或是誘導獼猴桃產生抗性,激活抗病防御機制,通過直接抑菌與誘導抗性形成協同性,有效防控軟腐病的發生。
外源MeJA處理能夠顯著提升農產品品質,延長農產品保鮮時間,在香氣提升、次生代謝產物含量增加等方面的效用尤為明顯[47]。外源MeJA易進入植物體內,能夠有效透過植物細胞膜在植物體內運輸并發揮信號轉導作用,調節植物體一系列生理生化反應[48]。同時外源MeJA可促進草莓可溶性固形物含量的增加、保持水蜜桃的營養品質、提高獼猴桃可溶性固形物含量[47-51]。本研究發現,MeJA處理可有效提高獼猴桃果實可溶性固形物、可溶性糖質量分數和VC含量,改善獼猴桃品質,與前人研究結果有共同之處。外源MeJA被吸收后可有效發揮信號分子作用,調控相關基因表達,影響相應蛋白質表達,誘導植物體內苯丙氨酸途徑關鍵酶活性上升,促進次生代謝產物的積累[47],這可能是MeJA改善獼猴桃果實營養品質的關鍵原因。
獼猴桃果實采后貯藏期間生理衰老及品質裂變對果實硬度、糖、酸和水分保持有著重要的影響。硬度的保持可以降低果實軟化率、延長貯藏期;水分及內含物質的損失會導致營養、風味的下降[1]。胡文忠等[52]研究發現外源MeJA可抑制果實呼吸強度、保持獼猴桃果實硬度、延緩果實中的VC、可溶性固形物等營養的損失。本研究表明,采前一個月采用0.50 mmol/L MeJA浸果處理可抑制獼猴桃貯藏過程中硬度下降,延緩果實可溶性固形物、可溶性糖和VC的損失,有效延長果實貯藏時間。盤柳依等[53]研究發現外源MeJA可抑制果實的呼吸強度、降低質量損失和腐爛率,從而有效保持獼猴桃果實品質、延長獼猴桃果實貯藏期,與本研究結果基本一致。對于外源MeJA對獼猴桃果實品質和貯藏性能的影響機制、最佳處理時間及對獼猴桃其他方面的影響還有待進一步研究。
4 結 論
本研究發現外源MeJA對獼猴桃軟腐病致病菌葡萄座腔菌有抑制作用,EC50為0.232 7 mmol/L;通過MeJA對葡萄座腔菌作用機制的研究,證明了MeJA可直接作用于葡萄座腔菌,增加其菌絲細胞膜通透性,誘導細胞壁水解酶(幾丁質酶、β-1,3葡聚糖酶)活力增強,使細胞壁結構發生改變,進而改變細胞內部結構,影響細胞正常新陳代謝,從而達到抑菌的效果。采前一個月以0.50 mmol/L MeJA浸果處理可有效防控獼猴桃軟腐病的發生,改善獼猴桃果實品質,減少果實內營養的損失,增強貯藏性能,從而達到保持獼猴桃果實食用價值且延長貨架期的效果。

