免疫磁分離技術(shù)在食源性致病菌快速檢測中的研究進展
曹 瀟,趙力超,陳 洵,謝 會,張竟豐,劉卓坤,王 麗,*
(1.華南農(nóng)業(yè)大學食品學院,廣東 廣州 510642;2.暨南大學食品安全與營養(yǎng)研究院,廣東 廣州 510632;3.廣州雙螺旋基因技術(shù)有限公司,廣東 廣州 510006)
食源性細菌感染和疾病一直以來被認為是全球公共衛(wèi)生的主要威脅,在全世界范圍內(nèi)造成了嚴重的健康威脅和社會經(jīng)濟損失,始終是研究人員亟需解決的首要問題[1]。有效預防和控制食源細菌的污染關(guān)鍵在于病原微生物的快速篩查,通常包括樣品采集、樣品前處理和微生物檢測等步驟[2]。樣品采集通常可采用國家標準方法,微生物快速檢測可采用聚合酶鏈式反應(polymerase chain reaction,PCR)、酶聯(lián)免疫吸附測定(enzyme linked immunosorbent assay,ELISA)、生物傳感器等傳統(tǒng)或新型方法。然而,由于動物和食品樣品均比較復雜,通常需要進行有效的樣品前處理才能得到準確可靠的檢測結(jié)果,現(xiàn)有的膜過濾和離心等傳統(tǒng)方法分別是基于分子大小和質(zhì)量,均沒有特異性,存在較大的局限性。因此,迫切需要開發(fā)食品樣品前處理新技術(shù),以提供自動化、簡單、準確和快速的系統(tǒng),從樣品中分離和濃縮低濃度的目標致病菌。
免疫磁分離技術(shù)(immunomagnetic separation,IMS)作為食物樣品有效的預濃縮技術(shù),能夠快速地從復雜的食品基質(zhì)中選擇性分離和濃縮靶細菌[3-4]。同時還因其具有靶向特異性強、操作方便、分離效率高等特點,而且能有效減輕過程交叉污染,已被證明是最具潛力的食品樣品前處理技術(shù)[5]。IMS常結(jié)合下游檢測方法,如顯色培養(yǎng)基[6]、PCR及衍生技術(shù)[7]、免疫學方法[8]、生物傳感器[9]、微流體[10]等實現(xiàn)多種不同食品基質(zhì)中致病性大腸桿菌O157:H7[11]、副溶血性弧菌[12]、沙門氏菌[13]、單增李斯特菌[14]、金黃色葡萄球[15]等常見致病菌的快速或在線分析檢測。本文歸納總結(jié)IMS在食源性致病菌快速檢測中應用的最新進展,以期為其進一步創(chuàng)新、IMS快速檢測試劑盒的研發(fā)應用以及與其他檢測技術(shù)的深度融合提供新思路,使其更好地服務于食源性致病菌的快速篩查。
1 IMS富集食源性致病菌的原理
IMS通過磁珠的磁響應性和免疫學反應富集食源性致病菌,其作用原理如圖1[16]所示,超順磁性顆粒其表面經(jīng)化學修飾后,與靶細菌特異性的活性蛋白質(zhì)結(jié)合制成免疫磁珠(immunomagnetic beads,IMBs),然后IMBs上的抗體將會特異性識別與捕獲待檢樣品中的目標菌,形成IMBs-目標菌復合物。最后依靠磁場的作用力快速地使復合物與樣品中其他雜質(zhì)分離,從而達到高效、精準濃縮目標微生物的目的。
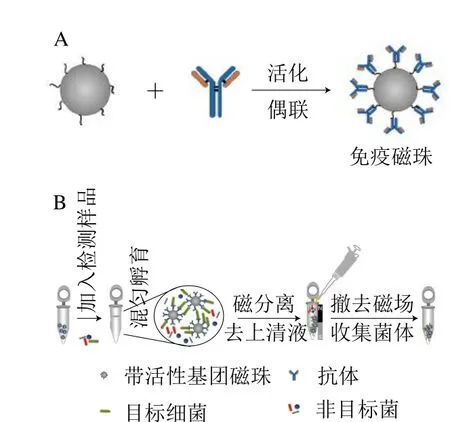
圖1 IMS原理圖[16]Fig. 1 Schematic illustration of IMS[16]
2 影響磁分離效果的主要因素
磁分離效果是檢驗IMS從復雜樣品基質(zhì)中分離濃縮目標微生物能力的標準,而IMS的有效性和穩(wěn)定性依賴于IMBs和富集條件,如何讓磁分離效果達到最佳的狀態(tài),需考慮到以下影響因素。
2.1 磁珠

表1 磁珠的制備方法及特點Table 1 Synthetic methods of magnetic beads and its characteristics
磁珠是IMS應用的物質(zhì)基礎(chǔ)。目前磁珠的合成手段如表1所示,也可直接購買成熟的商品化磁珠,進口的有Invitrogen Dynabeads磁珠、Bangs微球、Polysciences等,國內(nèi)有上海奧潤微納公司和廈門鑫海公司等生產(chǎn)磁珠。磁珠的粒徑和數(shù)量是影響磁分離效果的重要因素。Shan Shan等[17]研究不同粒徑(180、350、1 150 nm)磁珠對磁分離效果的影響,結(jié)果表明隨著磁珠尺寸的減小,靶細菌捕獲率增加。這可能是由于磁珠粒徑越小,其比表面積就越大,從而能夠捕獲到更多的靶細菌。Brandao[18]、牛牧[19]等也證實了這一點,磁珠粒徑的確對捕獲效率存在較大的影響。但Chen Jing等[20]研究表明,IMBs粒徑不僅能影響目標菌的捕獲效率,還對樣品基質(zhì)中非特異性結(jié)合率產(chǎn)生顯著影響。另外,IMS的回收效率也會隨著IMBs劑量的增加而增加至飽和狀態(tài)[21]。
2.2 表面功能基團修飾
直接使用未修飾的磁性微粒偶聯(lián)抗體等物質(zhì)時,不僅偶聯(lián)效率低,而且易被外界空氣氧化,不利于保存。因此,研究人員常對合成的磁性微粒進行表面修飾,使其帶有所需的活性基團。鐘子清等[27]比較了抗體直接偶聯(lián)和鏈霉親和素-生物素介導偶聯(lián)的IMBs對單增李斯特菌富集效果的影響。結(jié)果表明,鏈霉親和素-生物素介導偶聯(lián)IMBs的捕獲效率約是直接偶聯(lián)法的3 倍。Li Fulai等[28]研究表明,經(jīng)生物素修飾后的IMBs不僅對單增李斯特菌表現(xiàn)出超強的捕獲能力,當細菌濃度低于104CFU/mL時,有超過90%的單增李斯特菌被捕獲。更重要的是,相比以前直接使用抗體共軛磁性納米粒子,抗體劑量減少了10 倍。此外,IMBs修飾不同的功能基團,其富集效果不同。蘇晨曦等[29]應用羧基和甲苯磺酰氨基偶聯(lián)的IMBs與環(huán)介導基因恒溫擴增技術(shù)聯(lián)用檢測水產(chǎn)品中的副溶血性弧菌,結(jié)果表明,羧基偶聯(lián)的磁珠捕獲菌體的能力顯著優(yōu)于甲苯磺酰胺基(P<0.05),兩種羧基磁珠富集效率分別達到79%和94%。
2.3 抗體的選擇
抗體是IMS中識別、捕獲和集中來自食物樣品中靶病原體的分子,對免疫磁分離效果具有至關(guān)重要的影響。為了使富集效果最佳,使用的抗體應具備特異性好、排他性強與效價高等特點,即抗體與食源性致病菌需具備高親和度,且不與其他細菌進行交叉反應,抗原抗體結(jié)合反應靈敏度高[30]。抗體有單克隆抗體和多克隆抗體之分,在IMS分離食源性致病菌中均有應用。單克隆抗體具有較高的穩(wěn)定性與特異性,其效果優(yōu)于多克隆抗體,但制備周期長、價格昂貴且敏感度不及多克隆抗體。抗體的選擇至關(guān)重要,目前市面上專門針對食源性致病菌的抗體相關(guān)產(chǎn)品(抗血清、純抗體等)并不多見,特別是不常見食源病原微生物(表2)。國內(nèi)外食源性致病菌抗體品牌以美國Thermo Fisher公司、Meridian Life Science公司、KPL公司為代表,但價格昂貴且量少。也有研究人員選擇實驗室自制抗體或?qū)⒖乖瓬缁詈蠼豢贵w公司免疫,但耗時長(至少需要2 個月時間),且抗體特異性和有效性較前者低。另外,在進行大容量IMS的實際應用研究時,活性抗體與磁珠和靶細菌結(jié)合的先后順序也會影響磁分離效果。這是由于固定在磁珠的抗體運動性能較游離抗體弱而導致真正捕獲在IMBs上目標細菌的量少,特別是在大體積的體系中。為了確保免疫磁珠對靶細菌的高捕獲效率,Luo Dan等[31]采用新型IMS方法,即首先將生物素化單增李斯特菌單克隆抗體與10 mL單增李斯特菌特異性結(jié)合,然后與鏈霉親和素磁珠偶聯(lián)。結(jié)果表明巴氏殺菌乳中單增李斯特菌捕獲效率大于90%,而生物素化抗體的使用量僅約為常規(guī)IMS的7%,大幅節(jié)約了檢測成本。
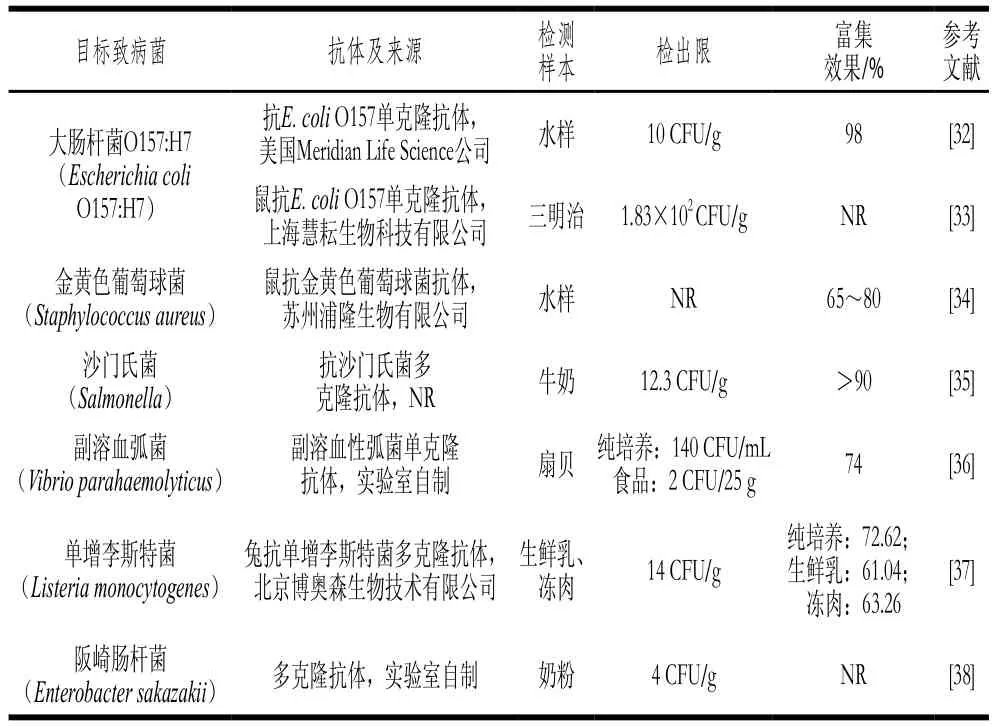
表2 IMS中常用食源性致病菌抗體信息Table 2 Antibody information of common foodborne pathogenic bacteria captured by IMS
2.4 富集條件
食品中目標菌的初始濃度,即食品基質(zhì)中病原微生物污染程度會對磁分離效果產(chǎn)生明顯影響作用。低濃度的樣本相比高濃度更易分離濃縮,李超輝等[39]證明了這點,加標量為0.25~2.00 ng/g時回收率大于80%,而當加標量為5 ng/g時回收率降至61.2%。另外,富集時間也是影響分離效果的關(guān)鍵因素,將磁性微粒置于磁場上時,時間不能太短或太長,時間太長導致部分磁性微粒聚集而不易分散,形成大顆粒;時間太短會使部分磁性微粒隨廢棄液而棄去,最終降低結(jié)果的精確度。Escalante-Maldonado等[40]研究結(jié)果表明,持續(xù)振動孵育30 min有利于增強IMBs與靶標的關(guān)聯(lián)性,提高富集效率。同樣,在磁分離前3 min內(nèi)細菌回收率顯著增加,3 min后無顯著差異。外界加持的高梯度和強度磁場有助于提高細菌的分離效率,Lin Jianhan等[41]研究證明高梯度磁分離(high gradient magnetic separation,HGMS)是一種有效的方法。然而在HGMS作用下吸附柱易吸收非目標磁性材料并造成復雜樣品中非磁性殘余物的阻塞,其研究仍存在一些挑戰(zhàn)。
3 IMS結(jié)合其他下游檢測技術(shù)在食源性致病菌檢測中的應用
IMS主要解決樣品前處理中微生物分離富集這一難題,后續(xù)還需要結(jié)合其他下游檢測技術(shù)。目前已將IMS結(jié)合顯色培養(yǎng)基、PCR及衍生技術(shù)、免疫學方法、生物傳感器、微流體等應用于食品安全分子檢測領(lǐng)域研究中。
3.1 結(jié)合顯色培養(yǎng)基的檢測
顯色培養(yǎng)基是一種基于細菌代謝特異性酶與相應顯色底物反應顯色的原理來鑒定細菌的檢測方法,結(jié)果直觀易獲取,其靈敏度和特異性均優(yōu)于傳統(tǒng)培養(yǎng)基。聞一鳴[42]、Wadud[43]、Bauwens[44]等的實驗證明了聯(lián)合使用IMS與顯色培養(yǎng)基能夠準確檢出目標病原微生物,較國家標準檢測法用時短,且具有同等靈敏度。然而,顯色培養(yǎng)基法仍無法有效克服平板檢測的操作繁瑣、易漏檢和錯檢等缺陷,已不能滿足現(xiàn)代食源性致病菌快速檢測的要求,逐漸被其他檢測技術(shù)替代。
3.2 結(jié)合PCR及衍生技術(shù)的檢測
PCR是一種針對目標細菌特異性基因進行核酸擴增的分子生物學技術(shù),包括普通PCR、可同時檢測多種細菌的多重PCR(multiplex PCR,mPCR)、基于核酸染料疊氮溴化丙錠(propidium monoazide,PMA)和疊氮溴化乙錠用于區(qū)分死活細胞的PCR、環(huán)介導恒溫核酸擴增(loop-mediated isothermal amplification,LAMP)技術(shù)等。因PCR技術(shù)特異性強、靈敏度高和檢測時間短,已成為目前聯(lián)合IMS來快速檢測食源性致病菌中應用最廣泛、最成熟的技術(shù)之一(表3)。然而,近年來新興發(fā)展的數(shù)字PCR作為一種強有力的能夠?qū)崿F(xiàn)對食品樣品中殘留的微量目標物進行絕對精準定量的工具,其同IMS聯(lián)用的應用研究卻鮮見報道,這有待于科研人員深入挖掘探討。
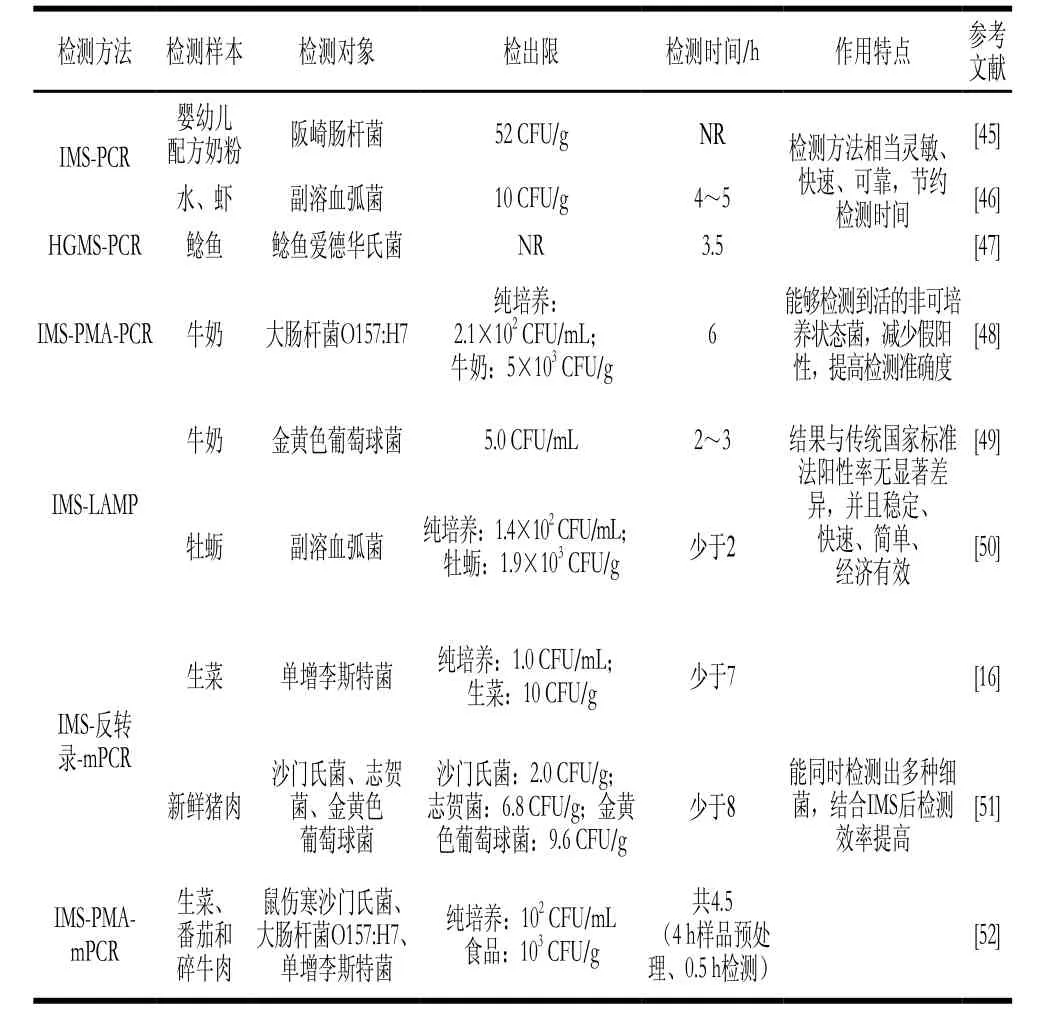
表3 IMS聯(lián)合PCR及衍生技術(shù)在食源性致病菌快速檢測中的應用Table 3 Applications of IMS combined with PCR and its derivative technologies in rapid detection of foodborne pathogenic bacteria
3.3 結(jié)合免疫學方法的檢測
免疫學方法依賴于目標病原體上存在抗原的高度特異性和敏感性,該特異性允許抗體與靶病原體中抗原產(chǎn)生強烈反應性。IMS-免疫學法利用磁珠的高比表面積和超順性的特性大幅增加了抗原抗體反應的接觸面積,從而降低檢出限和縮短檢測時間。ELISA是最早出現(xiàn)且最常見的基于抗原-抗體特異性結(jié)合原理實現(xiàn)靶標定量的檢測技術(shù),也是最先結(jié)合IMS來檢測食源性致病菌的免疫學方法。Wang Zhouli等[53]建立的IMS-ELISA在3 h內(nèi)檢測到可疑陽性樣品,同時顯著減少檢測脂環(huán)酸芽孢桿菌屬所需的材料和勞動力,并且與標準培養(yǎng)方法相比,IMS-ELISA對102 份自然污染蘋果汁樣品的靈敏度、特異性、準確度分別達到91.3%、96.02%和95.09%。
盡管ELISA因其高靈敏度和準確性被譽為免疫檢測的金標準,但其對檢測儀器、環(huán)境條件和檢測人員的操作要求高,并不適用于對突發(fā)食品安全和公共衛(wèi)生事件即時有效的檢測。免疫層析試紙條技術(shù)(immunochromatography assay,ICA)將ELISA整合至層層疊加的試紙條,具有操作簡便、結(jié)果可視化、無需精密儀器和設備等優(yōu)勢,更適用于現(xiàn)場便攜式快速檢測。為了使檢測更易于進行,ICA常用不同標記物(如膠體金、酶、熒光素、金磁雙功能納米珠等)標記抗體,其中膠體金標記應用廣泛。Zhang Xuan等[54]研究表明免疫磁性分離后膠體金標記的免疫層析試紙條可以檢測到102CFU/mL的陰溝腸桿菌,比直接使用免疫色譜試紙條檢測靈敏度提高10 倍。Li Qianru等[55]通過熒光標記抗體結(jié)合IMS聯(lián)用技術(shù)能夠以較少的步驟快速富集香腸、豬肉和牛奶樣品中的單增李斯特菌,具有高度特異性,并且與單獨的熒光免疫層析相比,檢測限約提高40 倍。Huang Zhen等[56]首次將IMS與熒光納米珠橫向流動結(jié)合用于生乳中大腸桿菌O157:H7的檢測。IMS的熒光納米珠橫向流動測試條的信號值比沒有IMS時的信號值強,表明IMS可以富集大腸桿菌O157:H7并消除食品雜質(zhì)干擾。在免疫層析檢測方面,金磁雙功能納米珠是一種新型抗體標記物,Xia Shiqi等[57]首次將其同免疫色譜試紙結(jié)合成功應用于全脂牛奶中霍亂沙門氏菌的快速檢測,與膠體金-ICA相比,金磁雙功能納米珠-ICA更敏感,捕獲率為82.4%。
免疫脂質(zhì)體是指單克隆抗體或其片段修飾的脂質(zhì)體,兼有脂質(zhì)體和靶向抗體的優(yōu)點。其廣泛應用于臨床藥物治療,但在食源性致病菌的檢測應用上卻鮮見報道。Song Xinjie[58]、Shukla[59]等開發(fā)的基于免疫脂質(zhì)體的免疫磁性富集和分離測定法能夠快速、靈敏、特異性檢測到嬰幼兒配方奶粉中的阪崎腸桿菌,且能夠排除復雜的背景干擾,在食品安全檢測上顯示出巨大的潛力。
3.4 結(jié)合生物傳感器的檢測
生物傳感器是食品安全檢測領(lǐng)域的前沿技術(shù)之一,具有操作簡單、檢測成本低、選擇性好、靈敏度高、分析速度快,且能在復雜的體系中進行在線連續(xù)監(jiān)測等特點。生物傳感器逐漸成為常規(guī)檢測方法的潛在替代物[60],被研究人員廣泛關(guān)注。Huang Fengchun等[61]經(jīng)IMS特異性捕獲靶細菌形成免疫轉(zhuǎn)化酶-納米簇復合物,復合物上的轉(zhuǎn)化酶將注入毛細管中的蔗糖轉(zhuǎn)化為葡萄糖,使用葡萄糖計檢測葡萄糖以獲得葡萄糖濃度,從而測定樣品中目標菌的濃度。結(jié)果表明對大腸桿菌O157:H7檢測下限為79 CFU/mL。Cheng Ping等[62]所研究的用于檢測大腸桿菌O157:H7的安培計免疫傳感器,其具有新穎、快速且成本低的特點,不僅可通過簡單地關(guān)閉電源來再生,還適用于檢測其他病原體。其利用電極表面上的免疫復合物阻礙電子轉(zhuǎn)移來降低響應電流信號,而越大的ΔI表明越多的靶細菌被捕獲。聲學傳感器是電化學裝置有力的替代品,Papadakis等[63]就提出了一種微納米生物聲學系統(tǒng),該系統(tǒng)利用磁性免疫珠捕獲來自牛奶的細菌,然后通過LAMP平臺和表面聲波傳感器檢測。結(jié)果顯示,僅在4 h內(nèi)就能夠成功地檢測出25 mL牛奶中的1 個沙門氏菌細胞。
3.5 結(jié)合微流體的檢測
IMS能有效地將樣品中的目標分析物分離出來,然而在分離過程中涉及許多步驟(如孵育、洗滌、外加磁力收集和分散在緩沖溶液中),并且在這些步驟之間可能會丟失分析物。而結(jié)合微流體后將所有反應步驟集成到生物芯片上,可最大程度減少目標分析物的損失,并快速有效地從少量復雜流體中獲得測量結(jié)果。Malic等[64]研究了一種使用抗體特異性二氧化硅-殼-鐵-氧化物核納米顆粒捕集和釋放細菌的基于聚合物的微流體裝置。其獨特之處在于能夠控制室內(nèi)的磁場分布而不會造成剩磁,從而允許樣品捕獲和釋放。研究表明,15 min內(nèi)便可實現(xiàn)對單核細胞增生李斯特菌的檢測,最低檢出限為10 CFU/mL。郭建江等[65]構(gòu)建了基于微流控芯片的磁控分離實驗平臺,用于檢測水產(chǎn)養(yǎng)殖環(huán)境中大腸桿菌O157:H7,結(jié)果表明磁控分離法捕獲率可達到92%以上,與被動分離捕獲方式相比,不僅捕獲率提高30%,而且分離操作靈活可控,自動化水平較高,實現(xiàn)了水產(chǎn)病原菌的高效分離。
3.6 結(jié)合表面增強拉曼光譜技術(shù)的檢測
表面增強拉曼光譜(surface-enhanced Raman spectroscopy,SERS)是一種高靈敏度的光譜技術(shù)。IMS將特異性抗體偶聯(lián)在貴金屬(Au、Ag)涂層的磁納米珠上富集濃縮樣品靶細胞,然后通過SERS強烈增加待檢分子的拉曼信號,可實現(xiàn)食品中痕量微生物的檢測[66]。Najafi等[24]開發(fā)IMS-SERS的組合捕獲和檢測方法檢測蘋果汁中的大腸桿菌O157,結(jié)果顯示,該技術(shù)在1 h內(nèi)對致病菌的捕獲效率約為84%~94%,最低檢測限為102CFU/mL,無任何交叉反應。Kusic等[67]同樣基于IMS和SERS在生物膜基質(zhì)中建立了不依賴培養(yǎng)物、無需標記和快速檢測軍團菌的方法。在100 min內(nèi),該技術(shù)能夠良好地區(qū)別軍團菌與非軍團菌,準確度為98.6%。
3.7 結(jié)合流式細胞技術(shù)的檢測
流式細胞術(shù)(flow cytometry,F(xiàn)CM)是一種對流動的單細胞或微小顆粒分子進行快速檢測的技術(shù)。IMS采用熒光素標記的抗體制備IMBs純化和濃縮細菌,然后結(jié)合FCM檢測熒光強度來確定樣品中細菌的濃度。IMS-FCM具有快速、精準、高通量的特點,適用于低濃度的致病菌檢測。Ryumae等[68]將HGMS和FCM結(jié)合,其檢測靈敏度比未經(jīng)IMS后的FCM測定高3 個數(shù)量級。通過FCM確定的細胞數(shù)量與使用菌落計數(shù)法獲得的細胞數(shù)量在約10~105CFU/mL范圍內(nèi)相關(guān)。一次FCM檢測可在60 s內(nèi)完成,總檢測時間(包括樣品制備)不到2.5 h。Li Fulai等[69]開發(fā)了一種聚乙二胺樹狀大分子介導的生物素擴增磁性分離方法,結(jié)合FCM檢測單增李斯特菌。該方法在細菌濃度低于104CFU/mL的磷酸鹽緩沖液和人工污染生菜樣品中富集率超過(89.15±1.75)%。在磷酸鹽緩沖液中具有低至35 CFU/mL的檢測限,人工污染樣品中的最低檢測限為3.5×102CFU/g。
4 結(jié) 語
食源性致病菌的污染和傳播對食品工業(yè)和公共健康造成嚴重威脅,因此建立食源性致病菌在線或現(xiàn)場快速靈敏檢的檢測方法是保障食品安全和防控食源性病原菌感染的重要技術(shù)支撐。而樣品前處理是食品分析檢測中的關(guān)鍵限速環(huán)節(jié),現(xiàn)有步驟復雜而耗時。IMS提供了一種快速且經(jīng)濟高效的樣品前處理技術(shù),其方便有效性主要在于代替了常規(guī)的選擇性前增菌培養(yǎng)過程,與其他檢測技術(shù)聯(lián)用,可以達到縮短檢測周期、提高靈敏度、增強特異性等目的,尤其適合在基層食品微生物檢測實驗室的推廣和應用。但目前仍存在一些需要改進的地方:1)磁分離效率:需通過不斷優(yōu)化反應體系,最大程度提高實際樣品中痕量病原體磁分離效率;2)應用性:盡管IMS與生物傳感器、微流控裝置等新型檢測技術(shù)聯(lián)用已被研究,但大多數(shù)仍停留在實驗室階段,還應結(jié)合實際情況進一步融合,實現(xiàn)現(xiàn)場或在線檢測;3)多重病原體檢測:磁性顆粒雖已成功整合到市售試劑盒中,以便快速、簡單和可靠地檢測單一病原菌,但由于IMS應用于高通量多重分析復雜食品樣品的多病原體富集機理仍然難以厘清,目前只有少數(shù)商業(yè)試劑盒可用于同時檢測多重病原體,用于細菌多重檢測磁性顆粒的整合仍處于初級階段,需要進一步研究。未來研究IMS的關(guān)鍵點在于IMBs穩(wěn)定性的改進、磁分離后磁珠的回收利用以及實現(xiàn)可人為調(diào)節(jié)磁場操縱磁珠等,這些問題的解決對推進這項新技術(shù)至關(guān)重要。IMS未來發(fā)展方向應迎合食品安全檢測的要求實現(xiàn)高精度、高效率、低成本方式在線監(jiān)測病原體,使檢測越來越微型化、便攜化、智能化,更適用于現(xiàn)場快速檢測。

