水稻滯綠突變分子遺傳研究進展
劉凱 嚴國紅 張桂云 孫明法
摘要:水稻是中國最重要的糧食作物,水稻滯綠突變的分子遺傳研究對于延緩水稻衰老以及提高水稻生物產量方面具有重要的意義。本文從植物滯綠突變的概念、分類,水稻滯綠突變基因的克隆與功能分析,以及在水稻高產育種上的應用進行了綜述,探討水稻滯綠突變基因的分子遺傳機制,以期為水稻超高產育種及挖掘水稻高產潛力的種質資源提供理論依據。
關鍵詞:水稻;滯綠;突變;分子遺傳
中圖分類號:S511
文獻標識碼:A
文章編號:1000-4440(2019)02-0484-05
高等植物的衰老是植株在細胞、組織、器官上的衰退過程,而葉片衰老最直觀的表現是葉綠體向著有色體轉化,葉綠素發生降解以及光合能力的大幅度下降。植物滯綠突變體(Stay greenmutant)是指植株在葉片衰老過程中葉綠素不發生降解或降解不明顯,尤其是在植株生長發育后期,葉片能夠保持綠色較長時間,甚至不完全黃化,并且保持較強的光合作用。因此,滯綠突變體的特殊表型在提高農作物產量方面顯示了巨大潛力,同時高等植物葉綠素降解代謝途徑的調控機理研究對延緩植物衰老也具有重要意義。
水稻是中國主要的糧食作物,也是基因功能研究的模式植物。提高水稻葉片中的葉綠素含量,可以增加水稻的生物產量,因而具有超高產潛力的水稻品種往往表現為植株光合作用能力強,后期不早衰,抗逆性也顯著高于一般品種。水稻收獲籽粒中80%以上的干物質是開花以后通過光合作用獲得的中,一些水稻滯綠突變體的葉片在成熟期依舊保持濃綠色,進行著較強的光合作用,在提高水稻產量方面展現出一定的潛能。因此本文綜述了水稻滯綠突變體相關基因的克隆與功能分析,并對其在水稻超高產育種及挖掘水稻高產潛力的種質資源方面的應用作了展望。
1 植物滯綠突變的概念
植物在生長發育的后期,葉片會逐漸由綠變黃,發生衰老現象,然而Thomas等[2]1987年在草地羊茅(Festuca pratensis)中發現1株突變體(sid),葉片在后期未發生黃化,通過對突變體的離體暗培養,發現葉片中的葉綠素含量并未發生下降,對照(野生型)植株葉綠素發生明顯降解。之后研究者利用物理和化學誘變的方法在辣椒(Capsicum annum)[3]、高粱(Sorghum bicolor)[4]、水稻(Oryza sativa)[5]、煙草(Nicotiana tabacum)[6]和擬南芥(Arabidopsis thali-ana)[7]中相繼發現了類似的突變體。
2 植物滯綠突變體的分類
根據Thomas等[8]的研究,將植物滯綠突變體分為5種類型。A型:突變體和野生型植株的葉綠素降解速率和光合速率基本一致,但突變體衰老起始比較晚;B型:葉綠素降解和光合作用下降起始時間相同,但是滯綠突變體降解的速率變慢;C型:葉綠素降解受到抑制,葉綠素含量直至葉片衰老后期始終保持相對穩定,與野生型相同;D型:遭遇突發的自然災害,造成葉片壞死,葉綠素被永久固定在葉片當中,光合作用停止并導致植株死亡;E型:突變體葉片相比野生型在成熟后期依舊保持較高的葉綠素含量。
此外,上述5種類型的滯綠突變體根據其植株衰老的起始時間和衰老進程的快慢,又可以分為功能型和非功能型2種基本類型。其中,A類和B類表型都能夠延緩植株衰老,屬于功能型的滯綠突變體(Functional stay-green?mutant),如果將功能型的滯綠突變體的基因轉入其他農作物中,可能會提高其生產能力和生物產量,Gan等[9]利用轉基因技術獲得1個煙草滯綠突變體,其植株的生物產量和種子產量分別增長了40%和52%;C、D、E類型中滯綠突變體表型和植株衰老的起始時間和速率都沒有顯著的相關性,屬于非功能型持綠突變體(Non-func-tional stay-green mutant)。
3 水稻滯綠突變基因克隆
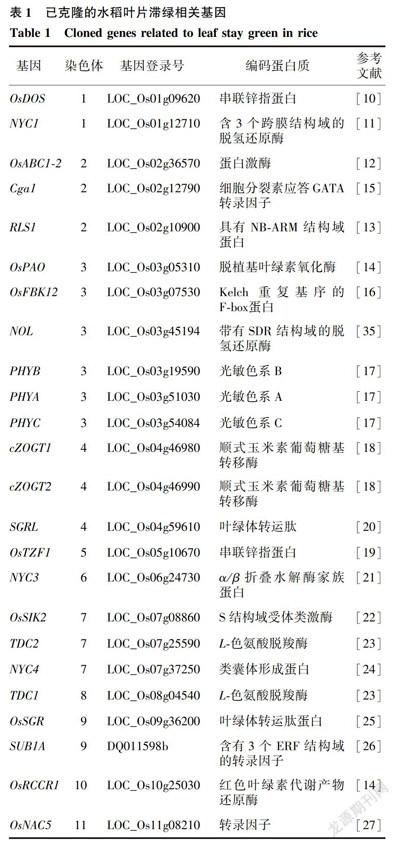
植物葉片中葉綠素分解代謝途徑發生突變,常會導致植物生長后期的滯綠表型,突變后葉片中葉綠素的降解明顯延緩或受阻,由于具有容易觀察的表型,滯綠突變體被廣泛用來研究植物的葉片衰老、果實成熟和葉綠素降解。目前水稻中已克隆的與葉片滯綠相關的基因有24個:ODOS、OABC1-2、NYC1、Cga1、RLS1、OPAO、OFBK12、NOL、PHYB、PHYA、PHYC、ZOGTl、Z0GT2、SGRL、OTZF1、NYC3、OSIK2、TDC2、NYC4、TDC1、OSGR、SUB1A、
ORCCRI、ONAC5(表1)[10-27]。
其中已經克隆到10個水稻滯綠突變基因與葉綠體發育及葉綠素降解途徑相關,分別是OSGR、SGRL、NYC1、NOL、RLS1、NYC3、OPAO、ORCCRI、OABC1-2、NYC4。
OsSGR是Jiang等[25]通過γ射線輻射水稻品種日本晴發現的1個與水稻葉綠素降解途徑相關的基因,該基因被定位于水稻第9染色體,編碼1個高度保守的蛋白質,是具有水溶性的轉運肽,亞細胞定位于類囊體膜上,在轉錄水平影響葉綠素的降解。Cha等[28]研究發現OsSGR的功能與葉綠素降解調控有關,通過激發多個葉綠素降解酶(例如NYC、PPH、RCCR PAO)等直接與LHCPII(light-harvestingcomplex II,LHCPII)結合,在類囊體膜上形成SGR-LHCPII復合物,誘導LHCPII降解,促進葉綠素的降解。Jiang等[29]通過暗誘導水稻衰老的葉片,0sSGR基因上調表達,這說明OSGR與植株的衰老是密切相關的,同時過量表達OSGR基因能使葉片中類囊體片層結構減少,葉片黃化,葉綠素含量也減少,加速葉綠素的降解。此外OSGR基因不僅存在于低等植物中,同時也存在于多種高等植物中,例如胡椒[30]、擬南芥[31]、豌豆[32]和番茄133]中。水稻SGRL是OSGR的同源基因,通過氨基酸序列的比對顯示,兩者的氨基酸序列具有高度的同源性,體現在氨基酸序列的中間區域都含有1個高度保守的區域,不同之處在于OSGR編碼氨基酸序列C端具有1個半胱氨酸的結構域,而SGRL不具有[34]。
Kusaba等[1]在水稻中發現另1個滯綠突變體基因NYC1,突變體在葉片衰老過程中一直保持綠色。圖位克隆將NYC1定位于第1染色體,它編碼1個帶有3個跨膜結構域的短鏈脫氫還原酶。通過電鏡觀察突變體葉片中的葉綠體,發現即使在葉片衰老后期也能觀察到大而密的葉綠體基粒。雖然NYCI編碼的蛋白質在體外不具有葉綠素b還原酶的活性,但另外1個滯綠基因NOL編碼的蛋白質具有葉綠素b還原酶的活性,所以Kusaba推斷NOL和NYC12個基因編碼具有不同功能的葉綠素b還原酶。進一步研究發現NYC和NOL都定位于類囊體膜上,兩者在體外可以互作,只有當NYC和NOL形成復合體的時候,才可以行使葉綠素b還原酶的功能,催化葉綠素b還原成葉綠素a,同時催化LHCPII的降解[35]。當NYC1突變后,葉綠素b和LHCPII以及類囊體基粒的降解都被抑制,不能與NOL發生結合,因而葉片一直保持綠色,說明NYC1和NOL兩者在調節植物葉片葉綠素b降解和LHC-PII降解中發揮重要作用。
Morita等[21]利用電離輻射獲得了NYC3突變體。圖位克隆發現該基因位于水稻第6染色體著絲粒附近,編碼1個ax/B折疊水解酶家族蛋白,可能是葉綠素酶,但沒有葉綠素酶的活性。NYC3在正常衰老葉片中的表達量很低,而在暗誘導后葉片中表達量很高,在其他非光合組織中如根部也有少量表達。NYC3突變體在黑暗誘導衰老葉片中葉綠素a和葉綠素b的含量比野生型高,其他參數如F./F和細胞膜離子滲漏等指標都下降,說明NYC3是1個非功能型持綠突變體。NYC3突變體表型特征與OSGR突變體類似,但NYC3/ossgr雙突變體在葉片衰老后期滯綠表型沒有顯著增強。
Jiao等[13]發現水稻滯綠基因RLS1,該基因被定位于水稻第2染色體上,編碼1個含有NB-ARM結構域的蛋白,該基因在水稻葉片衰老過程中參與自噬調節的葉綠體降解途徑,暗誘導以后,RLSI基因上調表達。OPAO編碼1個脫鎂葉綠素a氧化酶,它在植株中是組成型表達,通過ABA能夠誘導植株成熟,研究發現OSGR和OsPAO同時都是上調表達的,而且兩者都受到細胞分裂素的抑制,敲除OPAO基因后會使得轉基因植物快速死亡[14]。ORCCR1編碼1個葉綠素代謝產物還原酶,在葉片衰老的過程中表達上調,敲除后在水稻的葉片上會出現類病斑而導致植株死亡[14]。OABC1-2是Gao等[12]在水稻品種dongjin中發現的T-DNA插入突變體,該基因定位于水稻第2條染色體上,編碼1個蛋白激酶,暗誘導可以顯著抑制該基因的表達,過表達OABC1-2卻可以提高植株對黑暗誘導的脅迫響應能力。
Yamatani等[24]利用碳粒子束獲得了另一個水稻滯綠突變體,定名為NYC4,圖位克隆將該基因定位于第7染色體,為擬南芥THF1的同源基因[36],而THF1編碼1個多功能蛋白,參與植物體內糖信號轉導、抗病和高光馴化等過程[37-38]。NYC4編碼1個類囊體形成蛋白THF1,主要控制葉綠體中類囊體的形成,在葉綠素降解過程中起重要作用。對突變體進行暗處理后受衰老誘導且與葉綠素降解相關的基因如OSGR、NYC3、NYC1、NOL、ORCCR1、OPAO以及其他衰老誘導基因Oh36都得到上調表達,表明NYC4體內的衰老進程并未受阻,NYC4是非功能型突變體。然而與其他滯綠突變體如NYC1、OSGR、NOL和NYC3不同的是,在衰老的過程中NYC4的葉綠素熒光參數如F、/F與野生型相比,維持在較高水平,且PSII亞基的穩定性也比其他非功能型突變體的好。
4 展望
植物葉片的衰老和滯綠表型是植物進化中形成的生態適應性,也是植物生長和繁殖的重要過程,具有重要的生物學意義。滯綠突變體是研究植物光合作用、葉綠素代謝以及植物早衰和抗逆境重要的材料來源,因此對植物滯綠表型的研究可以深入闡明葉片中葉綠素代謝途徑與光合作用的相關性。
研究發現水稻籽粒灌漿后期絕大多數的碳水化合物來自于水稻植株倒三葉的光合作用產物,這表明水稻上部功能性葉片的早衰會直接影響水稻的灌漿結實,陸定志等[39]認為水稻功能性葉片每推遲1d衰老,生物產量可以提高1%,因而植物的滯綠表型對產量和品質具有很大的促進作用。目前通過突變體以及基因工程技術已經分離克隆到水稻相關的滯綠基因達20多個,但大多數都是非功能型的突變體,現在能直接用于水稻分子育種的基因只有SNU-SG140。SNU-SG1是在粳稻中發現的滯綠突變體基因,該突變體在水稻成熟后期葉片一直保持綠色,并且植株的光合作用能力依舊很強,是目前發現的唯一1個具有育種利用價值的滯綠突變體[41]。研究發現在同樣的環境下,SNU-SGl突變體較其他高產品種葉片中含氮量更高,表明這種功能型的滯綠突變體在水稻成熟后期葉綠素降解的速率緩慢,光合作用時間更長,根系能夠高效吸收營養[42],
筆者所在課題組于2014年在中熟中粳稻鹽稻8號提純復壯的試驗田中發現1株衰老明顯延緩的滯綠突變體。經連續多年的種植,表型穩定遺傳,在自然條件下,突變體在苗期、分蘗期、灌漿初期的表型與野生型鹽稻8號無顯著差異,但在灌漿后期葉色仍保持濃綠,尤其是千粒質量極顯著高于野生型。目前我們已將該基因定位在第4染色體遺傳距離為4.6cM的范圍內,此定位區間內沒有已報道的與水稻葉綠素代謝相關的基因。同時也以突變體為親本配置了大量雜交組合,以期為培育高產水稻品種提供種質資源。隨著水稻滯綠基因功能研究的深入,植物的滯綠機制將會被進一步詳細闡明,同時利用分子標記輔助選擇將有利基因進行聚合育種,在農業生產上將會具有更廣闊的應用前景。參考文獻:
[1]黃國勤,彭劍鋒.水稻早衰的原因及其防治措施[J].現代農業科技,2007(10):130.
[2]THOMAS H.Sid:a mendelian locus controlling thylakoid membrane disassembly in senescing leaves of Festuca pretenses [J].Theoretical & Applied Genetics,1987,73(4):551-555.
[3]SMITH P G.Inheritance of brown and green mature fruit color inpeppers[J].Journal of Heredity,1950,41(5):138.
[4]VICTOR D M,CRALLE H T,MILLER F R.Partitioning of 14C-Photosynthate and biomass in relation to senescencecharacteristicsof sorghum[J].Crop Science,1989,29(4):1049-1053.
[5]MONDAL W A,CHOUDHURI M A.Comparison of phosphorus mobilization during monocarpic se nascence in rice cultivars with sequential and non-sequential leaf senescence[J].Physiologia Plantarum,2010,65(3):221-227.
[6]CRAFTSBRANDNER S J,LEGGETTJ E,SUTTON T G,et al.Effect of root system genotype and nitrogen fertility on physiological differences between burley and flue-cured tobacco.I.single leaf measurements 1[J].Crop Science,1987,27(3):535-539.
[7]ZACARIAS L,REID M s.Role of growth regulators in the senescence of Arabidopsis thaliana leaves[J].Physiologia Plantarum,1990,80(4):549-554.
[8]THOMAS H,HOWARTH CJ.Five ways to stay green[J].Journal of Experimental Botany,2000,51:329-337.
[9]GAN S,AMASINO R M.Inhibition of leaf senescence by autoreg-ulated production of cytokinin[J].Science,1995,270(5244):1986-1988.
[10]KONG Z,LI M,YANG W,et al.A novel nuclear-localized CCCH-Type zinc finger protein,OsDOS,is involved in delaying leaf senescence in rice[J].Plant Physiology,2006,141(4):1376.
[11]KUSABA M,ITO H,MORITA R,et al.Rice NON-YELLOW COLORING1 is involved in light-harvesting complex II and granadegradation during leaf senescence[J].The Plant Cell Online,2007,19(4):1362-1375.
[12]GAO Q,YANG Z,ZHOU Y,et al.Characterization of an Abe I kinase family gene OsABCI-2,conferring enhanced tolerance to dark-induced stress in rice[J].Gene,2012,498(2):155-163.
[13]JIAOB B,WANG J J,ZHU X D,et al.A novel protein RLS1 with NB-ARM domains is involved in chloroplast degradation during leaf senescence in rice[J].Molecular Plant,2012,5(1):205-217.
[14]TANG Y,LI M,CHEN Y,et al.Knockdown of OsPAO and OsRCCR1 cause different plant death phenotypes in rice[J].Jourmal of Plant Physiology,2011,168(16):1952-1959.
[15]HUDSON D,GUEVARA D R,HAND A J,et al.Rice cytokinin GATA transcription Factor1 regulates chloroplast development and plant architecture[J].Plant Physiology,2013,162(1):132-144.
[16]CHEN Y,XU Y,LUO W,et al.The F-box protein OsFBK12 targets OsSAMSI for degradation and a facts pleiotropic phenotypes,including leaf senescence,in rice[J].Plant Physiology,2013,163(4):1673-1685.
[17]JUMTEE K,0KAZAWA A,HARADA K,et al.Comprehensive metabolite profiling of phyA phyB phyC,triple mutants to reveal their associated metabolic phenotype in rice leaves[J].Journal ofBioscience & Bioengineering,2009,108(2):151-159.
[18]KUDO T,MAKITA N,KOJIMA M,et al.Cytokinin activity of cis-Zeatin and phenotypic alterations induced by over expression of putative cis-Zeatin-O-glucosyl transferase in rice[J].Plant Physiology,2012,160(1):319-331.
[19]JAN A,YAMAGUCHI-SHINOZAKI K.OsTZF1,a CCCH-Tan-dem zine finger protein,confers de layed senescence and stress tolerance in rice by regulating stress-related genes[J].Plant Physiology,2013,161(3):1202-1216.
[20]RONG H,TANG Y,ZHANG H,et al.The stay-green rice like(SGRL)gene regulates chlorophyll degradation in rice[J].Journal of Plant Physiology,2013,170(15):1367-1373.
[21]MORITA R,SATO Y,MASUDA Y,et al.Defect in non-yellow coloring 3,an alpha/beta hydrolase-fold family protein,causes astay-green phenotype during leaf senescence in rice[J].PlantJournal,2009,59(6):940-952.
[22]CHEN LJ,WURIYANGHAN H,ZHANG Y Q,et al.An S-Do-main receptor-like kinase,OsSIK2,confers abiotic stress to leranceand delays dark-induced leaf senescence in rice[J].Plant Physiology,2013,163(4):1752-1765.
[23]KANG K,KIM Y S,PARK S,et al.Senescence-induced serotonin biosynthesis and its role in delaying senescence in rice leaves[J].Plant Physiology,2009,150(3):1380-1393.
[24]YAMATANI H,SATO Y,MASUDA Y,et al.NYC4,the rice or-tholog of Arabidopsis THF1,is involved in the degradation of chlo-rophyll-protein complexes during leaf senescence[J].Plant Journal,2013,74(4):652-662.
[25]JIANG H,LI M,LIANG N,et al.Molecular cloning and function analysis of the stay green gene in rice[J].Plant Jourmal,2007,52(2):197-209.
[26]FUKAO T,YEUNG E,BAILEYSERRES J.The submergence tolerance gene SUB1A delays leaf sense cense under prolonged dark-ness through hormonal regulation in rice[J].Plant Physiology,2012,160(4):1795-1807.
[27]SPEROTTO R A,RICACHENEVSKY F K,DUARTEGL,et al.Identification of up-regulated genes in flag leaves during rice grainfilling and characterization of OsNAC5,a new ABA-dependent transcription factor[J].Planta,2009,230(5):985-1002.
[28]CHAK W,LEE Y J,KOH H J,et al.Isolation,characterization,and mapping of the stay green mutant in rice[J].Theoretical andApplied Genetics,2002,104(4):526-532.
[29]JIANG H,CHEN Y,LI M,et al.Over expression of SGR results in oxidative stress and lesion-mimic cell death in rice seedlings [J].Journal of Integrative Plant Biology,2011,53(5):375-387.
[30]EFRATI A,EYAL Y,PARAN I.Molecular mapping of the Chlorophyll retainer(cl)mutation in pepper(Capsicum spp.)and screening for candidate genes using tomato ESTs homologous to structural genes of the Chlorophyll catabolism pathway[J].Ge-nome,2005,48(2):347-351.
[31]RENG,AN K,LIAO Y,et al.Identification of a novel Chloroplast protein AtNYE1 regulating Chlorophyll degradation during leaf senescence in Arabidopsis [J].Plant Physiol,2007,144:1429-1441.
[32]AUBRY s,MANI J,HoRTENSTEINER S.Stay-green protein,defective in Mendel' s green cotyledon mutant,acts in dependent and upstream of Pheophorbide a oxygenase in the Chlorophyll catabolic pathway[J].Plant Mol Biol,2008,67:243-256.
[33]BARRY C S,MCQUINN R P,CHUNG M Y,et al.Amino acid substitutions in homologs of the STAY-GREEN protein are responsible for the green-flesh and chlorophyll retainer mutations of toma-to and pepper[J].Plant Physiology,2008,147(1):179-187.
[34]PILKINGTON S M,MONTEFIORI M,JAMESONP E,et al.The control of chlorophyll levels in maturing kiwifruit[J].Planta,2012,236(5):1615-1628.
[35]SATO Y,MORITA R,KATSUMA s,et al.Two short-chain dehydrogenase/reductases,NON-YEL LOW COLORING 1 and NYC1-LIKE,are required for chlorophyll b and light-harvesting complexII degradation during senescence in rice[J].The Plant Jourmal,2008,57(1):120-131.
[36]WANG Q,SULLIVAN R W,KIGHT A,et al.Deletion of the chloroplast-localized Thylakoid for mationl gene product in Arabi-dopsis leads to deficient thylakoid formation and variegated leaves[J].Plant Physiology,2004,136(3):3594-3604.
[37]KEREN N,OHKAWA H,WELSH E A,et al.Psb29,a conserved 22-kD protein,functions in the biogenesis of photosystem IIcomplexes in Synechocystis and Arabidopsis[J].The Plant CellOnline,2005,17(10):2768-2781.
?[38]WANGDI T,UPPALAPATIS R,NAGARAJS,et al.A virus induced gene silencing screen identifies a role for Thylakoid Formation1 in Pseudomonas syringae pv tomato symptom development in tomato and Arabidopsis[J].Plant Physiology,2010,152(1):281-292.
[39]陸定志,潘裕才,馬躍芳,等.雜交水稻抽穗結實期間葉片衰老的生理生化研究[J].中國農業科學,1988,21(3):21-26.
[40]張寶來.水稻葉片衰老的研究進展[J].天津農業科學,2013,19(4):19-24.
[41]ZHANG H.Quantitative trait loci associated with functional stay-green SNU-SG1 in rice[J].Molecules & Cells,2007,24(1):83-94
[42]FUJ D,YAN Y F,LEE B W.Physiological characteristics of a functional stay-green rice ‘ SNU-SG1’during grainilling period[J].Jourmal of Crop Science & Biotechnology,2009,12(1):47-52.

