庫德畢赤酵母包埋茶多酚工藝及穩定性研究
馬冉冉,張丹丹,徐瑩*,王君瑋,程淑敏
1(中國海洋大學 食品科學與工程學院,山東 青島, 266003) 2(中國動物衛生與流行病學中心,山東 青島, 266000)
微膠囊化是一種廣泛用于制藥工業的技術,近年來在食品工業中也開始廣泛應用[1]。微膠囊包封能夠賦予活性化合物一定程度的穩定性,其壁材可充當氧或其他分子的物理屏障,防止有害反應,同時還可以控制芯材的釋放[2]。由于微膠囊的穩定性和釋放性高度依賴于壁材的組成,目前已經使用了各種載體,包括環糊精、麥芽糖糊精、改性淀粉、樹膠、蛋白質和納米顆粒、膠束或脂質體[3]。但考慮到以上壁材有些可能存在化學試劑殘留,價格昂貴等問題,近年來發現一種容易獲得、成本低廉且安全無毒的酵母細胞,可作為新型微膠囊壁材[4]。酵母細胞含豐富的營養成分,它的磷脂膜可以表現為脂質體,細胞壁則是由β-1,3-葡聚糖網絡、甘露糖蛋白層和少量幾丁質組成,該壁能為細胞提供機械強度,并允許分子質量高達760 Da的分子自由擴散,而細胞膜是滲透分子的主要滲透屏障[5]。因此芯材可能包裹在細胞壁內部與細胞膜之間。同時酵母細胞的通透性較高,在包埋時有助于芯材的進入,將制備的微膠囊凍干后保藏,有利于芯材穩定的存儲。使用酵母細胞作為壁材的微膠囊制備方法一般需要借助于不同的滲透壓,使物質滲透到細胞壁進入到細胞內,從而可形成微膠囊。目前大部分壁材用于包裹疏水脂溶性的物質,如白藜蘆醇[6]、馬齒莧籽油[7]、魚油[8]。PARAMERA等[4]通過熒光顯微鏡,差示掃描量熱法和傅立葉變換紅外光譜證實,酵母細胞具有包埋姜黃素的可能性。在所有制備的微膠囊中,姜黃素被整合到質膜雙層中,但也與細胞壁網絡的成分相互作用。而國內外關于包埋水溶性物質的報道甚少。
茶多酚(tea polyphenols,TP)是從茶葉中提取的天然多酚類物質,是一種天然的水溶性食品抗氧化劑[9],同時具有抑菌、絡合金屬離子[10]、抗癌和降脂等多種功效。TP的脂溶性較差,在存在光照、酸性或堿性溶液、氧化劑等條件下穩定性較差,容易被氧化,從而限制了TP的應用。因此利用微膠囊技術將TP包裹在壁材內可以防止氧化劑、水分以及環境中其他成分對其造成破壞[11],近年來相關研究也日益增多。盡管目前有少量報道TP微膠囊的制備,但尚不清楚微膠囊化TP的穩定性是否可以得到改善。有研究以納米顆粒為載體,將TP包埋于納米粒子中,發現一定程度上可減緩胃腸道酶、微生物、電解質成分對TP的損害,從而達到有一定緩釋作用以及保護TP的目的[12]。有研究將多酚用于商業多孔膜上與鈾形成超分子網絡以用做從海水中提取鈾的高效且經濟上可行的材料[13]。GüLSEREN等[14]使用大豆磷脂和牛奶磷脂制備脂質體包埋TP,所制備的納米粒子提高了游離TP的穩定性,并且包封的TP具有緩釋作用。WANG等[15]為了提高TP的穩定性,采用噴霧干燥法,以鄰苯二甲酸羥丙基甲基纖維素為涂料,將其微膠囊化。對所獲得的微膠囊的性質研究發現,儲存穩定性和抗氧化能力得到顯著提高。從而可得,微膠囊化不失為拓寬TP在食品工業中儲存和應用的好方法。
本研究選用實驗室保藏的庫德畢赤酵母(PichiakudriavzeviiA16)來作為新型微膠囊壁材,探究以其為載體包埋水溶性TP的可行性。同時確定了有效包封的最佳優化條件,并對包埋過程和釋放過程進行了研究。最后,還探究了微膠囊的貯藏穩定性。旨在提高TP等環境敏感性功能成分的生物穩定性,拓展其在食品工業中的應用。
1 材料與方法
1.1 材料與試劑
TP(純度98%):索萊寶生物科技有限公司;酵母菌:庫德畢赤酵母菌(PichiakudriavzeviiA16),本實驗室保藏;福林酚、Na2CO3、沒食子酸、NaCl、HCl、NaOH、Fe2(SO4)3:國藥集團化學試劑有限公司;胃蛋白酶、胰蛋白酶:諾維信(中國)有限公司;實驗用水均為去離子水。
1.2 儀器與設備
QYC-2102C振蕩培養箱,上海福馬設備有限公司;Nicolet iS10傅里葉紅外光譜儀,美國Thermo Fisher公司;CX21FS1,日本Olympus公司;JEM-1200EX,日本JEOL公司;真空冷凍干燥機,美國Sim公司;UV-2102型紫外分光光度計,上海尤尼柯公司。
1.3 實驗方法
1.3.1 TP的檢測方法
TP測定參照GB/T 31740.2—2015 《茶制品第2部分:茶多酚》[16]的方法,按公式(1)計算:
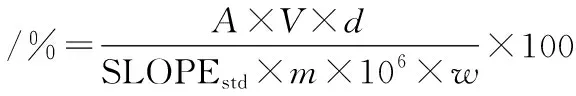
(1)
式中:A-樣品測試液吸光度;V-樣品溶液體積,100 mL;d-稀釋因子;SLOPEstd-沒食子酸標準曲線的斜率;m-樣品質量,g;w-樣品干物質含量,%。
1.3.2 茶多酚酵母微膠囊的制備
1.3.2.1 酵母細胞壁材的制備
將酵母細胞經斜面活化24 h,然后接種至液體YEPD培養基中繼續培養24 h,再繼續擴大培養24 h,離心得到酵母細胞,用超純水清洗3遍后離心得到酵母菌泥,備用。
將收集到的酵母細胞按固液比1∶20加入到3%(質量分數) NaCl,調至pH 5.5,于54 ℃,150 r/min水浴振蕩20 h,離心(6 000 r/min,10 min)。質壁分離完成后,水洗3次,冷凍干燥,得到酵母菌壁材。
1.3.2.2 茶多酚酵母微膠囊的制備方法
稱取預處理的酵母細胞與TP樣品,加入去離子水,恒溫振蕩,離心,收集細胞,水洗3次,再次離心收集酵母細胞,冷凍干燥,得到包埋茶多酚的酵母微膠囊產品即茶多酚微膠囊(microcapsules of tea polyphenols,MTPs)。
1.3.3 包埋率的計算
包埋率是指微膠囊產品中被包埋的芯材含量與微膠囊產品中總的芯材含量之比。它是衡量包埋效果的指標。包埋率計算公式(2)如下:
包埋率/%=
(2)
1.3.4 MTPs制備工藝的研究
單因素實驗:以包埋率為指標,研究壁芯比例、包埋溫度和包埋時間等單因素對酵母細胞包埋TP的影響。
壁芯比例:分別按壁芯比例1∶2,1∶1,2∶1,4∶1,6∶1,8∶1,10∶1 (質量比)稱取一定量預處理的酵母細胞壁材與TP樣品,加入30 mL去離子水,在28℃條件下恒溫振蕩4 h,離心(4 000 r/min,5 min),測定包埋率。
包埋溫度:按壁芯比例8∶1(質量比)稱取一定量預處理的酵母細胞壁材與TP樣品,加入30 mL去離子水,分別在20、28、36、44、52、60℃條件下恒溫振蕩4 h,離心(4 000 r/min,5 min),測定包埋率。
包埋時間:按壁芯比例8∶1(質量比)稱取一定量預處理的酵母細胞壁材與TP樣品,加入30 mL去離子水,在28℃條件下恒溫振蕩0、1、2、4、6、8 h,離心(4 000 r/min,5 min),測定包埋率。
響應面實驗:為得到制備MTPs的最佳工藝條件,在單因素試驗結果的基礎上,以(A)壁芯比例(6∶1,8∶1,10∶1)、(B)振蕩時間(2、4、6 h)和(C)溫度(20、28、36 ℃)為試驗因素及水平,以包埋率為響應值,采用響應面分析法設計3因素3水平Box-Behnken實驗。
1.3.5 傅里葉變換紅外光譜(fourier transform infrared spectrometer,FTIR)
將2 mg的TP樣品、凍干的酵母細胞和MTPs粉末碾磨均勻,使其分布在200 mg的KBr中壓片。壓片后放置在傅里葉變換紅外分光鏡中測定。
1.3.6 MTPs的形態觀察
1.3.6.1 電子顯微鏡觀察
分別將質壁分離后的酵母細胞和MTPs經Fe2(SO4)3染色后固定,于普通電子顯微鏡(electron microscope,EM)下觀察其微觀形態。
1.3.6.2 透射電子顯微鏡觀察
對包埋前后微膠囊微觀結構進行透射電子顯微鏡(transmission electron microscope,TEM)觀察。分別將質壁分離后的酵母細胞和MTPs用4%(體積分數)的戊二醛固定6 h以上,經固定與沖洗后,完成純白膠包埋,烘干。取出膠粒,經修塊和超薄切片后在80 kV加速電壓下進行觀察。使用Nano Measurer 1.2測量200個樣品中壁膜間隙的大小以及通過SPSS軟件進行統計學分析。
1.3.7 MTPs的釋放
參照文獻的方法[17],將MTPs在模擬胃腸液中的釋放來模擬體外消化過程。根據參考文獻[18]描述制備模擬胃液和腸液,并進行一些修改。模擬胃液:3.2 g胃蛋白酶,7 mL HCl并調至pH(1.2±0.1),定容至1 000 mL。模擬腸液:6.80g KH2PO4溶解于水中并定容至500 mL,190 mL 0.20 mol/L NaOH以及400 mL蒸餾水,10.00 g胰蛋白酶,調pH(7.5±0.1)并定容至1 000 mL。稱取一定量MTPs樣品于(37±0.5) ℃,150 r/min恒溫水浴振蕩,在模擬胃液、腸液中消化時間分別為10 h,每隔一段時間取樣,測定MTPs的釋放情況。
1.3.8 MTPs的貯藏穩定性分析
1.3.8.1 光照對MTPs穩定性的影響
將MTPs樣品分別置于光照和黑暗條件下,每隔5 d取樣,每次通過測定釋放TP的含量來計算剩余TP的含量,公式(3)如下:

(3)
1.3.8.2 相對濕度對MTPs穩定性的影響
將MTPs樣品分別置于飽和MgCl2溶液(RH=(32.78±0.16)%),Mg(NO3)2溶液(RH=(52.89±0.22)%)和KCl溶液(RH=(84.34±0.26)%)[19],每隔5 d取樣,每次通過測定釋放TP的含量來計算剩余TP的含量,計算方法同公式(3)。
2 結果與分析
2.1 MTPs包埋工藝
2.1.1 單因素研究
壁芯比例、溫度和包埋時間對包埋率的影響見圖1。隨著壁芯比例的增大,包埋率隨之增大,最后趨向于穩定,當壁芯比例為8∶1時,TP包埋率達到68.75%,而殷佳雅等[20]用釀酒酵母包埋茶多酚其包埋率最高能達到35.71%。說明庫德畢赤酵母是可用且效率較高的新型微膠囊壁材。隨著溫度的升高,微膠囊的包埋率先升高后降低,在28 ℃達到最大,溫度過高,分子運動加快,促進TP的細胞內擴散,可另一方面也會使酵母細胞膜通透性增大,導致TP的溶出,包埋率也會隨之降低,同時TP氧化嚴重,溶液紅度增大。在振蕩時間為4 h左右,包埋率最大,而隨后包埋率又逐漸降低,可能是因為在包埋的過程中有一部分TP通過物理吸附作用吸附在了細胞壁上,隨著時間的增長,TP與細胞壁的弱相互作用[21],導致一部分吸附稀疏的TP脫離酵母菌,回到溶液中。
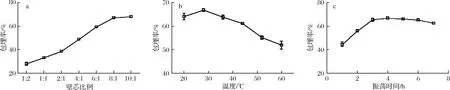
a-不同壁芯比例的包埋率;b-不同溫度下的包埋率;c-不同振蕩時間的包埋率圖1 不同因素對包埋率的影響Fig.1 The influence of different factors on the embedding rate
2.1.2 響應面優化
根據表1結果利用Design Export(8.0.6版)軟件,可得二次多項回歸方程為:
Y=68.48+3.89×A+0.22×B-0.82×C+0.048×A×B+0.36×A×C+0.21×B×C-4.38×A2-1.49×B2-2.81×C2
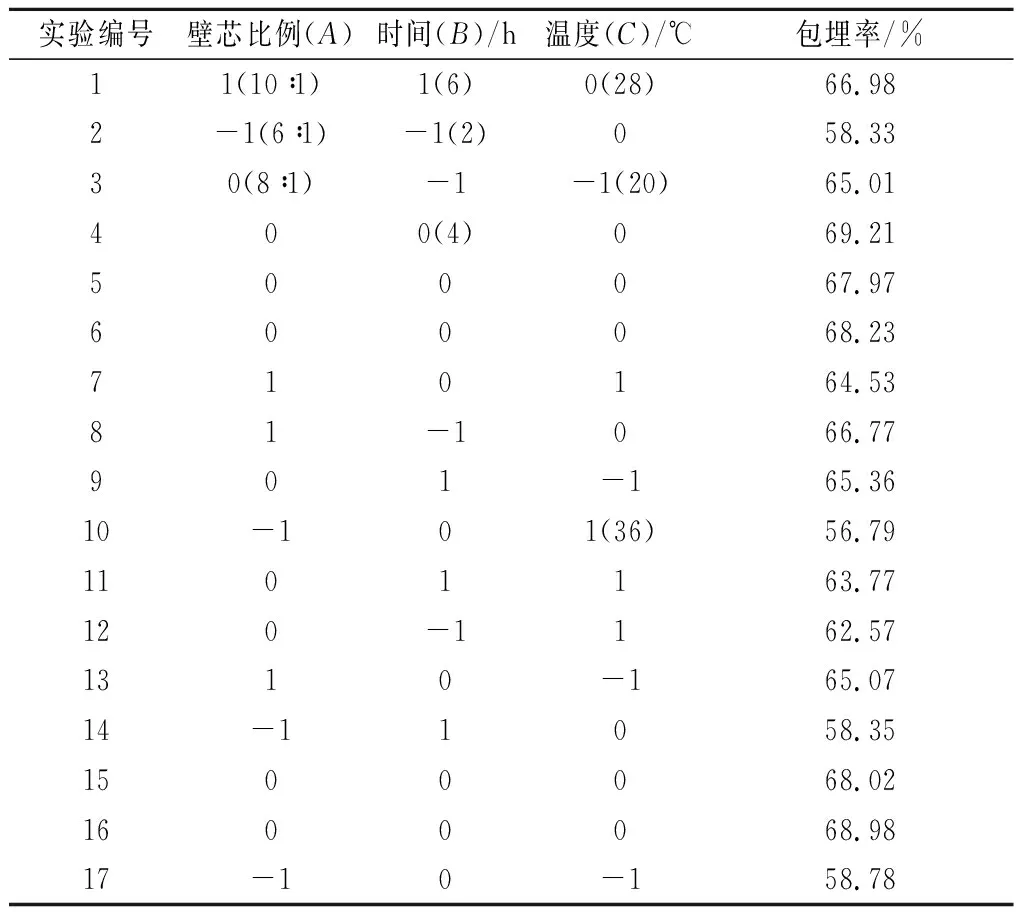
表1 響應面設計及結果Table 1 Design and results of response surface methodology experiment
注:“**”表示差異極顯著(P<0.01);“*”表示差異顯著(P<0.05)。
經響應面法優化得到酵母菌包埋TP的最佳工藝條件為:壁芯比例為8.88 ∶1,溫度27.08℃,時間為4.15 h,此時包埋率可達到69.39%。考慮實際操作的方便性和可行性,將理論值修訂為:壁芯比例為9∶1, 溫度28 ℃,時間為4 h。在此條件下進行驗證實驗,實測包埋率為(68.12±0.35)%,與理論值較接近,說明優化得到的工藝條件與實際情況擬合度較好,驗證了模型的可靠性。
2.2 傅里葉變換紅外光譜
圖2是MTPs、酵母菌壁材、TP以及TP與酵母菌物理混合物的傅里葉紅外光譜圖。從圖中可以看出TP在3 342 cm-1處左右有個大且寬的特征吸收峰,是O-H的伸縮振動;1 692 cm-1是羰基C=O的伸縮振動;在1 610、1 517、1 463 cm-13個“指峰”是苯環骨架C=C伸縮振動,1 314 cm-1是多種烷烴-CH2的疊加峰,在1 000~1 300 cm-1是C-O-C,C-OH,C-C3的振動,650~900 cm-1是芳香取代基的面外變形振動吸收峰。在酵母菌的光譜圖中,1 657cm-1處的吸收峰為酰胺Ⅰ帶,是C=O的伸縮振動,1 548 cm-1的吸收峰是酰胺Ⅱ帶,是N-H的彎曲振動和C-N的伸縮振動,1 244 cm-1是酰胺Ⅲ帶,是C-N的伸縮振動和N-H的彎曲振動引起的。
1 064 cm-1處的吸收峰是由酵母中的RNA、DNA或細胞壁中存在的碳水化合物或醇中的C-O伸縮振動引起的。圖3的結果顯示,MTPs與酵母菌壁材的圖譜高度一致,無明顯差異,并且沒有出現TP的特征峰,可能是TP與蛋白質主鏈的肽基-NH-CO,側鏈上的OH、NH2以及COOH以氫鍵的形式多點結合[22],發生了相互作用,而TP與酵母菌的簡單混合物中確實保留了TP的特征峰,因此可以看出TP確實包埋在了酵母菌內部,而并非只是二者的簡單混合[23]。
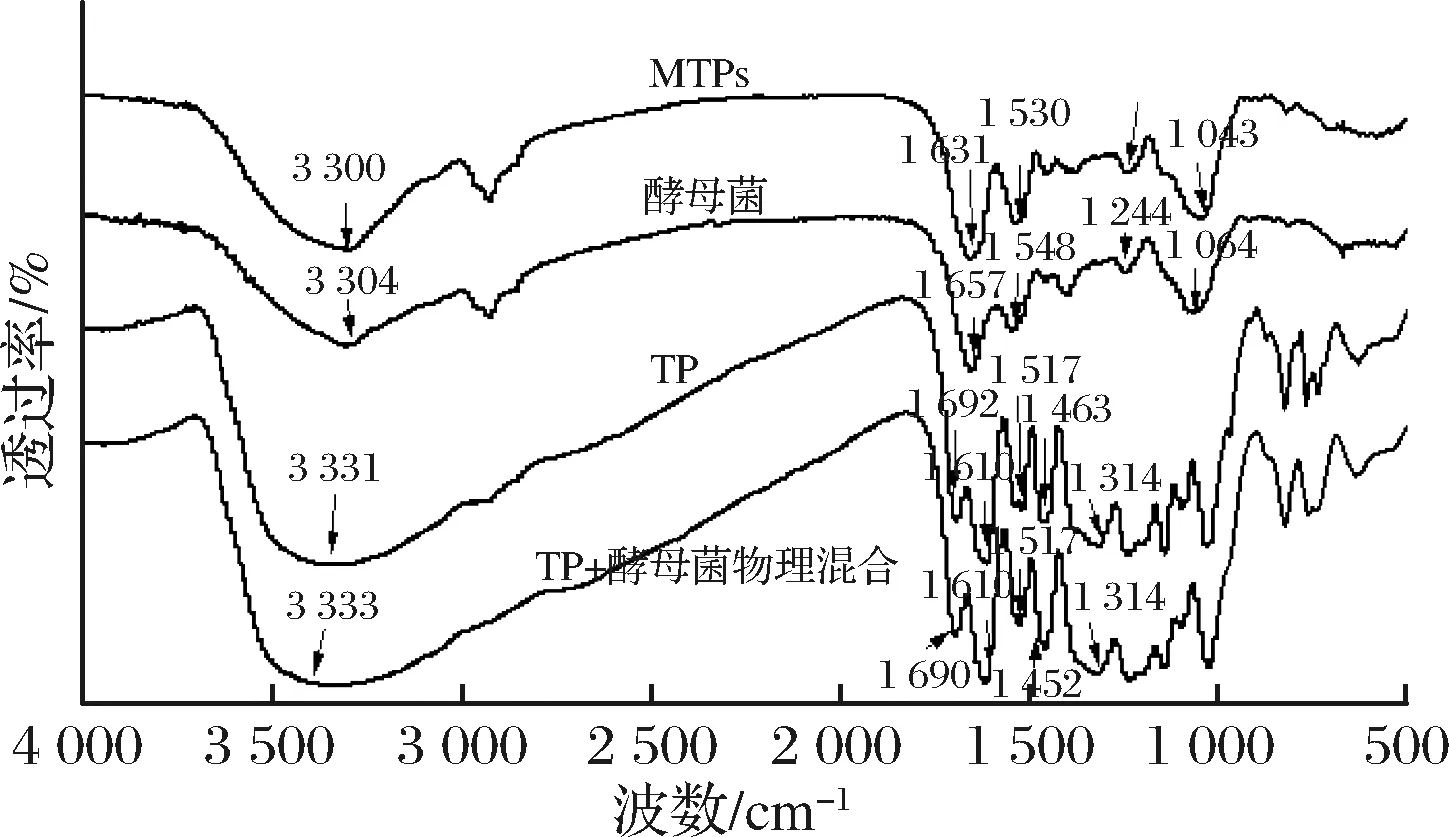
圖2 TP、酵母細胞、微膠囊的傅里葉紅外光譜圖Fig.2 FTIR of TP, yeast cells and MTPs
2.3 MTPs的形態觀察
2.3.1 電子顯微鏡觀察
使用電子顯微鏡觀察Fe3+染色后的酵母壁材與MTPs,如圖3-a、圖3-b所示。Fe3+與TP鄰二羥基結合,形成絡合物從而使之呈現深藍色[24]。由圖3-a與圖3-b對比可明顯觀察到酵母細胞發生了明顯的質壁分離,同時能看出在酵母細胞壁膜間隙顏色變深,即TP與Fe3+反應生成深藍色絡合物,因此可以得出TP已進入酵母細胞壁內,同時包埋過程也未明顯改變酵母細胞結構。
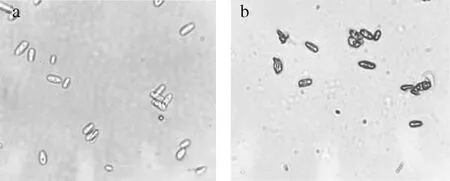
a-酵母壁材組(×2 000);b-MTPs組(×2 000)圖3 電子顯微鏡觀察酵母壁材和MTPsFig.3 EM of Pichia kudriavzevii A16 wall material and MTPs
2.3.2 透射電子顯微鏡觀察
對未包埋TP的酵母壁材(圖4-a,圖4-b)和MTPs(圖4-c,圖4-d)進行透射電鏡觀察。
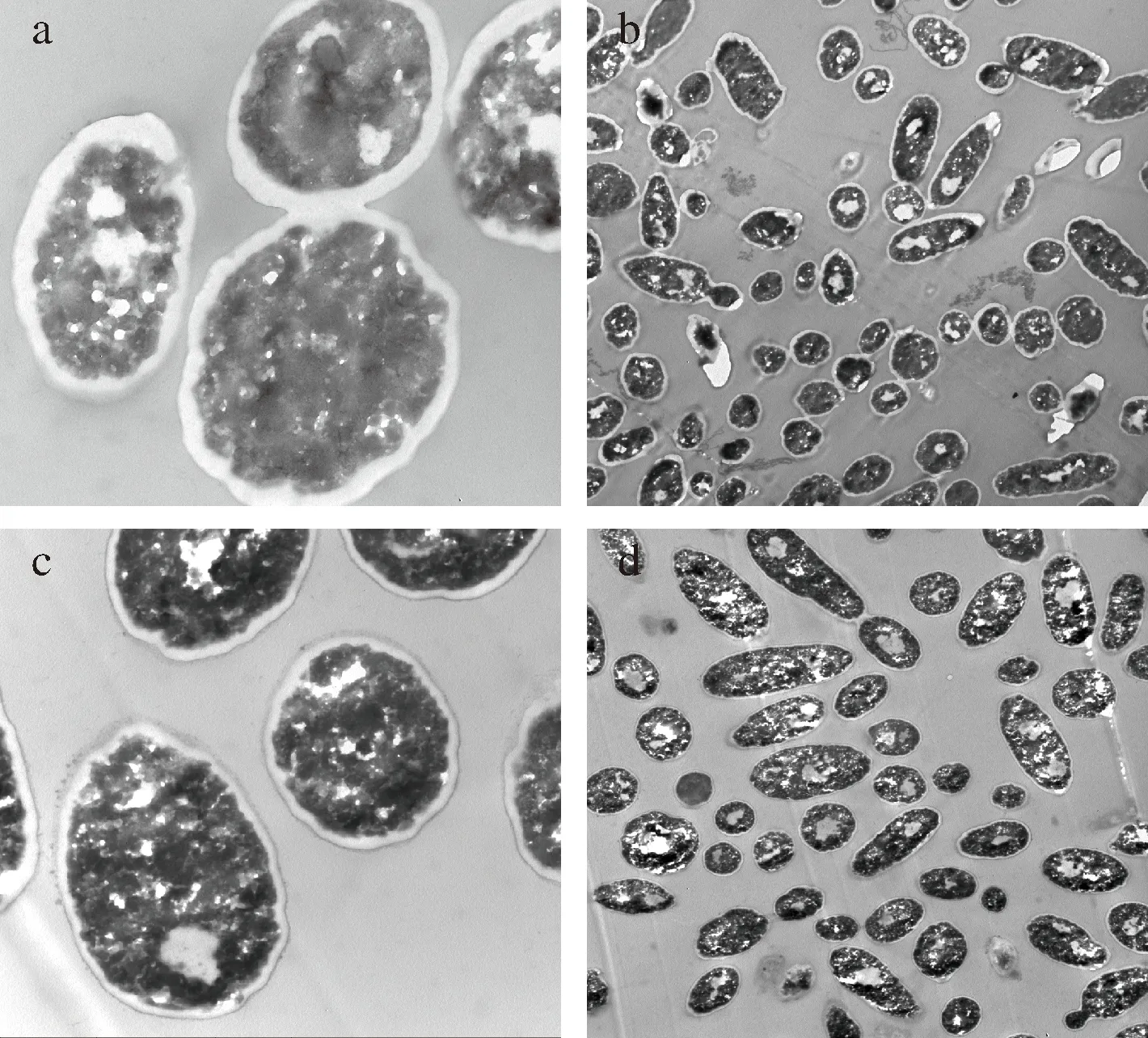
a-酵母壁材組(×30 000);b-酵母壁材組(×5 000);c-MTPs組(×30 000);d-MTPs組(×5 000)圖4 透射電鏡觀察酵母壁材和MTPsFig.4 TEM of Pichia kudriavzevii A16 wall materials and MTPs
由圖4-a可以看出,細胞壁與細胞膜之間界限明顯,說明酵母菌經過NaCl處理后發生了質壁分離;與圖4-a相比,圖4-c能明顯看出MTPs細胞膜與細胞壁之間的空隙減小,同時通過Nano Measurer 1.2測量了200個酵母細胞中壁膜間隙的大小以及SPSS軟件統計學分析得出,包埋前后間隙大小分別為(0.17± 0.03)、(0.11± 0.03)μm,說明TP主要被包埋在酵母菌細胞壁和細胞膜之間,與紅外圖譜結果相一致。由圖4-c和圖4-d可以看出,包埋TP后并沒有明顯改變酵母菌的結構,酵母菌起到了封裝TP的載體作用。
2.4 胃腸液模擬釋放
MTPs在體外模擬條件下的釋放曲線見圖5。由圖可知,在最初的1 h內,在胃液中釋放的比較快,在3 h趨于穩定,這也符合人體胃液消化的基本規律。在腸液中0~6 h TP的釋放率一直呈上升趨勢,并且在模擬腸液中的釋放率要高于在胃液中的釋放率。腸液pH值環境和酶的作用會改變MTPs結構,使TP更容易釋放。TAMIZHARASI等[25]也有相似的研究結果。6 h后釋放量相對平緩,釋放率最高能達到47.11%。累計在胃液與腸液中的釋放率能達到78.12%。
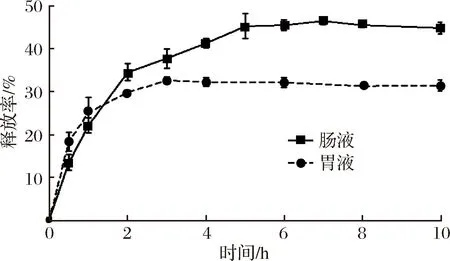
圖5 MTPs在模擬胃腸液中的釋放Fig.5 Release of MTPs in simulated gastric and intestinal fluids
2.5 MTPs的貯藏穩定性
2.5.1 光照對MTPs穩定性的影響
圖6表明了光照條件對MTPs貯藏穩定性的影響。
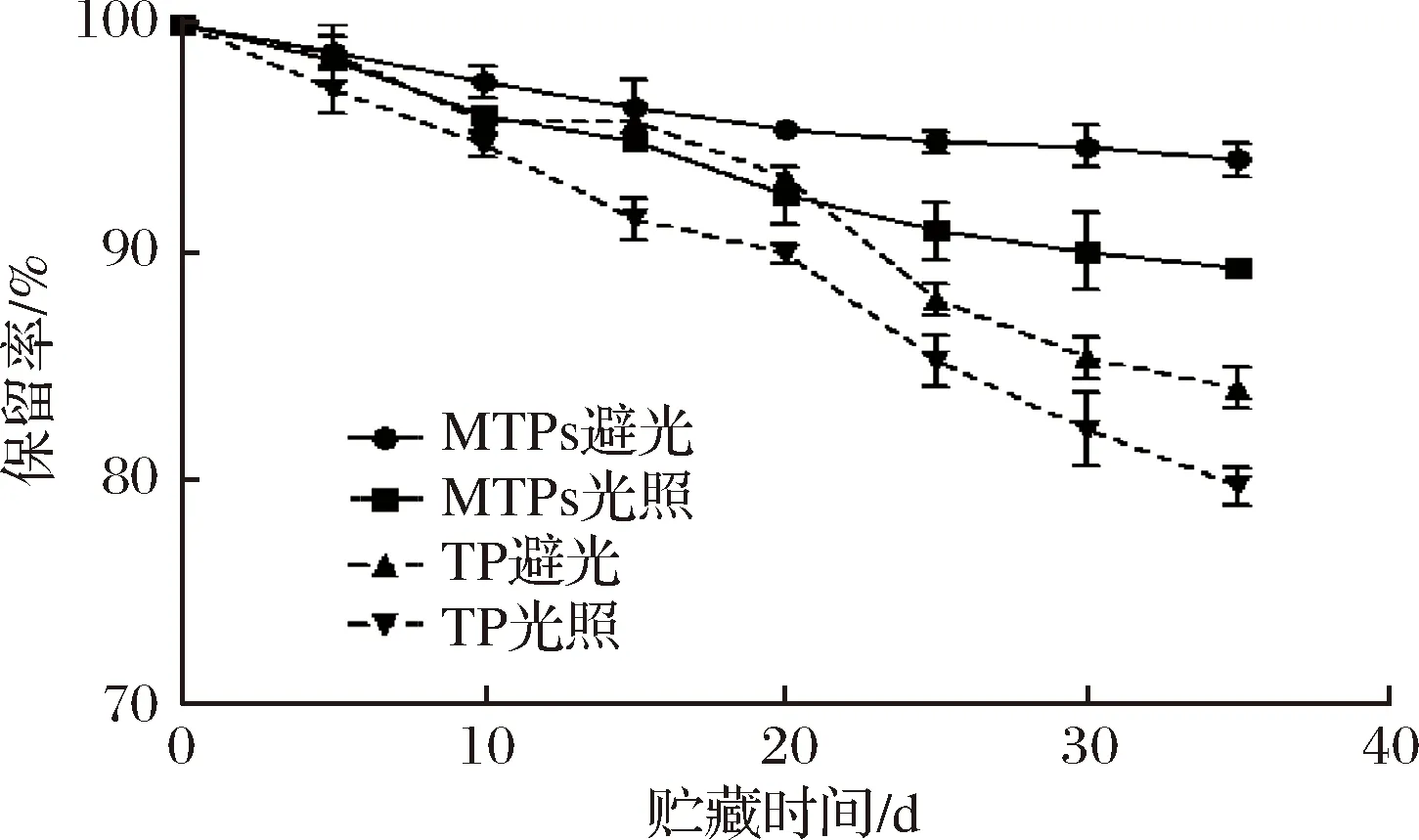
圖6 光照條件下TP及MTPs的保留率Fig.6 Retention rate of TP and MTPs under light or dark conditions
從圖6中可以看出,避光儲存條件能明顯提高TP以及MTPs的穩定性。同時酵母細胞一定程度上保護了TP不受光照的影響,在有光照條件下,貯藏35 d后,TP的保留率僅為79.33%,而MTPs的保留率為90.15%,這說明MTPs在一定程度上能保護TP,降低光照對TP的降解作用。曹龍奎等[26]也研究過微膠囊化玉米黃色素具有一定的光保護作用,明顯提高玉米黃色素的保留率。
2.5.2 相對濕度對MTPs穩定性的影響
相對濕度對MTPs穩定性的影響如圖7所示。在35 d后,MTPs在不同濕度下的保留率仍均在90%左右,明顯高于相同質量的TP的保留率,說明MTPs壁材料能在一定程度上保護TP減少其損失。且隨著相對濕度越大,TP以及MTPs的保留率都會隨之降低,35 d左右,MTPs在RH=(32.78±0.16)%下的保留率最高,能達到91.47%,相對于相同條件下的TP的保留率提高了約(13.40±0.89)%。王華[27]在研究VA微膠囊的貯存穩定性時表明,在低RH條件下穩定性比較好。因此適當降低濕度,保持干燥環境可以一定程度上保護TP,提高其保留率。
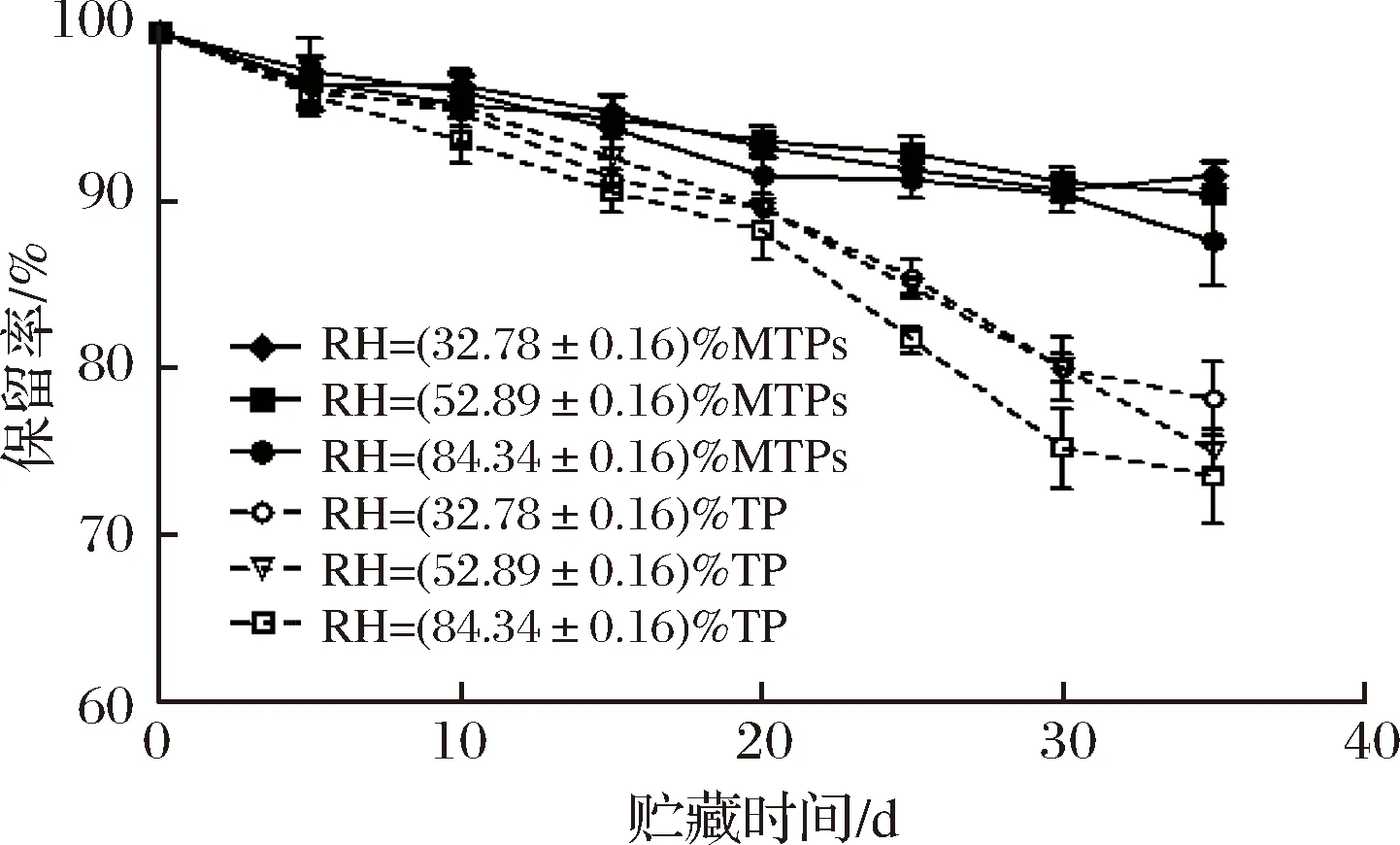
圖7 不同相對濕度下TP及MTPs的保留率Fig.7 Retention rate of TP and MTPs under different RH
3 結論
庫德畢赤酵母(PichiakudriavzeviiA16)作為壁材,能有效地包埋TP,起到了封裝TP的載體作用,在最優條件下即壁芯比例9 ∶1,包埋時間為4 h,以及包埋溫度28℃,MTPs的包埋率為(68.12±0.35)%。MTPs能有效地減緩光照和濕度對TP的不利影響。胃腸液模擬消化實驗表明MTPs總釋放率高于文獻報道的釋放率。本文探究了庫德畢赤酵母PichiakudriavzeviiA16作為新型微膠囊壁材包埋水溶性TP的可行性,為酵母的多重利用提供理論依據,同時也為解決生產中TP等環境敏感性成分的穩定性問題提供了重要參考。

