雌激素抑制淋巴細胞IL- 1β和IL- 6釋放并下調Cx40及Cx43水平
王 璐,王 愛,楊 瑞,張瑩瑩,倪 欣,于秀石,單莉婭,馬克濤
炎癥反應是常見的一個病理過程,當機體免疫反應狀態異常時,可有大量淋巴細胞浸潤,造成組織和細胞損傷而導致炎癥,淋巴細胞作為反映機體細胞免疫功能的重要指標在其中發揮著必不可少的作用[1]。課題組前期研究[2-3]表明,應用縫隙連接阻斷劑(gap junction inhibitory peptide,Gap27)后炎癥因子的釋放被顯著抑制,提示由連接蛋白(connexin,Cx)構成的縫隙連接通道在淋巴細胞介導的炎癥反應中發揮了重要作用。有研究[4-5]表明,縫隙連接通道介導免疫細胞間的電和化學信號交流,參與細胞因子的釋放以及炎癥反應過程。近年研究[6-7]顯示,雌激素(estrogen,E)除了可以促進和維持女性生殖器官和第二性征的發育以外,也通過調節免疫系統功能,進而抑制炎癥反應。因此,該研究假設 E抑制炎癥反應可能與淋巴細胞間連接蛋白的表達以及炎癥因子的釋放有關。
1 材料與方法
1.1 主要試劑及儀器
1.1.1試劑 ConA和E購自美國Sigma公司;APC anti- rat CD4和Per- cp anti- rat CD8a購自美國Biolegend公司;Anti- Connexin 40購自美國Santa Cruz Biotechnology公司;Anti- Connexin 43 抗體購自美國Abcam公司;Cx 40 FITC標記二抗和Cx 43 FITC標記二抗購自北京中杉金橋生物公司;KBM581培養基購自美國Corning公司;大鼠白細胞介素1β(interleukin 1β,IL- 1β)、IL- 6 ELISA檢測試劑盒購自杭州聯科生物技術有限公司;淋巴細胞分離液購自天津灝洋科技有限責任公司。
1.1.2儀器 CO2恒溫培養箱購自上海力申科學儀器有限公司;流式細胞儀購自美國BD公司;LSM510激光共聚焦顯微鏡購自德國CarlZeiss公司。
1.2 實驗動物實驗動物選取12周齡清潔級WKY雄鼠6只,體質量150~300 g,飼養環境的室溫控制在22~25 ℃、濕度50%~60%,購自北京維通利華實驗動物有限責任公司,動物合格證號:SCXK(京)2012- 0001。
1.3 方法
1.3.1細胞培養與分組 大鼠稱重,麻醉,采集腹主動脈血,3 500 r/min離心10 min,棄上清液,剩余血細胞根據密度梯度離心法分離淋巴細胞,于細胞間超凈臺無菌操作將分離的白色云霧狀淋巴細胞層吸出,細胞洗滌液洗滌2次,紅細胞裂解液裂解1次,1 800 r/min離心6 min,棄上清液,沉淀加入10%胎牛血清的KBM581進行培養。分為三組:空白組(Ctrl)、ConA組(10 μg/ml ConA干預48 h)和ConA+E組(1 μg/ml E預孵育24 h后加入10 μg/ml ConA共孵育48 h)。
1.3.2ELISA檢測培養基中IL- 1β和IL- 6水平 取出已干預好的細胞,1 800 r/min離心6 min,取上清液,應用ELISA技術檢測IL- 1β和IL- 6水平,操作步驟按照試劑盒說明書。
1.3.3流式細胞術檢測淋巴細胞上Cx40和Cx43的表達水平 取出已干預好的細胞,1 800 r/min離心6 min,棄上清液,PBS重懸細胞,設置陰性對照管和同型對照管,按照說明書分別加入相應流式表面抗體APC- CD4和 percp- CD8a,充分混勻后室溫避光孵育 30 min,洗滌后1 800 r/min離心6 min,棄上清液;固定破膜后分別孵育Cx40和Cx43一抗及二抗,37 ℃孵育30 min;洗滌后加入PBS重懸細胞,上機進行流式檢測。
1.3.4免疫熒光技術檢測淋巴細胞上Cx40和Cx43的表達及分布情況 取出已干預好的細胞,1 800 r/min離心6 min,棄上清液,PBS漂洗3次,固定,破膜,BSA 37 ℃封閉30 min,一抗于濕盒內37 ℃孵育2 h,PBS漂洗3次,二抗于濕盒內37 ℃孵育1 h,PBS漂洗3次,滴加PI,濕盒內室溫避光染色20 s,PBS漂洗3次,封片。激光掃描共聚焦顯微鏡觀察。
1.3.5Western blot檢測淋巴細胞上Cx40和Cx43的蛋白表達 取出已干預好的細胞,1 800 r/min離心6 min,沉淀采用BCA法測定蛋白濃度后,取蛋白樣品加入適量的上樣緩沖液,置于沸水中使蛋白變性,于SDS聚丙烯酰胺凝膠進行電泳分離,電泳完畢后將凝膠上的蛋白轉移至PVDF膜上,置于含5%脫脂奶粉的TBST中室溫封閉2 h,分別加入Cx40、Cx43及NADPH一抗4 ℃過夜,洗膜后再加入二抗室溫孵育2 h,再次洗膜后與發光試劑反應,置于X線膠片暗盒中曝光、顯影。應用ImageJ2x分析軟件檢測并分析條帶的灰度值。

2 結果
2.1 培養基中IL- 1β及IL- 6的水平ELISA檢測結果顯示,ConA組與Ctrl組相比,培養基中IL- 1β 和IL- 6水平明顯升高,差異有統計學意義(P<0.01);ConA+E組與ConA組相比,培養基中IL- 1β和IL- 6水平明顯降低,差異有統計學意義(P<0.01,P<0.05,n=6),見表1。

表1 培養基中IL- 1β及IL- 6的水平
與Ctrl組比較:**P<0.01;與ConA組比較:#P<0.05,##P<0.01
2.2 淋巴細胞上Cx40和Cx43的表達及分布差異采用FITC染料標記二抗和PI標記細胞核的雙重免疫熒光來顯示Cx40和Cx43在淋巴細胞上的表達和分布情況。綠色熒光代表Cx40和Cx43在淋巴細胞上的表達和分布情況,而紅色熒光則對應為染色的細胞核。結果表明,Cx40主要表達在細胞質及細胞核,而Cx43主要表達在細胞膜,與Ctrl組相比,ConA組Cx40和Cx43在淋巴細胞上表達增強,差異有統計學意義(P<0.01),給予E干預后Cx40和Cx43的表達降低,差異有統計學意義(P<0.01)。見圖1。
2.3 淋巴細胞上Cx40和Cx43表達水平的變化流式細胞術檢測結果顯示,ConA組淋巴細胞Cx40和Cx43陽性表達率高于Ctrl組大鼠,差異有統計學意義(P<0.01,P<0.05);ConA+E組淋巴細胞Cx40和Cx43陽性表達率低于ConA組大鼠,差異有統計學意義(P<0.05,n=3),見圖2。
2.4 淋巴細胞上Cx40和Cx43的蛋白表達Western blot檢測結果顯示,ConA組淋巴細胞上Cx40蛋白表達水平高于Ctrl組,差異有統計學意義(P<0.01);ConA+E組淋巴細胞上Cx40蛋白表達水平低于ConA組,差異有統計學意義(P<0.01)。
ConA組淋巴細胞上Cx43蛋白表達水平明顯高于Ctrl組,差異有統計學意義(P<0.01);ConA+E組淋巴細胞上Cx43蛋白表達水平明顯低于ConA組,差異有統計學意義(P<0.01)。見圖3。
3 討論
炎癥反應是機體活組織對各種致炎因素的一種正常防御反應,同時伴有大量淋巴細胞浸潤,這方面變化產生的實質是機體與炎癥因子進行抗爭的反映[8]。炎癥因子主要由免疫細胞釋放,在炎癥反應的發生和發展過程中起關鍵作用[9]。其中, IL- 1β和IL- 6能夠促進淋巴細胞的增殖與分化,促進免疫炎癥反應。同時,淋巴細胞在免疫反應中也發揮核心作用,其活化、增殖及炎癥因子的釋放等細胞行為是免疫反應的基礎和關鍵事件[10]。另外,ConA具有強力的促有絲分裂作用,能夠較好的促進淋巴細胞轉化,刺激淋巴細胞分泌炎癥因子[11]。本研究結果表明,通過ELISA檢測炎癥因子表達水平,使用ConA激活淋巴細胞后,淋巴細胞釋放IL- 1β 和IL- 6增多,給予雌激素干預后,IL- 1β和IL- 6的濃度明顯降低,提示體外炎癥模型制備成功,并且E能夠減少ConA刺激下炎癥因子的分泌。

圖1 淋巴細胞上Cx40和Cx43的表達及定位 ×630

圖2 淋巴細胞上Cx40和Cx43的表達水平
A:淋巴細胞上Cx40陽性表達及統計結果;B:淋巴細胞上Cx43陽性表達及統計結果;與Ctrl組比較:*P<0.05,**P<0.01;與ConA組比較:#P<0.05
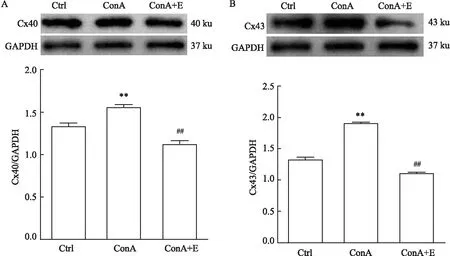
圖3 淋巴細胞上Cx40和Cx43的蛋白表達
由Cx構成的縫隙連接通道作為細胞間進行物質交換和信息通訊的一種特殊膜通道結構,直接介導細胞間的電和化學信號交流,在細胞增殖分化以及機體新陳代謝中發揮重要作用。Vliagoftis et al[5]發現Cx43在外周血嗜酸性粒細胞上表達,不僅定位于細胞質內,而且存在于質膜上。本研究結果證實了淋巴細胞上表達有Cx40和Cx43,且Cx40主要表達在細胞質及細胞核,而Cx43主要表達在細胞膜。此外,研究[12]顯示由Cx40和Cx43構成的縫隙連接通道參與免疫系統細胞間細胞通訊及免疫炎癥應答。當免疫細胞受到炎癥因子的刺激時,淋巴細胞上Cx40和Cx43表達可顯著上調。本研究結果中也表明由ConA激活的淋巴細胞上Cx40和Cx43的表達升高,提示Cx40和Cx43可能參與了炎癥反應。近年來研究[13]顯示,E可以抑制炎癥反應,對多種臟器具有一定的保護作用。已有研究[14]表明,E對多種組織細胞中Cx43的表達、分布、空間構象及功能狀態等具有調節作用,且具有調節縫隙連接的功能。本研究結果顯示,在ConA刺激下淋巴細胞上Cx40和Cx43的表達上調,給予E干預后,淋巴細胞上Cx40和Cx43的表達下降,提示E的抗炎作用可能與下調淋巴細胞上的連接蛋白有關,但它是如何通過下調淋巴細胞上Cx40和Cx43從而發揮抗炎作用的機制仍不十分清楚,后續需要進一步探討。
綜上所述,本研究結果證實淋巴細胞上Cx40和Cx43的表達在ConA刺激下顯著上調,炎癥因子水平升高,給予E進行干預后,Cx40和Cx43的表達下降,炎癥因子水平降低,表明E能夠抑制促炎因子IL- 1β 和IL- 6的釋放,同時下調淋巴細胞上Cx40和Cx43的表達,從而改善炎癥反應。這一研究對了解Cx參與淋巴細胞炎癥反應具有一定的意義,也為闡明E的抗炎機制及其臨床治療提供更多依據。

