不同類型非甾體抗炎藥物對脊柱術后椎體間植骨融合影響的相關研究
劉少強 陳 偉 劉伯齡 梁珪清▲ 齊 強
1.廈門大學附屬福州第二醫院脊柱外科,福建福州 350007;2.北京大學第三醫院骨科,北京100191
脊柱融合(spinal fusion)是治療脊柱疾病的主要方法之一,已成為治療脊柱骨折、脊柱腫瘤、脊柱退行性病變和脊柱畸形的常規技術[1-3]。雖然采用聯合內固定技術可減少融合失敗的發生,但臨床上不愈合率仍高達10%~15%,并導致疼痛、椎間隙塌陷、遲發性后凸畸形等并發癥[2]。因此,如何有效地提高脊柱融合率和臨床療效,一直是脊柱外科醫生亟待解決的問題。
非甾體抗炎藥物(non-steroidal anti-inflammatory drugs,NSAIDs)在脊柱外科手術后的疼痛管理中有廣泛應用。有研究發現,NSAIDs 對骨折愈合有不利影響,如延長愈合時間、降低骨痂的機械強度和剛度、增加骨折不愈合率[4-7]。盡管上述學者報道了NSAIDs 藥物對骨折愈合的影響,但均未直接模擬脊柱融合手術,且研究內容局限于生物力學研究,而缺乏組織學及免疫染色學等相關研究,因此尚無法闡明NSAIDs 藥物對脊柱融合術后椎間植骨塊中成骨細胞、骨形態發生蛋白形成的影響機制。
本研究擬以日本大耳白兔的脊柱融合為模型,術后給予不同類非甾體抗炎藥,并于不同愈合期對椎體間植骨界面行組織學、影像學、生物力學進行定量比較,以研究不同藥物對椎體間植骨融合的影響差異性,并闡明椎體間植骨融合的生物學關鍵環節和總體機制。
1 材料與方法
1.1 動物模型
1.1.1 同種異體骨制備 選擇成年雄性日本大耳白兔(健康8 月齡,體重2.5 ~3.0kg),以速眠新Ⅱ注射液0.2mL/kg 對實驗動物進行肌肉注射以施行全身麻醉,常規皮膚消毒,在無菌條件下采集髂骨骨材,去除骨膜及周圍軟組織,洗凈骨髓腔,1%新潔爾滅中浸泡30min,置入70%乙醇中浸泡及常溫密封保存備用。
1.1.2 脊柱融合手術 麻醉成功后將其置于右側臥位,左側腰背部備皮,常規皮膚消毒。以肋緣下為標志確定L1水平,自肋骨下緣沿橫突水平做長約5cm 橫行切口,切開淺層肌肉,沿橫突間肌肉肌間隙進入,暴露L3橫突,用蚊式鉗提拉L3橫突及L4橫突棘間韌帶,充分暴露L3~4間盤。切除L3~4間盤組織,于椎間隙內植入已消毒好的同種異體骨。絲線逐層縫合周圍軟組織,包扎固定。術后分籠飼養,肌注青霉素40×104U/d,共3d。
1.1.3 分組 按數字隨機化分為3 組:雙氯芬酸鈉組、塞來昔布組和對照組,術后即刻開始服藥。藥物組中雙氯芬酸鈉、塞來昔布的用量按4mg/(kg·d)口服給藥;為避免如胃腸道等不良反應,將藥物研磨成粉,均勻分成三份,按早、中、晚混于飼料中,飼料標準為200g/d,連續藥物喂養2 周;2 周后則正常飼料喂養。而對照組僅按相應重量進行飼料喂養,不給藥物處理。
1.2 方法
1.2.1 組織學染色 在術后4、8、12 周分別取各組動物融合節段行大體標本。植骨融合節段于體積分數7%~10%甲醛脫鈣液脫鈣3 ~4 周,石蠟包埋,切片,行蘇木精-伊紅染色(HE 染色)檢查,100 倍光鏡下比較各組標本的骨痂生長情況,并依據Nilsson 骨愈合組織學評分標準[8]進行評分,見表1。

表1 Nilsson骨愈合組織學評分標準
1.2.2 影像學評估 在術后4、8、12 周,相同條件下(100cm,50kV,KODAK)拍攝所有標本側位X 射線片,X 射線上融合融合標準為:(1)融合節段出現椎體前方、側方連續骨橋形成或椎間連續骨小梁通過。(2)未出現融合節段透亮影、植骨下沉、終板和植骨面出現間隙等假關節形成的表現。根據Lane-Sandhu 骨愈合X 線評分標準[9]進行評分,見表2。
1.2.3 生物力學測定 在術后4、8、12 周,取所有標本,保留L3、L4、L5椎體,剔除肌肉、筋膜等軟組織,保留融合骨結構,自椎體中央由前向后插入直徑2.0mm 克氏針,使用電子拉力機(精度0.01N)進行融合節段(L3~4)及相鄰未融合節段(L4~5)單向拉伸測試,拉伸負荷以1cm/min 的位移率通過克氏針施加于2 個節段,記錄斷裂時數值為該節段的最大拉伸負荷值。為減少實驗動物間生理變異的影響,計算同一標本融合節段(L3~4)與相鄰未融合節段(L4~5)的強度比值進行比較。
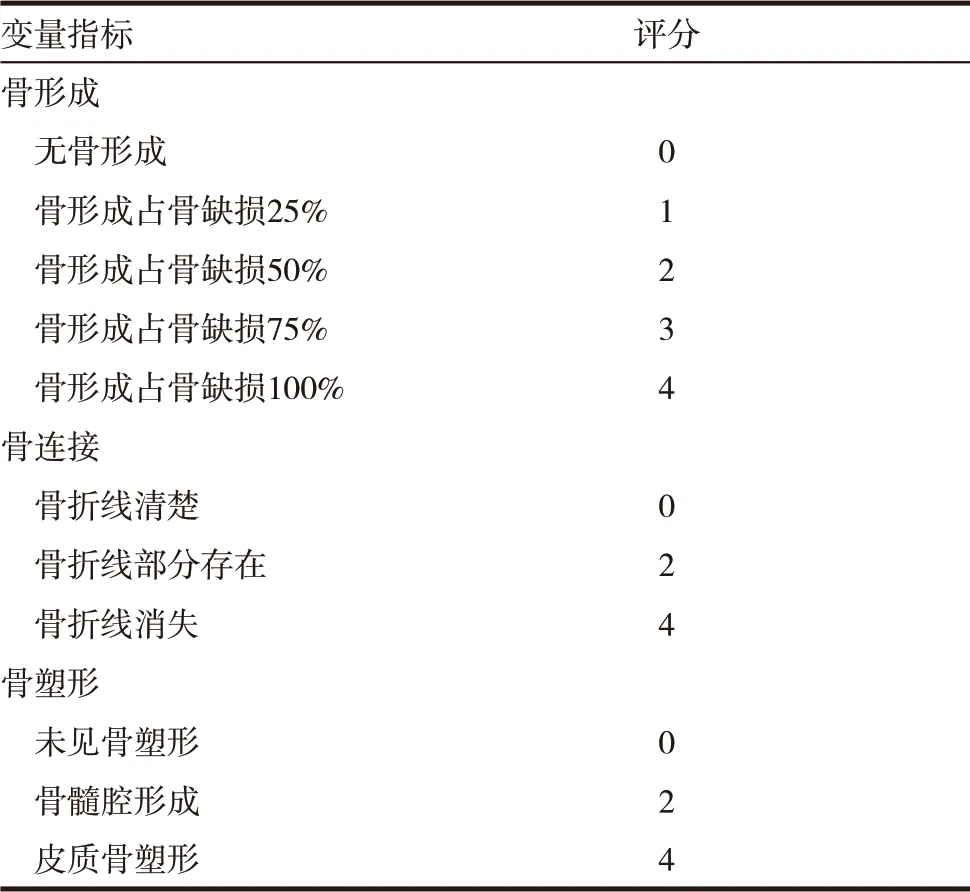
表2 Lane-Sandhu 骨愈合X線評分標準
1.3 統計學處理
所有數據采用SPSS 16.0 統計軟件進行分析。三組間的計數資料采用單因素方差分析(ANOVA),組間采用兩兩比較q 檢驗。檢驗水準α 值取雙側0.05。
2 結果
本研究成功建立了45 只雄性日本大耳白兔的脊柱融合動物模型,體重平均(2.83±0.18)kg。雙氯芬酸鈉組、塞來昔布組和對照組各包含15 只動物模型。在術后4、8、12 周的每個時間節點,分別取各組5 只動物的融合節段制備標本,行組織學、影像學和生物力學評價。
2.1 組織學結果
按照Nilsson 骨愈合組織學評分標準對各實驗兔進行評分,術后4 周時雙氯芬酸鈉組、塞來昔布組和對照組的評分分別為(5.9±1.3)分、(6.0±0.9)分和(7.3±1.1)分,雙氯芬酸鈉組和塞來昔布組的評分顯著低于對照組(P <0.05)。術后8 周時雙氯芬酸鈉組、塞來昔布組和對照組的評分分別為(7.1±1.0)分、(9.3±1.5)分和(10.1±0.8)分,雙氯芬酸鈉組評分顯著低于對照組(P <0.05),而塞來昔布組與對照組比較無統計學差異。術后12 周時雙氯芬酸鈉組、塞來昔布組和對照組的評分分別為(9.7±0.8)分、(11.1±0.7)分和(12.3±0.9)分,雙氯芬酸鈉組評分顯著低于對照組(P <0.05),而塞來昔布組與對照組比較無統計學差異。見表3。
表3 各組Nilsson骨愈合組織學平均評分 s,分)

表3 各組Nilsson骨愈合組織學平均評分 s,分)
注:與對照組比較,#P <0.05
組別 術后4周 術后8周 術后12周雙氯芬酸鈉組 5.9±1.3# 7.1±1.0# 9.7±0.8#塞來昔布組 6.0±0.9# 9.3±1.5 11.1±0.7對照組 7.3±1.1 10.1±0.8 12.3±0.9 F 9.821 20.390 6.379 P 0.031 0.027 0.019
2.2 影像學觀察及評分
按照Lane-Sandhu 骨愈合X 線評分標準對各實驗兔進行評分,術后4 周時雙氯芬酸鈉組、塞來昔布組和對照組的評分分別為(3.8±1.1)分、(5.5±0.8)分和(6.3±1.2)分,雙氯芬酸鈉組和塞來昔布組的評分顯著低于對照組(P <0.05)。術后8 周時雙氯芬酸鈉組、塞來昔布組和對照組的評分分別為(6.4±0.8)分、(9.5±1.5)分和(11.0±0.9)分,雙氯芬酸鈉組評分顯著低于對照組(P <0.05),而塞來昔布組與對照組比較無統計學差異。術后12 周時雙氯芬酸鈉組、塞來昔布組和對照組的評分分別為(8.4±0.9)分、(10.5±1.4)分和(12.8±1.1)分,雙氯芬酸鈉組評分顯著低于對照組(P <0.05),而塞來昔布組與對照組比較無統計學差異,見表4。
表4 各組Lane-Sandhu骨愈合X線平均評分分)

表4 各組Lane-Sandhu骨愈合X線平均評分分)
注:與對照組比較,#P <0.05
組別 術后4周 術后8周 術后12周雙氯芬酸鈉組 3.8±1.1# 6.4±0.8# 8.4±0.9#塞來昔布組 5.5±0.8# 9.5±1.5 10.5±1.4對照組 6.3±1.2 11.0±0.9 12.8±1.1 F 10.571 9.306 11.528 P 0.012 0.032 0.040
2.3 生物力學測定
測量各組實驗兔的腰椎融合節段(L3~4)與相鄰未融合節段(L4~5)的生物力學強度,并計算兩節段的生物力學強度比值(L3~4/ L4~5),詳見表5。術后4 周時雙氯芬酸鈉組、塞來昔布組和對照組的生物力學強度比值分別為(1.6±1.0)、(1.7±0.8)和(2.0±0.8),雙氯芬酸鈉組和塞來昔布組顯著低于對照組(P <0.05)。術后8 周時雙氯芬酸鈉組、塞來昔布組和對照組的生物力學強度比值分別為(2.1±1.1)、(2.3±0.8)和(2.5±1.3),雙氯芬酸鈉組顯著低于對照組(P <0.05),而塞來昔布組與對照組比較無統計學差異。術后12 周時雙氯芬酸鈉組、塞來昔布組和對照組的生物力學強度比值分別為(2.4±0.8)、(2.7±0.9)和(2.9±0.8),雙氯芬酸鈉組顯著低于對照組(P <0.05),而塞來昔布組與對照組比較無統計學差異。

表5 各組的生物力學強度比值(L3~4/ L4~5)
3 討論
脊柱的穩定性對于維持脊柱的正常功能非常重要,脊柱外科常采用植骨融合術來獲得中遠期的穩定效果。脊柱融合技術技術在過去的數十年間取得了很大成功。但脊柱融合術后骨不愈合時有發生,可導致疼痛、椎間隙塌陷、遲發性后凸畸形等并發癥[10-11]。研究認為,脊柱融合術后植骨融合失效的原因包括技術因素、力學因素和生物學因素[12-13]。其中,生物學因素是急待解決的重點。由于整個植骨愈合過程可分為3 個階段:炎癥期、修復期和重塑期[14]。骨移植物植入之后,局部發生炎癥反應,由此產生化學信號機因子趨化作用,宿主體內的免疫細胞進入植骨塊,血管及基質逐漸形成并包繞植骨塊,將多能干細胞輸送至此,并在移植骨塊內分化成熟,通過爬行替代的方法完成修復和重塑。
研究發現NSAIDs 藥物緩解術后患者疼痛的同時,其還可抑制炎癥過程中緩激肽的釋放,干擾植骨炎癥期的正常進行。Gerstenfeld 等[4]報道53 只閉合性股骨干骨折SD 雄性大鼠,骨折后隨訪分為4組,連續分別經口給生理鹽水、酮咯酸、低劑量帕瑞昔布、高劑量帕瑞昔布組,發現NSAIDs 藥物均降低骨痂的機械強度和剛度,造成骨折愈合延遲,其中非選擇性NSAIDs 藥物(酮鉻酸)的影響更大,而選擇性NSAIDs 藥物(帕瑞昔布)的影響相對較小。該研究還觀察對照組大鼠骨折部位的COX 表達情況,發現骨痂內COX-1 的表達在骨折后21d 均保持不變,而COX-2 在骨折后持續高表達到14d,后逐漸下降,在骨折后21d 回到基線水平。Akman 等[6]同樣報道雙氯芬酸可顯著影響大鼠脛骨干骨折的愈合強度。陳堅等[5]報道常用非甾體抗炎藥(阿司匹林、布洛芬、雙氯芬酸鈉、美洛昔康、尼美舒利、塞來昔布)對成骨細胞增殖和骨形成蛋白有不同程度的抑制作用。
本研究發現術后4 周時,組織學、影像學和生物力學研究均表明雙氯芬酸鈉組和塞來昔布組實驗兔植骨愈合劣于對照組,術后8、12 周時,塞來昔布組與對照組無顯著差異,而雙氯芬酸鈉組仍劣于對照組。NSAIDs 藥物的作用機制包括:(1)通過抑制環氧合酶活性,降低前列腺素的合成;(2)抑制淋巴細胞活性和活化的T 淋巴細胞的分化,減少對傳入神經末梢的刺激;(3)直接作用于傷害性感受器,阻止致痛物質的形成和釋放[15]。而環氧合酶包括COX-1 和COX-2 兩種同工酶:COX-1 屬于原生型酶,在正常生理狀態下就存在于胃腸道、腎臟等部位,促進生理性前列腺素的合成,調節正常組織細胞的生理活動,如保護消化道黏膜,調節血管張力等;COX-2 屬于誘生型酶,由損傷或炎癥因子誘導生成,進而催化前列腺素合成,產生后續炎癥反應以及疼痛[16-17]。作為非特異性NSAIDs 藥物,雙氯芬酸鈉對COX-1 和COX-2 均有抑制作用,而塞來昔布作為特異性NSAIDs 藥物,僅對COX-2 有抑制作用。因此,非甾體抗炎藥物對植骨融合的影響存在差異,可能與NSAIDs 的藥理機制不同相關。術后4 周時,選擇性COX-2 和非選擇性COX 抑制劑對脊柱椎間植骨融合均有負面影響,同時引起力學強度的減弱。術后8 和12 周時,選擇性COX-2 非抑制劑對骨融合的負面影響消失,而非選擇性COX抑制劑的負面影響仍存在。
根據本研究結果,脊柱椎間融合術后患者鎮痛處理時,我們應注意避免過多使用非甾體抗炎藥物(尤其非選擇性COX 抑制劑),以免影響患者術后椎間植骨的愈合。

