MALBAC-NGS和array CGH檢測(cè)染色體異常囊胚的結(jié)果比較
王林玉,施文韜,趙正豪,柏海燕,師娟子*
(1.西北婦女兒童醫(yī)院轉(zhuǎn)化醫(yī)學(xué)中心,西安 710061;2.寧夏藥品檢驗(yàn)研究院,銀川 750004;3.西北婦女兒童醫(yī)院輔助生殖中心,西安 710003)
在自然生殖發(fā)育過(guò)程中,細(xì)胞分裂時(shí)期染色體不分離或染色單體提早分離和染色體丟失是引起染色體異常的主要原因。染色體異常分為數(shù)量異常和結(jié)構(gòu)異常,數(shù)量異常更為常見(jiàn)[1]。目前在胚胎種植前篩查的主要技術(shù)手段就是胚胎植入前遺傳學(xué)篩查或診斷(PGS/PGD),是在胚胎植入著床之前,對(duì)早期胚胎進(jìn)行染色體數(shù)目和結(jié)構(gòu)異常的檢測(cè),分析胚胎非整倍體風(fēng)險(xiǎn)的一種早期產(chǎn)前篩查方法,從而挑選正常的胚胎植入子宮,以期獲得正常的妊娠,提高妊娠率,降低流產(chǎn)率,預(yù)防出生缺陷[2-3]。PGS的有效性依賴于早期胚胎活檢技術(shù)和遺傳學(xué)檢測(cè)分析技術(shù)。在遺傳學(xué)檢測(cè)分析技術(shù)方面,比較基因組雜交微陣列芯片(array CGH)是第一項(xiàng)廣泛應(yīng)用于PGS的可進(jìn)行全部24條染色體篩查的技術(shù),并已成為該領(lǐng)域的金標(biāo)準(zhǔn)。然而,隨著科學(xué)的發(fā)展和進(jìn)步,遺傳學(xué)檢測(cè)技術(shù)也不斷推陳出新,二代測(cè)序技術(shù)(NGS)作為一項(xiàng)新興的遺傳學(xué)檢測(cè)技術(shù),在輔助生殖醫(yī)學(xué)領(lǐng)域,尤其是在PGS中的應(yīng)用價(jià)值備受關(guān)注[4]。檢測(cè)方法的有效性對(duì)于PGS的應(yīng)用前景以及臨床結(jié)局至關(guān)重要。但是關(guān)于兩種檢測(cè)方法在PGS中的差異卻鮮有報(bào)道。因此,本文擬從我院PGS病例中研究array CGH與多次退火環(huán)狀循環(huán)擴(kuò)增-二代測(cè)序(MALBAC-NGS)兩種檢測(cè)方法的差異,以期為PGS提供一個(gè)可靠的檢測(cè)手段。
資料與方法
一、研究對(duì)象
收集2015年1月1日至2017年4月30日西北婦女兒童醫(yī)院生殖中心行PGS的常規(guī)IVF-ET患者,以array-CGH法檢測(cè)染色體異常的胚胎為研究對(duì)象,共收集32枚染色體異常的囊胚同時(shí)進(jìn)行MALBAC-NGS法檢測(cè)。PGS檢測(cè)在西北婦女兒童醫(yī)院醫(yī)學(xué)遺傳中心完成,采用array-CGH(BlueGnome 24SureV3軟件)檢測(cè)。所有進(jìn)入臨床PGS周期的患者均簽署知情同意書(shū)。
二、研究方法
1.囊胚活檢:確認(rèn)array CGH檢測(cè)染色體異常的囊胚,玻璃化解凍復(fù)蘇,放入Vitrolife G2.5培養(yǎng)液培養(yǎng)(20 μl)。培養(yǎng)12~24 h后,內(nèi)細(xì)胞團(tuán)形態(tài)明顯者,再次活檢內(nèi)細(xì)胞團(tuán)和外胚層。內(nèi)細(xì)胞團(tuán)活檢操作技術(shù)難度較高,肉眼觀察內(nèi)細(xì)胞團(tuán)不少于2/3被活檢視為內(nèi)細(xì)胞團(tuán)活檢成功,內(nèi)細(xì)胞團(tuán)活檢失敗或內(nèi)細(xì)胞形態(tài)不明顯時(shí),整個(gè)囊胚活檢。活檢的細(xì)胞組織培養(yǎng)液洗滌后放入裝有5 μl細(xì)胞裂解液的PCR管內(nèi),離心后-40℃凍存待檢。
2. array CGH法檢測(cè):采用SurePlex DNA Amplification System試劑盒(購(gòu)自美國(guó)New England Biolabs公司)進(jìn)行全基因組擴(kuò)增,然后通過(guò)array CGH方法(BlueGnome 24SureV3 package kit)對(duì)擴(kuò)增后的產(chǎn)物進(jìn)行檢測(cè),BlueFuse Multi軟件分析并出具報(bào)告。
3.MALBAC-NGS法檢測(cè):采用MALBAC方法將待測(cè)樣本進(jìn)行全基因組擴(kuò)增,向待測(cè)樣本和對(duì)照品的PCR管中分別加入裂解酶,放入設(shè)定好參數(shù)的PCR儀中,裂解細(xì)胞,隨后經(jīng)過(guò)預(yù)擴(kuò)增將微量初始模板進(jìn)行線性擴(kuò)增,最后經(jīng)過(guò)指數(shù)擴(kuò)增即完成文庫(kù)構(gòu)建。將構(gòu)建好的文庫(kù)純化后定量,隨后測(cè)序文庫(kù)與引物、dNTPs、DNA聚合酶、引物載體構(gòu)建“油包水”P(pán)CR反應(yīng)單元后在DA8600測(cè)序平臺(tái)完成NGS測(cè)序工作。檢測(cè)內(nèi)容為染色體非整倍體和10 M以上的片段缺失和/或重復(fù)。
三、統(tǒng)計(jì)學(xué)分析
實(shí)驗(yàn)數(shù)據(jù)以率(%)進(jìn)行統(tǒng)計(jì)學(xué)描述,所有數(shù)據(jù)采用SPSS 23.0進(jìn)行統(tǒng)計(jì)學(xué)分析。
結(jié) 果
一、基本數(shù)據(jù)
共活檢32枚囊胚,均是經(jīng)array CGH法檢測(cè)為異常的囊胚,復(fù)蘇培養(yǎng)后再次活檢,通過(guò)MALBAC-NGS的方法檢測(cè)胚胎染色體,MALBAC-NGS法共檢測(cè)到異常囊胚17枚。兩種檢測(cè)方法均顯示單個(gè)胚胎中一條染色體異常發(fā)生率最高(分別為43.75%、58.82%),3條及以上染色體發(fā)生率較低(18.75%、0%)(表1、2)。在染色體缺失及重復(fù)異常中,經(jīng)array CGH方法檢測(cè),9號(hào)(21.88%)、16號(hào)(21.88%)、22號(hào)(21.88%)、10號(hào)(18.75%)、13號(hào)(18.75%)及15號(hào)(18.75%)染色體發(fā)生率較高;MALBAC-NGS方法檢測(cè),13號(hào)染色體發(fā)生率最高(35.29%)(表1、3)。

表1 array CGH法和MALBAC-NGS法檢測(cè)32枚胚胎檢測(cè)結(jié)果展示

續(xù)表
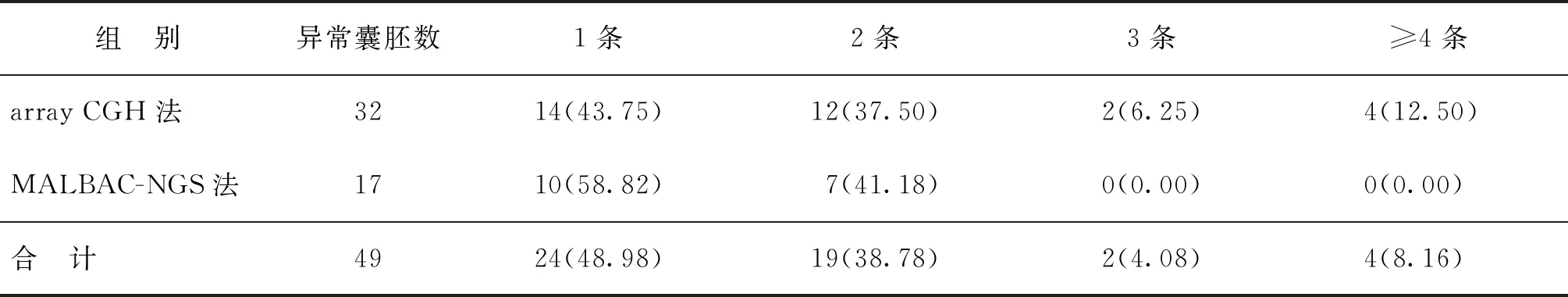
表2 array CGH和MALBAC-NGS方法檢測(cè)單個(gè)胚胎異常染色體數(shù)目的發(fā)生頻率[n(%)]
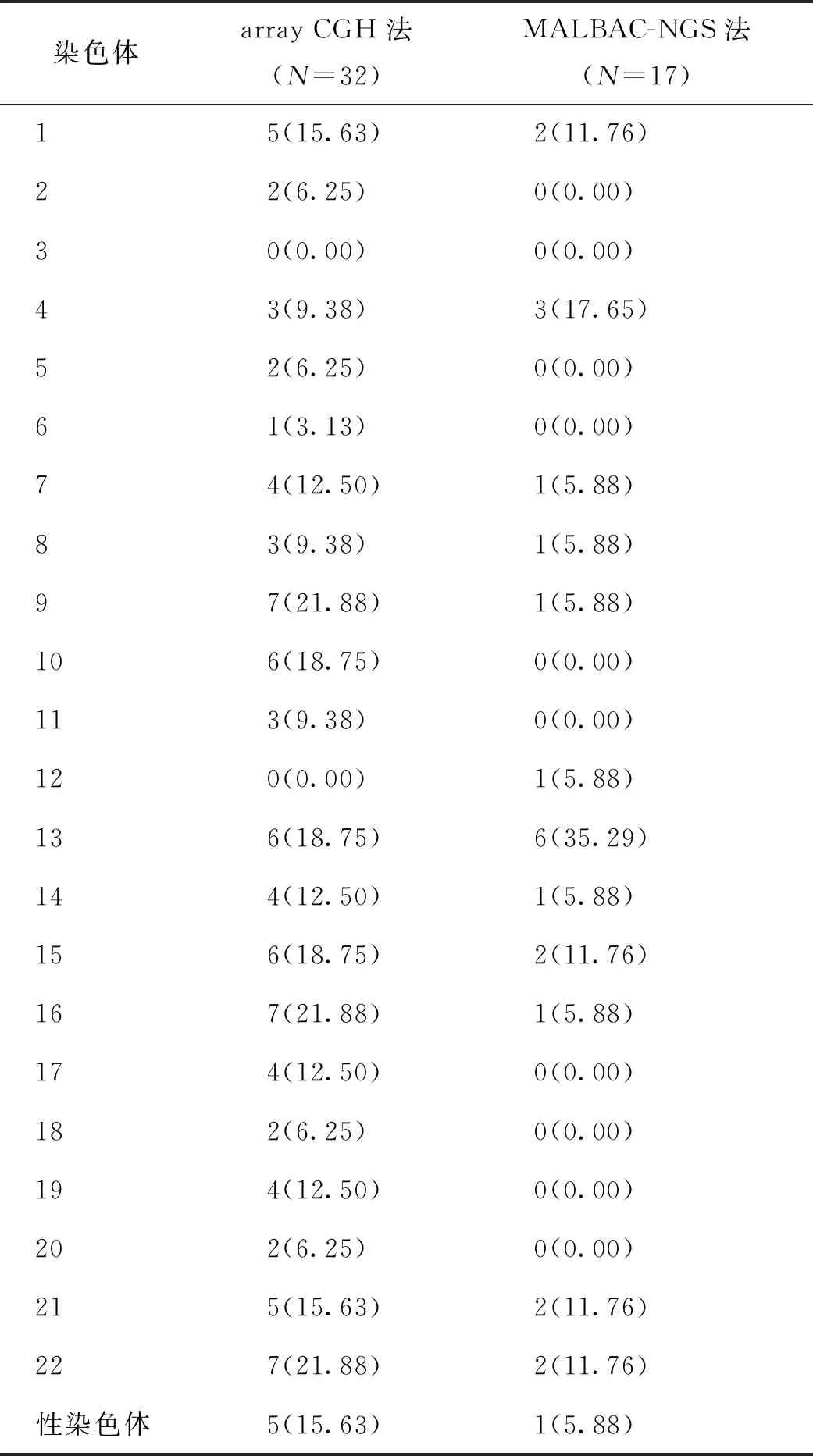
表3 array CGH和MALBAC-NGS方法檢測(cè)各染色體缺失/重復(fù)的發(fā)生頻率[n(%)]
二、MALBAC-NGS法檢測(cè)內(nèi)細(xì)胞團(tuán)與外胚層檢測(cè)結(jié)果比較
內(nèi)細(xì)胞團(tuán)與外胚層分別活檢的有16枚,用MALBAC-NGS法檢測(cè),其中有14枚胚胎內(nèi)細(xì)胞團(tuán)和外胚層檢測(cè)結(jié)果完全一致,一致率達(dá)87.5%(14/16);而另外2枚(7號(hào)、12號(hào))胚胎內(nèi)細(xì)胞團(tuán)和外胚層檢測(cè)結(jié)果不一致,不一致率為12.5%(2/16)(表1)。
三、兩種檢測(cè)方法一致性比較
經(jīng)array CGH法檢測(cè)為異常的胚胎,再用MALBAC-NGS法檢測(cè),其中3號(hào)、8號(hào)、9號(hào)、10號(hào)、11號(hào)、13號(hào)及14號(hào)共7枚胚胎檢測(cè)結(jié)果與array CGH法檢測(cè)結(jié)果完全一致,一致率達(dá)21.88%(7/32)。
四、兩種檢測(cè)方法檢測(cè)結(jié)果比較
32枚胚胎均是經(jīng)array CGH法檢測(cè)異常的胚胎,活檢后再用MALBAC-NGS法檢測(cè),其中15枚胚胎檢測(cè)結(jié)果為正常(46,XN),假陽(yáng)性率達(dá)46.88%(15/32)(表1)。
五、兩種檢測(cè)方法檢出嵌合率的比較
array CGH法未檢出染色體嵌合的胚胎,而MALBAC-NGS法檢出7號(hào)、12號(hào)及22號(hào)共3枚染色體嵌合的胚胎,染色體嵌合胚胎檢出率9.38%(3/32),染色體非嵌合胚胎檢出率90.63%(29/32)。
討 論
隨著現(xiàn)代分子生物學(xué)的發(fā)展,運(yùn)用于PGS的遺傳學(xué)分析技術(shù)也在不斷更新,由最初的 PCR僅能檢測(cè)單位點(diǎn)的突變,發(fā)展到FISH技術(shù),可以檢測(cè)少數(shù)染色體,后來(lái)又出現(xiàn)array CGH技術(shù),可以檢測(cè)所有染色體的數(shù)目及結(jié)構(gòu)異常,到目前新興的NGS技術(shù),可同時(shí)進(jìn)行染色體異常及單基因疾病的診斷[5]。
本研究中使用MALBAC-NGS方法檢測(cè)內(nèi)細(xì)胞團(tuán)與外胚層,兩者檢測(cè)結(jié)果完全一致的有14枚胚胎,一致率高達(dá)87.5%。這提示我們MALBAC-NGS方法在PGS診斷方面具有較高的可靠性和準(zhǔn)確性。因?yàn)镸ALBAC-NGS從基因組擴(kuò)增就采用高擴(kuò)增效率、高覆蓋率和均衡性、較低等位基因脫扣率的MALBAC擴(kuò)增技術(shù)[6-7],且NGS可以對(duì)全基因組進(jìn)行全面地讀取,隨著DNA測(cè)序技術(shù)的不斷成熟,其數(shù)據(jù)輸出量不斷增大,因此對(duì)異常的發(fā)現(xiàn)能力和尋找新信息的能力也不斷增強(qiáng)。
本研究共檢測(cè)32枚胚胎,均是array CGH檢測(cè)異常的胚胎,活檢后再用MALBAC-NGS檢測(cè),其中有7枚胚胎檢測(cè)結(jié)果完全一致,另外還有5枚胚胎檢測(cè)出其他異常。這提示我們MALBAC-NGS與array CGH技術(shù)有較好的一致性。有多個(gè)研究驗(yàn)證了NGS檢測(cè)染色體非整倍體的效能。Fiorentino等[8]首次將array CGH作為參照,驗(yàn)證將NGS用于胚胎非整倍體檢測(cè)的精確性。該研究證實(shí)了NGS是一項(xiàng)高通量、高度自動(dòng)化的可用于染色體非整倍體篩查的技術(shù)。Yang等[9]也進(jìn)行了類(lèi)似試驗(yàn),運(yùn)用NGS技術(shù)對(duì)從38個(gè)PGS周期中獲得的164例全基因組擴(kuò)增產(chǎn)物(WGA)進(jìn)行染色體非整倍體篩查,再將檢測(cè)結(jié)果與之前已有的array CGH 結(jié)果進(jìn)行比較。結(jié)果發(fā)現(xiàn),NGS可以精確檢測(cè)出所有類(lèi)型的染色體非整倍體。此外,很多研究也表明MALBAC-NGS與array CGH方法具有高度的一致性[10-11]。
另外,MALBAC-NGS檢出3枚染色體嵌合的胚胎,而array CGH未檢測(cè)出嵌合胚胎。array CGH技術(shù)無(wú)法識(shí)別單個(gè)堿基,此外,由于分辨率不足,細(xì)胞凋亡DNA降解等原因,array CGH無(wú)法檢測(cè)出小片段的染色體異常,也無(wú)法檢出嵌合體胚胎。而NGS的動(dòng)態(tài)范圍較array CGH更加寬泛,染色體拷貝數(shù)的變化可在正常背景中清晰可見(jiàn),較array CGH而言,嵌合體在NGS中也更容易識(shí)別。且大量的實(shí)驗(yàn)數(shù)據(jù)證明,胚胎嵌合體的存在依然使部分具有發(fā)育潛能的胚胎被排除[12-13]。因此MALBAC-NGS技術(shù)在檢出嵌合率方面優(yōu)于array CGH。
總之,MALBAC-NGS作為一項(xiàng)高通量、高度自動(dòng)化的可用于染色體非整倍體篩查的技術(shù),在診斷速度和效率、精確度、動(dòng)態(tài)范圍、分辨率等方面都表現(xiàn)出不凡的優(yōu)勢(shì)。因此,NGS或許可成為一種非常有價(jià)值的遺傳檢測(cè)分析技術(shù),用來(lái)替代當(dāng)前可用的其他染色體非整倍體篩查技術(shù)[14-15],以期提高胚胎染色體異常的診斷效率。

