水凝膠納米纖維復合基底捕獲循環腫瘤細胞的研究
王志利 丁丕 高田 陳昌沖 曹翼 孫娜 裴仁軍

摘要:循環腫瘤細胞(CTCs)檢測被認為是一種極具發展前景的癌癥液體活檢技術。血液中CTCs數量非常稀少,因此,從血液中高效捕獲高純度、高活性的CTCs極具挑戰。為提高CTCs捕獲純度,本研究通過自由基聚合反應在玻璃片表面修飾厚度約2.3μm的聚羧酸甜菜堿甲基丙烯酸甲酯(PCBMA)水凝膠,具有抗粘附作用,并提供一種類似細胞外基質的柔軟界面。在水凝膠表面修飾抗上皮粘附分子(EpCAM)抗體后,對靶細胞的捕獲效率僅約20%。為提高捕獲效率,通過靜電紡絲技術在水凝膠表面覆蓋一層直徑約200nm的殼聚糖納米纖維,使捕獲基底具有納米結構,最后引入EpCAM抗體作為親和捕獲分子用于特異性捕獲EpCAM高表達的CTCs。實驗結果表明,此水凝膠納米纖維復合基底對靶細胞捕獲效率可達85%,比平面水凝膠基底的捕獲效率提高了4倍多;對陰性細胞的粘附率僅0.5%,并且97%的捕獲細胞保持活性。對模擬病人樣本中少量靶細胞的捕獲效率可達79.9%。本研究所發展的捕獲基底通過親和捕獲分子、抗粘附水凝膠和納米纖維結構的協同作用實現了對CTCs的高效率捕獲。
關鍵詞:循環腫瘤細胞;高效捕獲;納米結構;水凝膠抗粘附界面
1引言
循環腫瘤細胞(CTCs)是一些攜帶原始腫瘤信息并從腫瘤部位脫落后,經過遷移、轉化等過程,最終進入血液循環系統的腫瘤細胞[1~3]。CTCs檢測為腫瘤的研究提供了一種非侵入性方式,因此被認為是最具發展前景的液體活檢技術,對腫瘤的早期診斷、預后監控、藥物評估以及個體化治療具有指導意義[4,5]。然而,CTCs在血液中非常稀少,且存在異質性,因此,從血液中高效、高純度捕獲CTCs仍然面臨嚴峻的挑戰[6]。目前,已經發展了多種分離技術用于CTCs捕獲,如密度梯度離心法[7]、濾膜過濾方法[8]、水動力分離法[9]、介電泳(DEP)細胞分離法[10]、納米基底親和捕獲方法[11]、磁珠親和捕獲分離技術[12]和微流控技術[13]等。研究發現,細胞表面存在的微納米結構可與納米結構基底形成較強的局部作用,同時,納米結構基底為親和捕獲分子的修飾提供更多的靶點,有望大幅度提高捕獲效率[14]。納米結構基底(如納米柱、納米線、納米纖維等)已經應用于CTCs捕獲[15,16]。Liu等[17]制備了基于金屬有機骨架(MOF)結構的納米基底,引入抗體作為親和捕獲分子,用于細胞的識別和捕獲以及作為藥物的響應性釋放載體。Wang等[18]通過在磨砂片表面原位生長硅納米線并修飾EpCAM抗體用于靶細胞PC-3的捕獲,捕獲效率達85%,隨著硅納米線長度增加,捕獲效率可進一步提高。但是,納米結構的引入增加了基底對血細胞或其它干擾細胞的非特異粘附,在一定程度上降低了對靶細胞的捕獲效率和純度,尤其是對CTCs的鑒定和分析存在嚴重干擾的白細胞也會被部分捕獲,因此,對于CTCs的研究首先需要發展能夠高效高純度捕獲CTCs的平臺。
目前,為降低基底對非特異性細胞的粘附作用,主要在納米結構表面修飾抗粘附分子如牛血清白蛋白(BSA)、聚乙二醇(PEG)等[19,20]。Sun等[19]將BSA蛋白通過化學交聯的方式引入到二氧化鈦納米棒表面,達到較好的抗粘附效果。研究發現,兩性離子聚合物的親水性是PEG分子的7~8倍,并具有良好的抗粘附性能[21]。其中,CBMA聚合物在抗蛋白、細菌和細胞吸附等方面具有優異的性能,將CBMA接枝到金表面,該表面在較廣pH和離子強度范圍內均具有優異的抗蛋白吸附能力[22]。而且CBMA化合物具有雙鍵和羧基官能團,為其廣泛使用提供了基礎。本研究引入CBMA來解決靶細胞捕獲過程中的非特異性吸附問題,以期提高靶細胞的捕獲純度。同時,相比無機納米材料制備的“硬”界面,細胞更偏向于“軟”的捕獲界面,為了對捕獲的CTCs進行后續研究,需要基底界面具有更好的細胞相容性以保持細胞的活性[23]。水凝膠的結構與活體組織細胞外基質(ECMs)相似,具有良好的親水性和抗粘附性能,因此被廣泛應用于人工ECMs合成的基礎成分和CTCs分離基底[24,25]。
本研究構建了一層水凝膠作為捕獲界面基層,此基層由兩性離子化合物CBMA形成,具有良好的抗粘附性能和類似于細胞外基質的結構。為提高水凝膠基層對CTCs的捕獲效率,在此基層上覆蓋一層殼聚糖納米纖維,通過化學交聯在纖維表層修飾PEG分子,最終將抗體修飾到其表面。利用水凝膠基層、殼聚糖纖維的納米結構以及抗體的特異性提高CTCs的捕獲效率和純度,對靶細胞捕獲效率可達85%,對陰性細胞的粘附率僅0.5%,對模擬血液樣本中少量靶細胞的捕獲效率達到79.9%。此基底為CTCs的高效、高純度捕獲提供了新的平臺。
2實驗部分
2.1儀器與試劑
DW-N303-1ACD8高壓直流電源發生器(天津東文高壓電源股份有限公司);W0109-1B微量進樣器(保定蘭格恒流泵有限公司);FEIQuanta400F環境掃描電子顯微鏡(美國FEI公司);Hitachi*CT6E日立臺式離心機(高壹工機商業(上海)有限公司);SW-CJ-1FD超凈工作臺(蘇州安泰空氣技術有限公司);FormaSeriesⅡ細胞恒溫培養箱(賽默飛世爾科技(中國)有限公司);NikonECLIPSETi熒光倒置顯微鏡(日本NIKON公司);Varian核磁共振波譜儀(美國瓦里安有限公司)。
殼聚糖(CS,MW=190-310kDa,脫乙酰度為85%)、聚(環氧乙烯)(PEO,MW=1000kDa)、N-羥基丁二酰亞胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺(EDC)、過硫酸銨(APS)、N,N-二甲氨基甲基丙烯酸乙酯(DMAEM,98%)、β-丙內酯(98%)、甲基丙烯酸-3-(三甲氧基甲硅烷基)丙酯(MPS)、N,N-亞甲基雙丙烯酰胺(MBA)、25%戊二醛(GA)、人白細胞分離液(Ficoll-Paque)、碘化丙啶(PI)、鈣黃綠素(AM)、細胞膜綠色熒光探針(DiO)、細胞膜紅色熒光探針(DiI)(試劑級,美國Sigma-Aldrich公司);達爾伯克改良伊格爾培養基(DMEM)、懸浮細胞1640培養基(RPMI1640)、最低必需培養基(MEM)、0.25%(w/V))胰蛋白酶(Trypsin-EDTA)、胎牛血清(FBS)(試劑級,GibcoBRL,賽默飛世爾科技(中國)有限公司);N,N,N',N'-四甲基乙二胺(TEMED)、乙酸、丙酮、無水乙醚(分析純,上海國藥集團化學試劑有限公司);氨基-聚乙二醇-羧基(NH2-PEG2000-COOH,試劑級,北京鍵凱科技有限公司);鏈霉親和素(SA,試劑級,北京索萊寶科技有限公司);生物素修飾的抗EpCAM抗體(anti-EpCAM,試劑級,上海優寧維生物科技股份有限公司)。
2.2細胞培養
人乳腺癌細胞系(MCF-7)、人前列腺癌細胞系(PC-3)、人胚胎腎細胞系(293T)、人慢性骨髓性白血病細胞系(K562)和人宮頸癌細胞系(HeLa)分別使用添加體積比為10%FBS的DMEM、RPMI1640和MEM的培養基培養。細胞系均來源于中國科學院上海細胞庫。
2.3實驗方法
2.3.1水凝膠納米纖維復合基底的構建(1)CBMA制備根據實驗室已有技術合成[23]。在氮氣保護下,將11.89gDMAEM溶解于80mL無水丙酮,冰浴下攪拌,逐滴加入5.73gβ-丙內酯,15℃反應5h。離心,用無水丙酮和無水乙醚洗滌,真空抽干,4℃保存。(2)雙鍵官能團修飾將1cm×1cm玻片,置于含0.5mLMPS的50mL乙醇溶液中,清洗,干燥。(3)水凝膠基層合成根據文獻[26]方法合成水凝膠層。用2.5μL40%(w/V)CBMA溶液、2.5μL1%(w/V)MBA溶液、0.15μLAPS(10%(w/V))和TEMED(5%(w/V))配制水凝膠溶液。立即轉移至干凈大玻片上,然后將步驟(2)修飾后的玻片倒扣在水凝膠溶液上,20min后可觀察到水凝膠成型。將水凝膠修飾的玻片從大玻片上取下,保存于干燥器中待用。(4)水凝膠纖維復合基底的構筑殼聚糖納米纖維根據本研究組前期建立的方法制備[22]。將殼聚糖與PEO按照質量比9∶1溶解于90%(V/V)乙酸-水,制成3%(w/w)的溶液,室溫攪拌8h。將電紡溶液轉移至5mL注射器中,采用5#針頭,針頭與鋁箔間距為10cm,電壓18kV,在水凝膠層表面電紡,4%氨水處理,清洗,過夜干燥。樣品命名為CS@Hydrogel。(5)纖維表面修飾PEG將CS@Hydrogel玻片與2.5%戊二醛反應2h,清洗后與1mg/mLNH2-PEG2000-COOH溶液過夜孵育,PBS清洗。樣品命名為PEG-CS@Hydrogel。(6)anti-EpCAM-CS@Hydrogel基底的構筑將PEG-CS@Hydrogel玻片用0.1mol/LEDC和0.025mol/LNHS活化,與10μg/mLSA溶液反應,PBS清洗,氮氣吹干,滴加2μmol/Lanti-EpCAM抗體溶液,4℃反應過夜,FBS封閉10min。樣品命名為anti-EpCAM-CS@Hydrogel。
2.3.2anti-EpCAM-CS@Hydrogel基底最佳捕獲時間的考察分別使用濃度為10μg/mL的DiO和DiI對K562和MCF-7染色20min,PBS清洗,計數,分別將0.25×105MCF-7和1×105K562細胞與anti-EpCAM-CS@Hydrogel玻片孵育不同時間,PBS清洗,熒光顯微鏡記錄細胞的捕獲情況,計算捕獲效率,選擇最佳孵育時間用于后續細胞捕獲實驗。捕獲效率定義為捕獲的細胞與最初加入細胞的百分比。
2.3.3anti-EpCAM-CS@Hydrogel基底捕獲效率的考察將MCF-7細胞染色,清洗,計數,將0.25×105MCF-7細胞與不同修飾界面的基底孵育40min,清洗,用倒置熒光顯微鏡記錄捕獲的細胞數,計算捕獲效率。
2.3.4anti-EpCAM-CS@Hydrogel基底特異性的考察分別對HeLa、K562、293T、MCF-7和PC-3這5種細胞進行染色,清洗,計數,配制成固定濃度的細胞溶液,分別與anti-EpCAM-CS@Hydrogel基底孵育40min,清洗,熒光顯微鏡記錄結果,統計捕獲效率。
2.3.5anti-EpCAM-CS@Hydrogel基底捕獲細胞活性的考察將MCF-7與anti-EpCAM-CS@Hydrogel基底孵育40min,清洗,然后與AM和PI的混合溶液孵育20min,清洗。同時將捕獲前的MCF-7進行AM和PI的雙染色處理,作為對照。其中AM標記活細胞,PI標記死細胞。用熒光顯微鏡觀察細胞的狀態,統計細胞的存活率。細胞存活率定義為活細胞數量與總細胞數量的百分比。
2.3.6anti-EpCAM-CS@Hydrogel基底靈敏度的考察將不同個數(10、20、50、100和200)DiI預染的MCF-7分別分散到1mL處理過的健康志愿者新鮮的抗凝血中,模擬病人血液樣本。同時用PBS溶液替代血液作對照組。分別與Lab-TekTM4孔腔室內的anti-EpCAM-CS@Hydrogel基底孵育,清洗,用熒光顯微鏡記錄捕獲的細胞數。
血液的處理方法:SepMateTM-15離心管中加入5mLFicoll-Paque,然后將PBS稀釋1倍的抗凝全血加入離心管中,2000r/min離心20min,提取白細胞(WBCs),PBS清洗,最后根據最初的血液體積加入等量的PBS分散,備用。
3結果與討論
3.1基底的制備和表征
合成的CBMA用1HNMR(400MHz)表征,結果如下:δ6.01(s,1H,dCH),5.63(s,1H,dCH),4.51(t,2H,OCH2),3.65(t,2H,CH2N),3.54(t,2H,NCH2),3.05(s,6H,NCH3),2.59(t,2H,CH2COO),1.80(s,3H,dCCH3)。
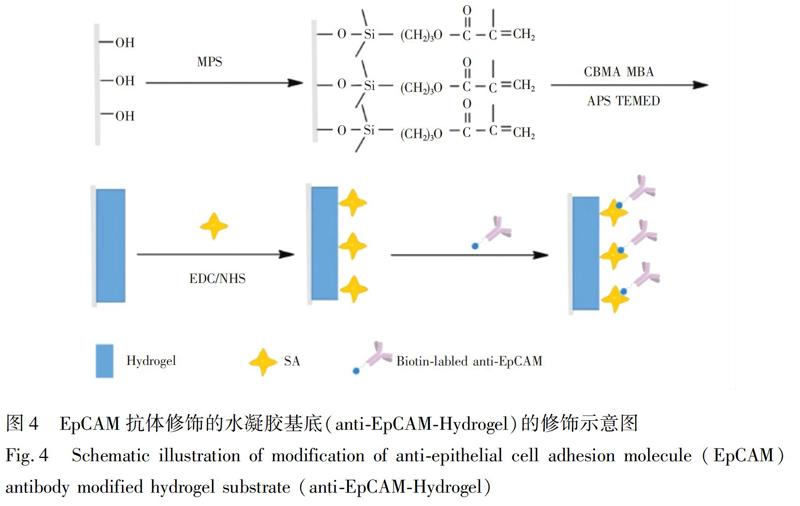
anti-EpCAM-CS@Hydrogel基底的構建和修飾見圖1。首先通過自由基聚合反應在玻片表面合成PCBMA抗粘附水凝膠基層。該水凝膠層作為捕獲基底需有一定的硬度和交聯密度,同時又能保留良好的吸水能力,通過實驗,最終確定20%(w/V)CBMA和0.5%(w/V)MBA滿足要求。如圖2A和2B所示,此水凝膠層表面平整,厚度約2.3μm,完全覆蓋玻片。在水凝膠形成過程時,玻片表面修飾的雙鍵參與反應,使水凝膠通過化學方式結合在玻片表面,保證了水凝膠層在后續的實驗過程中不會脫落。對水凝膠層進行水接觸角測試(圖2C和2D),落在水凝膠表面的測試液滴立刻被吸收,說明水凝膠層具有良好的吸水能力。利用靜電紡絲技術在水凝膠表面覆蓋一層殼聚糖納米纖維(圖2E和2F),纖維直徑約200nm,且稀疏地分布在水凝膠層上,通過SEM觀察到水凝膠層依然裸露在外,并未被纖維層掩蔽,使其依然能夠發揮抗粘附作用。此外,水凝膠基層吸水膨脹變柔軟時,纖維的一部分會嵌入到水凝膠中,起到了防止纖維層脫落的作用。然后用戊二醛將PEG分子的氨基端修飾到殼聚糖纖維表面,另
一端的羧基通過EDC/NHS活化后與SA上的氨基反應,最后通過親和素與生物素的特異相互作用將生物素化的抗體修飾在CS@Hydrogel基底上。此水凝膠納米纖維復合基底主要是利用水凝膠的抗粘附、纖維的納米結構及抗體特異識別的協同作用實現CTCs的高效高純度的捕獲。

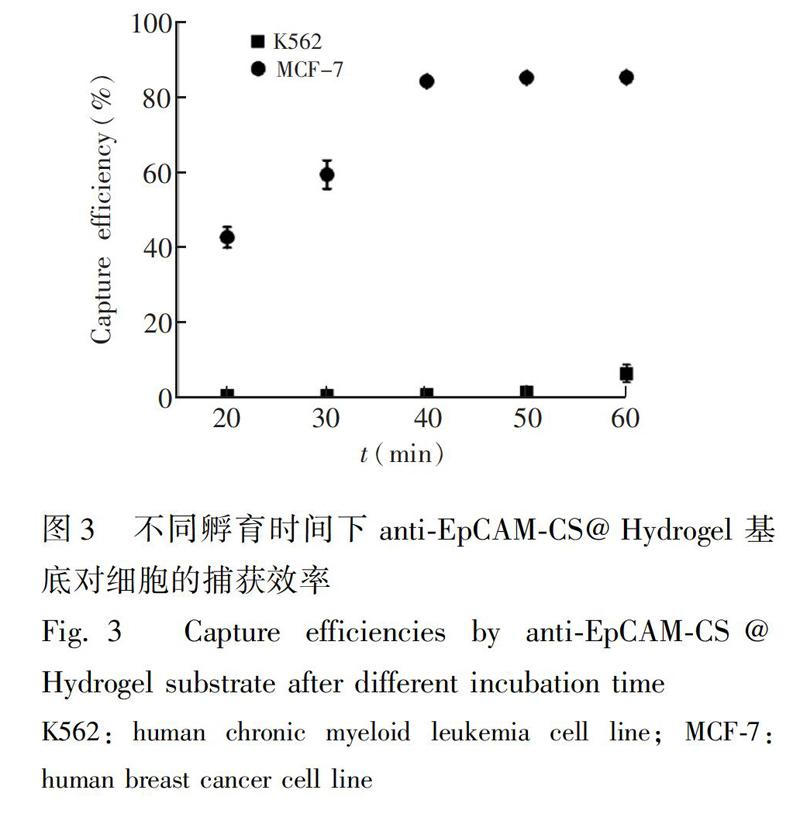
3.2不同孵育時間下的捕獲效率
基底與細胞的孵育時間會影響基底對靶細胞的捕獲效率,同時也會影響對非特異性細胞的粘附,因此在實驗中利用陰性模型細胞K562和陽性模型細胞MCF-7,考察不同孵育時間下,anti-EpCAM-CS@Hydrogel基底對K562和MCF-7細胞的捕獲效率以確定最佳孵育時間。不同孵育時間下兩種細胞的捕獲效率如圖3所示。隨著孵育時間延長,40min后,對MCF-7的捕獲效率達到一個穩定水平,而對K562細胞的非特異性粘附依然在增加,這可能是由于時間的延長增加了非特異細胞與基底的作用,導致其在清洗時不能被清除,在60min時達到了6%。為了確保靶細胞的純度,減弱非特異性細胞的粘附作用,后續的捕獲實驗采用40min的孵育時間。

3.3不同修飾基底的細胞捕獲效率
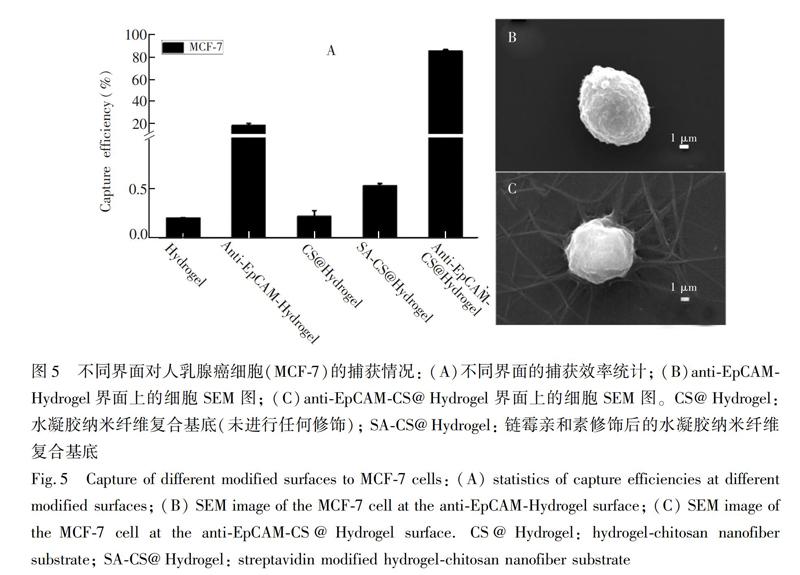
使用MCF-7作為模型細胞,不同修飾的界面互相作為對照,考察基底的抗粘附性能和捕獲效率。主要選取了5種界面:(1)Hydrogel:玻片上修飾CBMA水凝膠層,無任何修飾;(2)anti-EpCAM-Hydrogel:通過EDC/NHS活化Hydrogel界面,修飾SA,最后將生物素化的EpCAM抗體修飾在水凝膠表面,修飾過程見圖4;(3)CS@Hydrogel:Hydrogel表面覆蓋纖維后無任何處理;
(4)SA-CS@Hydrogel:CS@Hydrogel表面修飾PEG后,通過EDC/NHS活化PEG的羧基端,連接SA;(5)anti-EpCAM-CS@Hydrogel:在SA-CS@Hydrogel表面連接生物素化的EpCAM抗體。這5種界面的捕獲效率如圖5A所示,Hydrogel界面的細胞粘附率為0.20%,說明PCBMA水凝膠基層具有很好的抗粘附作用。
anti-EpCAM-Hydrogel界面的捕獲效率僅約為18%,這可能是由于水凝膠的抗粘附性阻礙了細胞與基底抗體的作用,從而導致細胞的捕獲效率低。為提高捕獲效率,在水凝膠基層表面覆蓋一層分布均勻的薄納米纖維,構成了水凝膠納米纖維復合基底(CS@Hydrogel),該基底對細胞的粘附率也僅為0.22%,說明水凝膠基層依然能夠起到抗粘附作用。纖維層的厚度和密度會影響水凝膠基層的抗粘附作用,因此需嚴格控制電紡條件。在同樣的捕獲條件下,anti-EpCAM-CS@Hydrogel界面對細胞的捕獲效率可達85%,相比于平面水凝膠anti-EpCAM-Hydrogel界面,水凝膠納米纖維復合基底的捕獲效率提高了4倍多,其中納米結構起到了關鍵作用。同時,對孵育時間40min時,anti-EpCAM-Hydrogel和anti-EpCAM-CS@Hydrogel界面捕獲的細胞進行了SEM觀察(圖5B和5C),anti-EpCAM-Hydrogel界面上的細胞依然處于收縮狀態,而anti-EpCAM-CS@Hydrogel界面上的細胞已經鋪展并有偽足產生,進一步說明納米纖維結構有效促進了基底對靶細胞的捕獲。

3.4基底的特異性和捕獲細胞的活性
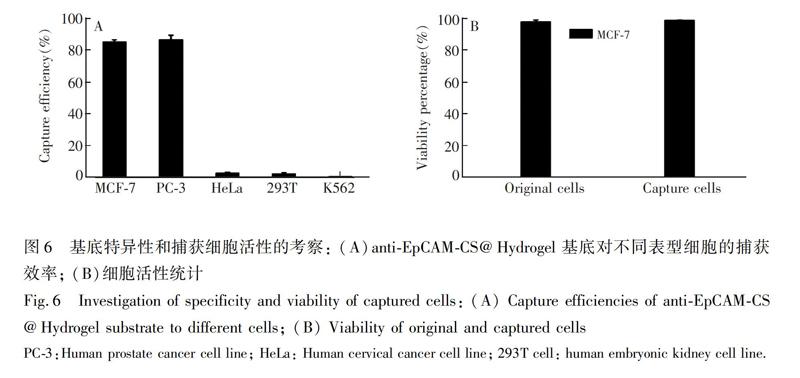
為了證實anti-EpCAM-CS@Hydrogel基底對細胞的捕獲具有特異性,選擇了5種細胞進行細胞實驗,分別是作為陰性模型細胞(EpCAM低表達)的HeLa、K562及293T,陽性模型細胞(EpCAM高表達)的MCF-7和PC-3[27,28]。這5種細胞主要是根據文獻報道的細胞表面EpCAM蛋白的表達情況確定其作為陽性模型細胞還是陰性模型細胞,并用于相應細胞捕獲實驗。在孵育40min后,此基底對MCF-7和PC-3細胞的捕獲效率超過85%,而對EpCAM低表達的HeLa、293T、K562的捕獲效率分別為2.6%、2.2%和0.5%(圖6A),表明此基底對不同類型細胞的捕獲具有良的選擇性。
通過死/活雙熒光染色對anti-EpCAM-CS@Hydrogel基底所捕獲細胞的活性進行評估。作為對照,對相同數量的未與基底進行孵育的細胞也進行雙染色處理。如圖6B所示,捕獲前的細胞和捕獲后的細胞存活率分別為98.4%和97.5%,兩者之間的差異很小,說明此基底具有良好的生物相容性,對細胞后續的研究以及培養有重要意義。
3.5基底的靈敏性
為了驗證anti-EpCAM-CS@Hydrogel能否用于臨床血液中少量CTCs的捕獲,進行了模擬樣本實驗。將DiI預染色的10、20、50、100和200個MCF-7細胞分散到1mL處理過的血液中,制成臨床病人模擬樣本,與anti-EpCAM-CS@Hydrogel基底孵育,清洗,固定,用熒光顯微鏡計數。另外,用PBS溶液代替處理后的血液作為對照組,結果見圖7。
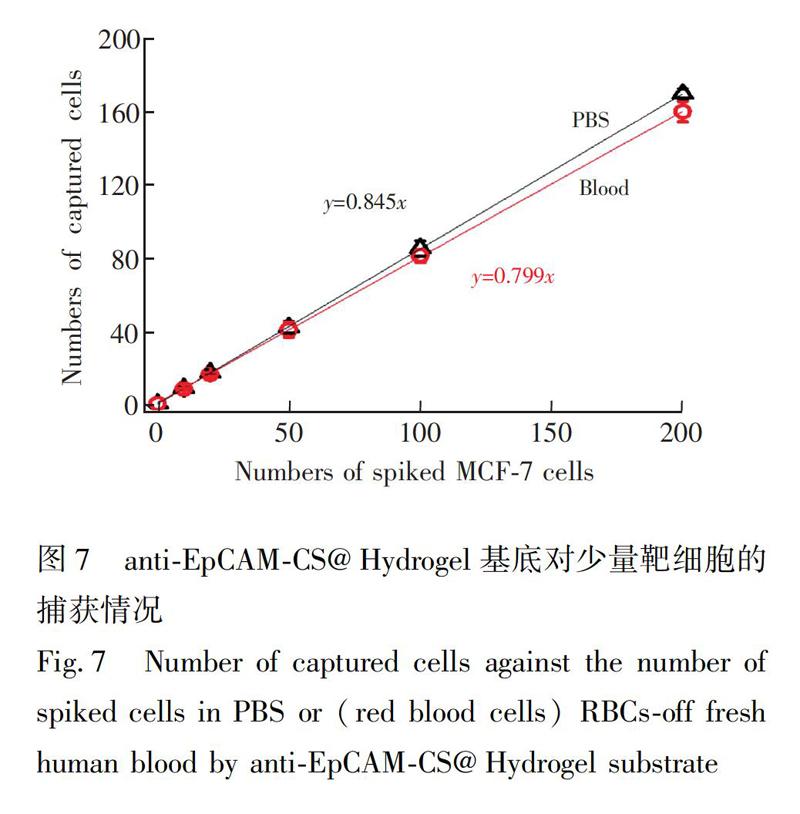
血液中的白細胞對CTCs后續鑒定及分析應用的干擾最大,因此本研究主要考慮白細胞的影響。對PBS和白細胞中少量MCF-7細胞的捕獲效率分別為84.5%和79.9%。即當1mL血液中有10個CTCs時,基底約可捕獲到8個,且在兩種介質中的捕獲效率并無顯著差異,說明此基底具有較好的靈敏度,表明anti-EpCAM-CS@Hydrogel基底可用于臨床血液樣本的檢測。
4結論
通過水凝膠抗粘附性、纖維的納米結構和親和捕獲分子抗體的協同作用實現了對CTCs的高效高純度捕獲。此水凝膠納米纖維復合基底可進一步用于檢測臨床癌癥患者血液樣本,探索其實際應用潛能。此基底具有良好的生物相容性,也可進一步研究捕獲細胞的原位培養和增殖。
References
1CabelL,ProudhonC,GortaisH,LoiratD,CoussyF,PiergaJY,BidardFC.Int.J.Clin.Oncol.,2017,22(3):421-430
2PramaniKA,JonesS,GaoY,SweetC,VangaraA,BegumS,RayPC.Adv.Drug.Deliv.Rev.,2018,125:21-35
3DONGJian-Wei,XIALing,LIGong-Ke.ChineseJ.Anal.Chem.,2018,46(12):1851-1862
董建偉,夏凌,李攻科.分析化學,2018,46(12):1851-1862
4AzevedoR,SoaresJ,PeixotoA,CottonS,LimaL,SantosLL,FerreiraJA.Urol.Oncol.,2018,36(5):221-236
5HongS,WangAZ.Adv.Drug.Deliv.Rev.,2018,125:1-2
6HongB,ZuY.Theranostics,2013,3(6):377-394
7HuangQ,WangFB,YuanCH,HeZ,RaoL,CaiB,ChenB,JiangS,LiZ,ChenJ,LiuW,GuoF,AoZ,ChenS,ZhaoXZ.Theranostics,2018,8(6):1624-1635
8ChenFF,WangSY,FangY,ZhengL,ZhiX,ChengBR,ChenYY,ZhangCX,ShiDD,SongHB,CaiCL,ZhouPF,XiongB.Oncotarget,2017,8(2):3029-3041
9ZhaoW,ChengR,JenkinsBD,ZhuT,OkonkwoNE,JonesCE,DavisMB,KavuriSK,HaoZ,SchroederC,MaoL.Labchip,2017,17(18):3097-3111
10ChouWP,WangHM,ChangJH,ChiuTK,HsiehCH,LiaoCJ,WuMH.Sens.ActuatorsB,2017,241:245-254
11PanchapakesanB,CapraraR,VelascoV,LoomisJ,KingB,XuP,BurkheadT,SethuP,StallonsLJ,McgregorWG,RaiSN,KloeckerG,WickstromE.CancerNanotechnol.,2010,1(1-6):3-11
12MaXY,WuLL,ChenL,QinYH,HuJ,TangM,XuCM,QiCB,ZhangZL,PangDW.ACSAppl.NanoMater.,2018,1(8):4019-4027
13ParkMH,ReateguiE,LiW,TessierSN,WongKH,JensenAE,ThaparV,TingD,TonerM,StottSL,HammondPT.J.Am.Chem.Soc.,2017,139(7):2741-2749
14ZhangF,JiangY,LiuX,MengJ,ZhangP,LiuH,YangG,LiG,JiangL,WanLJ,HuJS,WangS.NanoLett.,2016,16(1):766-772
15LiM,AnandRK.J.Am.Chem.Soc.,2017,139(26):8950-8959
16LiR,ChenFF,LiuHQ,WangZX,ZhangZT,WangY,CuiH,LiuW,ZhaoXZ,SunZJ,GuoSS.ACSAppl.Mater.Interfaces,2018,10(19):16327-16334
17QiX,ChangZ,ZhangD,BinderKJ,ShenS,HuangYYS,BaiY,WheatleyAEH,LiuH.Chem.Mater.,2017,29(19):8052-8056
18CuiH,WangB,WangW,HaoY,LiuC,SongK,ZhangS,WangS.ACSAppl.Mater.Interfaces,2018,10(23):19545-19553
19SunN,LiX,WangZ,ZhangR,WangJ,WangK,PeiR.ACSAppl.Mater.Interfaces,2016,8(20):12638-12643
20XiaoY,WangM,LinL,DuL,ShenM,ShiX.Mater.Chem.Fron.,2018,2(5):891-900
21MiL,JiangS.Angew.Chem.Int.Edit.,2014,53(7):1746-1754
22ZhangZ,VaisocherovaH,ChengG,YangW,XueH,JiangSY.Biomacromolecules,2008,9(10):2686-2692
23SunN,LiuM,WangJ,WangZ,LiX,JiangB,PeiR.Small,2016,12(36):5090-5097
24ChienHW,TsaiWB,JiangS.Biomaterials,2012,33(23):5706-5712
25LiuL,YangK,GaoH,LiX,ChenY,ZhangL,PengX,ZhangY.Anal.Chem.,2019,91(4):2591-2594
26ZhangZ,ChenN,LiS,BattigM,WangY.J.Am.Chem.Soc.,2012,134(38):15716-15719
27SunN,WangJ,JiL,HongS,DongJ,GuoY,ZhangK,PeiR.Small,2015,11(40):5444-5451
28WangS,WangH,JiaoJ,ChenK,OwensG,KameiK,SunJ,ShermanD,BehrenbruchC,WuH,TsengH.Angew.Chem.Int.Edit.,2009,121(47):9132-9135

