IRS1/PI3K/Akt信號通路在Ang(1~7)調節非酒精性脂肪性肝炎中的作用
張藝軍 鄒瑞 鐘武裝 蔡敏捷 許桂英 樂德 劉崗
(1中國人民解放軍南部戰區總醫院干部病房二科,廣東 廣州 510010;2廣州醫科大學附屬口腔醫院 廣州口腔疾病研究所 口腔醫學重點實驗室)
非酒精性脂肪性肝炎(NASH)作為一種代謝性肝損傷性疾病,其發病率正在逐年上升。長期NASH可以進一步進展為肝纖維化、肝硬化甚至肝癌,然而其發病機制目前尚不明確,也缺乏有效的預防措施。胰島素抵抗是公認的產生NASH的重要環節。研究提示,血管緊張素(Ang)(1~7)能在一定程度上改善細胞胰島素抵抗狀態,從而抑制NASH的進展〔1〕。但Ang(1~7)與胰島素受體底物(IRS)1/磷脂酰肌醇3激酶(PI3K)/絲/蘇氨酸激酶(Akt)胰島素信號通路之間的調控關系還尚未見系統研究。本研究擬分析IRS1/PI3K/Akt信號通路在Ang(1~7)調節NASH中的作用。
1 材料與方法
1.1材料 胎牛血清(GIBCO,美國),胰蛋白酶(Sigma,美國),DMEM培養基(GIBCO,美國),油酸(賽哲生物,廣州),二甲基亞砜(DMSO,賽哲生物,廣州),油紅(賽哲生物,廣州),Ang(1~7)(PhoenixBiotech,德國),AngⅡ(Sigma,美國),A779(晶欣,深圳),總膽固醇試劑盒、谷丙轉氨酶(ALT)試劑盒、腫瘤壞死因子(TNF)-α購自CUSABIO(武漢),AKT1(AF0836)、PI3K抑制劑(AF6241)、兔PI3-kinase(AF6241)、兔IRS1(AF6273)及多克隆抗IRS1抗體購自美國AFFINITY公司 ,人肝細胞L02細胞購自中科院上海細胞庫。
1.2NASH體外模型建立 L02細胞株用含10%胎牛血清的DMEM培養基培養,加入20 mg/ml油酸(以0.5%DMSO溶解)誘導肝細胞脂肪變性,隔天換液并加入新配制的油酸。分別接種于96孔細胞培養板,72 h后細胞發生脂肪變。光鏡觀察細胞內脂肪油紅染色情況。
1.3實驗分組 將細胞加入培養瓶中,用含10%胎牛血清的DMEM培養液培養48 h,細胞分為陰性對照組、Ang(1~7)處理組、AngⅡ處理組、Ang(1~7)+A779處理組,每組細胞數約5×106個。對照組為脂肪變肝細胞,未加任何干預因素。處理組分別加入10-6mol/L Ang(1~7),10-6mol/L Ang(1~7)和10-6mol/L MAS拮抗劑(A779)共同干預及10-6mol/L AngⅡ干預。細胞繼續培養24 h后,取細胞上清液進行檢測。每組分別重復3次測量。
1.4檢測各組細胞上清液中TNF-α、ALT、總膽固醇、葡萄糖轉運蛋白(GLUT4)含量 將細胞接種于6孔板中,待細胞完全貼壁生長至60%~80%融合時,分別加入10-6mol/L Ang(1~7),10-6mol/L AngⅡ及10-6mol/L Ang(1~7)和 10-6mol/L MAS拮抗劑(A779)共同干預,對照組不加任何試劑,繼續培養24 h,再收集細胞的上清液。按照說明書操作步驟進行酶聯免疫吸附試驗(ELISA),檢測各組細胞上清液中TNF-α、ALT、總膽固醇、GULT4的含量。
1.5逆轉錄-聚合酶鏈反應(RT-PCR)檢測IRS1 mRNA表達 總RNA提取,逆轉錄合成cDNA,引物設計為β-actin上游引物:5′-TTGTTACAGGAAGTCCCTTGCC-3′,下游引物:5′-ATGCTATCACCTCCCCTGTGTG-3′。IRS1上游引物:5′-AAGCACCTATGCCAGCATCAAC-3′,下游引物:5′-GAGGATTGCTGAGGTCATTTAGGTC-3′。RT 和PCR體系均為25 μl。反應條件:95℃ 變性 30 s,60℃ 退火60 s,72℃ 延伸15 s,40個循環。 擴增產物瓊脂糖凝膠電泳,EPSON Perfection 2480 Photo掃描儀(愛普生公司產品)掃描條帶,SmartView 2000生物電泳圖像分析軟件(上海復日科技有限公司產品)對條帶密度進行密度定量分析,與標準化的β-actin條帶密度掃描值作對比后測定其表達情況。
1.6Western印跡檢測PI3K及Akt蛋白表達 取30 μg蛋白上樣,10%分離膠和5%濃縮膠電泳。350 mA進行恒流電轉移。一抗封閉后過夜,再二抗孵育1 h。洗膜后置暗室中,等體積混合發光緩沖液A與B,均勻滴加到聚偏氟乙烯(PVDF)膜的蛋白面上。壓X光膠片1~10 min,顯影后定影,Gel-ProAnalyzer分析蛋白條帶的灰度值。
1.7統計學處理 采用SPSS22.0軟件進行單因素方差分析。
2 結 果
2.1脂肪變肝細胞的構建 脂肪變肝L02細胞經油紅O染色后,可見大量脂質集聚的紅染顆粒積聚,見圖1。
2.2各組總膽固醇、ALT、GLUT4的變化情況 Ang(1~7)組總膽固醇、ALT含量顯著低于陰性對照組,GLUT4含量顯著高于陰性對照組(P<0.05)。AngⅡ組、Ang(1~7)+A779組總膽固醇、ALT、GLUT4含量與陰性對照組差異有統計學意義(P<0.05),見表1。
2.3各組IRS1基因活性、磷酸化(p)-PI3K、Akt及TNF-α的表達變化 Ang(1~7)組IRS1基因活性增強,p-PI3K、p-Akt表達水平升高,TNF-α表達量下降,與陰性對照組相比差異有統計學意義(P<0.05)。AngⅡ組與Ang(1~7)+A779組IRS1基因活性減弱,p-PI3K、p-Akt表達水平下降,AngⅡ組TNF-α表達量升高,與陰性對照組相比差異有統計學意義(P<0.05)。見表2。
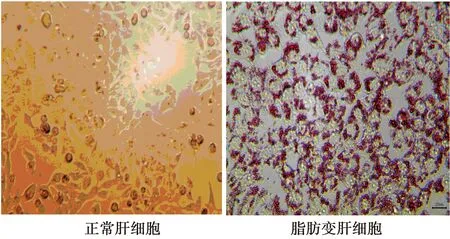
圖1 經油紅染色的NASH細胞模型(×400)
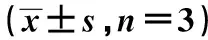
表1 各組細胞培養上清液中ALT、總膽固醇、GLUT4水平比較
與陰性對照組比較:1)P<0.05;下表同
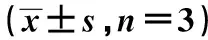
表2 各組IRS1、p-PI3K、p-Akt、TNF-α表達量比較
3 討 論
NASH正成為全球最常見的慢性肝病,其患病率為20%~30%,在一些特殊人群中其患病率更高,據統計,2型糖尿病患者中有70%合并該病,而在肥胖者中其患病率高達90%〔2〕,NASH的發病機制復雜〔3,4〕。2004年,Wang等〔5〕首次提出胰島素抵抗的定義,并認為胰島素信號傳遞受阻或減弱,是導致胰島素抵抗的主要原因。胰島素抵抗可減弱和破壞胰島素對脂肪代謝的調節,增加脂質溶解,提高循環中游離脂肪酸濃度,促進肝臟游離脂肪酸的攝取和肝細胞內三酰甘油的合成,促使三酰甘油在肝細胞內蓄積,導致NASH的形成〔6〕。Promrat 等〔7〕發現胰島素增敏劑可使NASH患者的生化指標和肝臟組織學特征獲得改善。迄今,胰島素抵抗被公認為NASH的核心機制。NASH發病機制的“二次打擊”假說〔8〕認為,脂肪蓄積通過脂毒性作用,誘導過氧化作用、氧化應激、炎癥、細胞凋亡、纖維化等二次打擊的發生。脂肪組織(尤其是內臟性脂肪)的增加伴隨胰島素增敏因子、抗炎因子的減少及致炎因子的增加,炎癥因子反過來通過調節脂肪細胞分泌代謝而增強胰島素抵抗。 Najjar等〔9〕證明,單核細胞趨化蛋白(MCP)-1通過募集巨噬細胞在脂肪組織中產生炎癥,加重脂肪肝和胰島素抵抗。在動物模型和NASH患者中,肝臟核因子(NF)-κB表達顯著增加,活化的NF-κB通過上調白細胞介素(IL)-6、TNF-α等水平介導肝臟炎癥,加重胰島素抵抗。腎素-血管緊張素-醛固酮系統(RAS)廣泛存在于各種組織器官。血管緊張素轉換酶(ACE)-AngⅡ- AngⅡ 1型受體軸(AT1R)是其主要分支。多項研究證實〔10~12〕,ACE抑制劑和AngⅡ受體阻斷劑可以阻斷2型糖尿病的進展,發揮改善胰島素抵抗的作用。ACE2-Ang(1~7)-MAS軸作為RAS分支,抑制ACE-AngⅡ-AT1R軸的內在調節途徑,對多種組織器官具有保護作用〔13~15〕。Ang(1~7)在體內外與AT1R競爭性結合,拮抗AngⅡ活性,被認為是內源性AngⅡ的阻斷劑〔16〕。 Ang(1~7)可以完全阻斷AngⅡ對腎近曲小管上皮細胞、人內皮細胞外調節蛋白激酶(ERK)1/2的磷酸化作用,該阻斷作用可以被MAS受體阻斷劑A779所抑制。
本研究提示,AngⅡ能對肝細胞造成持續性損傷,Ang(1~7)有改善肝細胞功能的作用。 A779作為Ang(1~7)的拮抗劑,阻斷Ang(1~7)對肝細胞的保護作用,具有反向調節功能。GLUT4是一類嵌于細胞膜上用于轉運葡萄糖的蛋白質載體,在機體攝取葡萄糖及代謝葡萄糖過程中發揮重要作用,葡萄糖的代謝取決于細胞對葡萄糖的攝取,其表達水平直接影響機體對葡萄糖的利用,也被稱為胰島素反應性蛋白〔17〕。進一步研究抑制胰島素抵抗的分子調控機制發現,脂肪變肝細胞L02細胞中IRS1基因表達升高,p-PI3K、Akt表達水平升高,TNF-α水平下降。在IRS1/PI3K/Akt信號通路中,IRS1是一種能夠被激活的胰島素受體酪氨酸激酶作用的底物,機體內的胰島素通過特異性地結合胰島素受體,激活IRS1等底物進而發揮調控血糖的作用。而PI3K/Akt信號通路是經典的胰島素信號轉導的主要途徑〔18〕,當胰島素與細胞表面胰島素受體結合后,激活IRS1蛋白酪氨酸的磷酸化,進而使PI3K磷酸化,產生瀑布效應,使得Akt磷酸化被激活,并促使GLUT4轉位,調節葡萄糖的吸收。相反,則可能導致胰島素抵抗〔19〕。Zhang等〔20〕研究表明, 一種肝臟保護劑(SIL)能夠通過IRS1/PI3K/Akt 信號通路改善脂肪變肝細胞和胰島素抵抗。也有研究表明,當IRS1/PI3K/Akt信號通路被激活后,能夠將更多的GLUT4從細胞內轉移到細胞膜,從而增加細胞對葡萄糖的攝取〔21〕,與本實驗結果相一致,說明Ang(1~7)還可以通過PI3K/Akt/TNF-α信號途徑降低肝細胞凋亡,改善NASH。
綜上,Ang(1~7)可以通過IRS1/PI3K/Akt信號通路提高細胞膜GLUT4含量,同時減少TNF-α的表達,減少肝細胞中膽固醇、ALT含量,改善胰島素抵抗,從而達到減輕NASH的作用。

