衰老原代小鼠成骨細胞模型的建立與評價
魯晴 譚海濤 賀錦橋 楊心妮張鑫 黎靜
1.廣西醫科大學基礎醫學院生理學教研室,廣西南寧 530021;2.廣西醫科大學第八附屬醫院廣西數字醫學3D打印臨床研究中心,廣西貴港 537100
骨質疏松是中老年人的一大常見疾病,以低骨量,骨顯微組織損壞為主要特征,易引起老年人骨折,致殘甚至死亡[1]。成骨細胞的主要功能是負責骨的形成,分泌與礦化,其特異性分泌的多種生物活性物質,可以調節骨的形成和重建過程[2]。其功能隨著衰老的過程而發生顯著的變化[3]。乳鼠顱蓋骨由于含有骨膜和骨松質,具有良好的表達成骨細胞蛋白合成以及繁殖的能力,培養條件較為簡單,因而被普遍選作體外培養成骨細胞的組織來源[4]。該試驗旨在運用酶消化法和組織塊相結合的培養法獲取原代成骨細胞,并采用D-半乳糖法構建成骨細胞衰老模型,為后續對成骨細胞衰老機制的探討打下基礎。
1 實驗材料
1.1 實驗動特
實驗動物新生5~7 d的昆明乳鼠,雌雄均可,購自廣西醫科大學實驗動物中心。
1.2 主要試劑
MEM α培養基,膠原酶Ⅱ型,BCIP/NBT堿性磷酸酶顯色試劑盒,PBS,胰蛋白酶-EDTA消化液(0.25%),β-半乳糖苷酶細胞衰老染色試劑盒,D-(+)半乳糖,cDNA逆轉錄試劑盒,riboFECT CP Transfection Kit。
2 方法
2.1 提取細胞
取5只新生5~7 d昆明乳鼠,剝離顱骨的頂骨和額骨,剔除骨片上附著的多余血液和結締組織。隨后將骨片置于含0.25%EDTA胰酶的離心管中浸沒,37℃消化10 min。取適量培養基中和胰酶。將骨碎塊加至0.1%Ⅱ型膠原酶中,37℃水浴箱消化30 min。棄上清液,將骨碎片置于25 cm2的培養瓶中平鋪,置于37℃、5%的CO2培養箱倒置干涸培育。約2~4 h后翻正培養瓶,加入4 mL MEM完全培養基繼續培養3 d后換液。
2.2 成骨細胞傳代和純化
骨組織塊爬出的細胞生長鋪至培養瓶80%滿時,進行細胞傳代。經胰酶消化后,加入MEM完全培養基終止消化,取細胞懸液靜置3min,棄掉沉淀的骨組織塊。上清液離心1 000 rpm×5 min。棄上清液后重新加入MEM完全培養基重懸均勻細胞,加入25 cm2細胞培養瓶中。運用差速黏附法[4]分離混雜其中的成纖維細胞:即把培養瓶內的細胞懸液在細胞孵箱中靜置15 min,吸取上清液至新培養瓶內,再靜置15 min,如此連續轉瓶2~3次,成纖維細胞便可去除。
2.3 成骨細胞形態學觀察
每天用倒置相差顯微鏡察看原代培育,傳代細胞的爬出以及生長狀況,察看細胞狀態并拍照記錄。
2.4 成骨細胞堿性磷酸酶染色
顯微鏡下進行細胞計數第三代生長狀態良好的原代細胞,將細胞接種于六孔板。待細胞生長至80%后,按照試劑盒說明書進行堿性磷酸酶染色實驗,顯微鏡下觀察染色情況,顯微鏡下挑選細胞散布均勻的視野計數100個細胞,計算陽性細胞所占比例。
2.5 D-半乳糖誘導細胞衰老
將生長狀態良好的小鼠成骨細胞接種于六孔板,待細胞生長至50%左右,D-半乳糖處理組更換為含有D-半乳糖MEM培養基 (20 g/L),對照組給予無D-gal培養基,培養48 h。
2.6 β-半乳糖苷酶染色
六孔板內原代成骨細胞長到70%,按照β-半乳糖苷酶染色試劑盒進行操作,并在顯微鏡下各組隨機挑選并計數100個細胞中的陽性細胞數,計算陽性細胞率(%)。
2.7 RT-PCR法檢測BMP2、ALP基因表達
Trizol法提取細胞總RNA并進行逆轉錄,采取RT-PCR法檢測各組基因表達程度(引物信息見表1)。每個樣本重復測量3次,以GAPDH為基因內參參照標準,按照2^-△△Ct計算基因相對表達量。
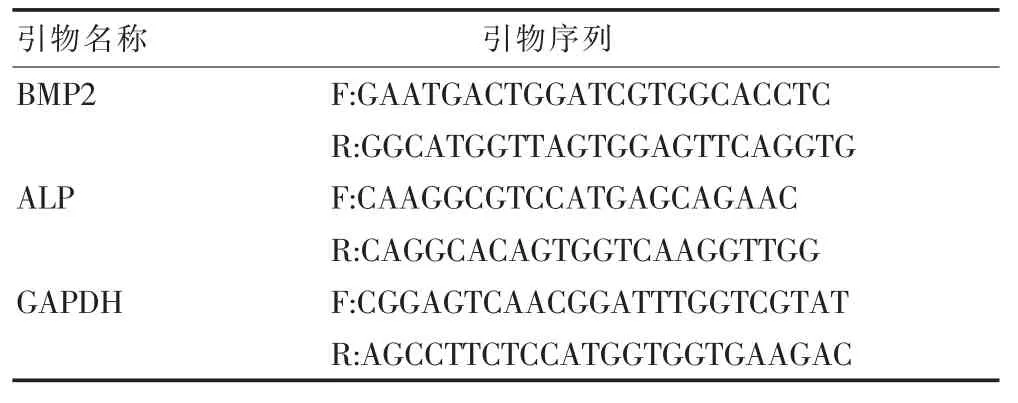
表1 引物序列
2.8 統計方法
應用SPSS 25.0統計學軟件進行數據比較分析。 組間比較(±s)表示,采用t檢驗,P<0.05 為差異有統計學意義。
3 實驗結果
3.1 倒置相差顯微鏡下觀察細胞形態
骨塊貼壁2 d后有細胞自骨碎片爬出,貼壁逐漸展開(如圖1A)。3 d左右細胞數量顯著增多,以骨塊為中心向周圍放射狀生長,呈梭形,三角形,非規則鱗片形(如圖1B)。4 d左右生長的細胞基本鋪滿整個培養瓶(如圖 1C)。

圖1 不同天數細胞爬出骨片狀況 (×100)
3.2 堿性磷酸酶染色結果
體外培養的成骨細胞能夠合成大量堿性磷酸酶,分析結果表明,分離培養的細胞經染色后呈現明顯的深藍色和藍黑色,其中陽性細胞所占比例約為90%,見圖 2。
3.3 β-半乳糖苷酶染色結果
經β-半乳糖苷酶染色后觀察可發現,衰老陽性細胞顯現出藍綠色,陰性細胞無著色。結果表明,與對照組相比,D-半乳糖處理組陽性細胞數顯著增多(P<0.01),如圖 3。

圖2 原代細胞堿性磷酸酶染色觀察(A:×4 B:×100)

圖3 成骨細胞β-半乳糖苷酶染色情況分析
3.4 RT-PCR分析>BMP2、ALPmRNA表達
如圖4結果顯示,D-半乳糖誘導48 h后成骨細胞中基因BMP2、ALPmRNA表達較對照組表達顯著降低(P<0.05)。
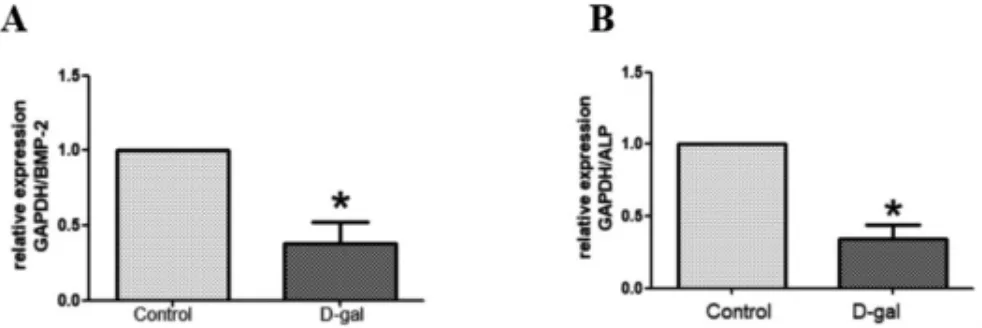
圖4 成骨細胞基因BMP2及ALP表達變化(±s)
4 討論
骨質疏松以骨量減低,骨脆性加重,骨密度減少為主要特征。成骨細胞是參與骨重塑的主要細胞之一[5],原代培養是其體外培養主要細胞來源之一[6]。由于新生乳鼠的頂骨和額骨能夠產生較多成骨細胞且附著的成纖維細胞較少[7],因此選擇其顱骨進行取材保證成骨細胞的增殖數量與純度。該實驗使用酶化法與組織塊法聯合進行原代成骨細胞的培育。此方法不但提取成骨細胞成功率較高,易于實驗操作,且取得的成骨細胞數量多。
對成骨細胞進行生物形態學特征的觀察,是對其鑒別的常用方法之一[8]。該實驗觀察發現分離培養的細胞形態為不規則梭形,三角形,鱗片形,有多個長短不一的細胞突起,細胞核卵圓形位于胞質中央,符合其他文獻報道的成骨細胞特性[9]。此外,堿性磷酸酶(ALP)的高表達被廣泛看作是成骨細胞早期分化的重要指標[10],該實驗發現90%的細胞都被堿性磷酸酶染色,表明所培養的細胞分泌堿性磷酸酶,符合其他文獻報道[4]的成骨細胞的生物學特征。
D-半乳糖是一種正常生理性營養成分,能在機體內通過酶解轉變為葡萄糖為機體生命活動提供能量,但是過量的D-半乳糖會導致機體代謝異常,并引起機體生理功能發生顯著變化[11]。因此,D-半乳糖建立的動物衰老模型已經被國內外認可并廣泛應用于醫學研究的多方領域。X-Gal在細胞衰老特異性的β-半乳糖苷酶催化下會產生深藍色產物。堿性磷酸酶(ALP)是成骨細胞通過基質小泡釋放的參與鈣磷代謝的一種重要酶,能夠加速細胞的成熟、鈣化,ALP活性加強會加速骨基質礦化形成,因此ALP活性表達被看作是反應成骨細胞分化程度和功能狀態的重要指標[12]。RUNx轉錄因子蛋白家族中的RUNx2是成骨細胞分化的特異性轉錄因子,也稱骨形態發生蛋白,具備誘導間充質細胞分化成骨細胞的作用[13]。該實驗原代成骨細胞經D-半乳糖誘導4后,β-半乳糖苷酶染色發現其陽性率明顯增加,而且D-半乳糖處理后成骨細胞ALP、RUNxmRNA均呈低表達,提示D-半乳糖誘導導致細胞活力降低,增殖分化能力削弱,細胞呈衰老表現。
綜上所述,該實驗通過Ⅱ型膠原酶消化聯合組織塊培養建立了原代小鼠成骨細胞培養方法,并通過D-半乳糖誘導法建立了小鼠成骨細胞衰老模型,為后續對成骨細胞衰老機制以及老年骨質疏松相關疾病的研究提供了實驗基礎。

