血清炎癥因子水平與慢性阻塞性肺疾病嚴重程度的相關性
林冠旭,李 翠
(瓊海市人民醫院急診科,海南 瓊海 571400)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)為氣流受限不完全可逆疾病,臨床可導致患者出現肺臟損傷,另外易導致肺外(全身)的不良效應,如抑郁、心血管疾病、骨質疏松癥、代謝綜合征、肌肉骨骼功能異常等并發癥。COPD患者支氣管壁組織內存在以中性粒細胞和淋巴細胞為主的浸潤細胞,在急性發作時,炎癥細胞病理性增多,可進展成化膿性炎癥,造成黏膜充血,水腫、變性與壞死等,進而上皮細胞增生,造成氣道壁的組織損傷- 修復過程反復循環發生,并最終造成細支氣管壁變厚,氣道壁結構重建。患者一般為進行性發展,受損肺臟對有害氣體與氣體顆粒等吸入物反應強烈,如有害氣體、職業粉塵及污染等[1]。目前關于COPD發病因素的研究顯示,炎癥細胞特異性表達與患者病情發生、進展存在相關性[2]。Celli等[3]于2004年提出體重氣流呼吸運動綜合指數(body- mass,airflow obstruction,dyspnea,exercise capacity index,BODE)對COPD患者病情及預后測評有較好的臨床參考價值。相關研究顯示,BODE與COPD患者痰培養陽性率、急性發作次數、住院時長、急性發作時長等呈正相關,說明BODE對COPD患者病情程度有預測作用[4]。慢性阻塞性肺疾病的全球倡議(Global Initiative for Chronic Obstructive Lung Disease,GOLD)評估COPD分為4級,分別為A、B、C、D級,綜合評估患者合并癥、癥狀、急性加重風險及肺功能[5]。本研究主要探究炎癥因子水平與COPD患者病情程度的相關性,現報道如下。
1 資料與方法
1.1一般資料 選取2017年2月至2019年2月瓊海市人民醫院急診科收治的COPD穩定期患者114例為研究對象,其中男64例、女50例,年齡52~78歲,平均(64±8)歲。均符合2013年中華醫學會呼吸病學分會所編寫COPD診治指南[6],COPD患者于穩定情況下(既往6周內無任何情況住院或者急性加重)評估氣流受限為舒張藥吸入支氣管后第1秒用力呼氣量所占用力肺活量(fored expiratory volume in first second/forced vital capacity,FEV1/FVC%)低于70%;排除活動性肺結核、支氣管擴張和其他限制性肺通氣受限者,合并惡性腫瘤、肝臟、腎臟及心臟等慢性疾患者,無法溝通交流者。選取同期健康體檢者100名作為對照組,其中男58例、女42例,年齡53~76歲,平均(64±7)歲。兩組受試者性別、年齡比較差異無統計學意義(P>0.05)。本研究經瓊海市人民醫院倫理委員會批準,患者或家屬均簽署了知情同意書。
1.2方法
1.2.1BODE評估 ①體質指數(body- mass index,B),BMI≤21 kg/m2計1分,BMI>21 kg/m2計0分;②氣流阻塞程度(degree airflow obstruction,O),檢測前24 h內禁止使用支氣管舒張劑,患者吸入400 g沙丁胺醇后20 min,采用肺功能儀檢測FEV1/FVC%,≤35%計3分,36%~49%計2分,50%~64%計1分,≥65%計0分;③呼吸困難(dyspnea,D),使用呼吸困難量表(modified medical research council scale,MMRC)檢測,除劇烈均勻外,無顯著呼吸困難為0級(0分),上緩坡或快走出現氣短為1級(0分),平地上以自己速度行走需停下呼吸,或比同齡人步行速度慢為2級(1分),平地步行數分鐘或100 m需停下呼吸為3級(2分),穿脫衣時氣短,或者呼吸困難無法離開房屋為4級(分);④運動能力(exercise capacity,E),依據“6 min步行試驗”,6 min步行距離≤149 m計3分,150~249 m計2分,250~349 m計1分,≥350 m計0分。BODE分級:0~2分為1級,3~4分為2級,5~6分為3級,7~10分為4級[7]。急性加重標準:患者癥狀包含痰量增加、咳嗽、氣促加重,且持續2 d以上。
1.2.2GOLD分級 依據GOLD分級指南(2015年版)[8]進行分級,患者癥狀較輕,1年內無急性加重入院,MMRC評分為0~1分,或者慢性阻塞性肺疾病評估量表(chronic obstructive pulmonary disease assessment test,CAT)評分低于10分,判定為A級;患者癥狀較重,1年內無急性加重入院,MMRC評分≥2分,或CAT評分≥10,判定為B級;患者癥狀較輕,1年內由于急性加重入院1次及以上,MMRC評分為0~1分,或CAT評分低于10分,判定為C級;患者癥狀較重,1年內由于急性加重入院1次及以上,MMRC評分≥2分,或者CAT評分≥10,判定為D級。
1.2.3血清炎癥因子水平檢測 采集COPD患者和對照組空腹靜脈血6 mL,采用酶聯免疫吸附測定法檢測血清白三烯B4(leukotriene B4,LTB4)、腫瘤壞死因子- α(tumor necrosis factor- α,TNF- α)、白細胞介素- 8(interleukin- 8,IL- 8)及IL- 17水平,試劑盒均購自上海酶聯生物科技有限公司,具體步驟依據試劑盒說明書進行。
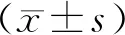
2 結 果
2.1COPD患者GOLD分級與BODE分級的相關性 114例COPD患者行BODE分級,BODE 1級15例,BODE 2級19例,BODE 3級35例,BODE 4級45例;經GOLD分級A級9例,B級24例,C級45例,D級36例。Spearman相關分析結果顯示,GLOD分級與BODE分級呈正相關(r=0.812,P=0.005),見表1。

表1 COPD患者GOLD分級與BODE分級的相關性 (例)
COPD:慢性阻塞性肺疾病;BODE:體重氣流呼吸運動綜合指數;GOLD:慢性阻塞性肺疾病的全球倡議
2.2COPD患者不同BODE分級和對照組BODE得分及血清炎癥因子水平比較 COPD患者不同BODE分級和對照組BODE得分及血清LTB4、TNF- α、IL- 8及IL- 17水平比較差異有統計學意義(P<0.05),不同BODE分級患者血清LTB4、TNF- α、IL- 8及IL- 17水平高于對照組,隨著患者BODE分級升高,其血清炎癥因子水平逐漸升高(P<0.05)。見表2。
2.3血清炎癥因子與COPD患者嚴重程度的相關性 Spearman相關分析結果顯示,不同分級COPD患者BODE、血清LTB4、TNF- α、IL- 8及IL- 17水平與病情嚴重程度呈正相關(r=0.640,P=0.001;r=0.935,P=0.003;r=0.885,P=0.006;r=0.770,P=0.008;r=0.761,P=0.007)。


組別例數BODE得分(分)LTB4(ng/L)TNF-α(ng/L)IL-8(ng/L)IL-17(ng/L)對照組100-134±3529±410±449±14BODE 1級151.29±0.62198±36a42±4a17±4a70±14aBODE 2級193.36±0.61258±35ab67±5ab28±4ab97±15abBODE 3級355.58±0.60447±38abc98±5abc34±4abc122±14abcBODE 4級457.88±0.64663±37abcd134±5abcd45±4abcd160±15abcdF值4.69220.72613.7429.37616.882P值0.037<0.001<0.001<0.001<0.001
COPD:慢性阻塞性肺疾病;BODE:體重氣流呼吸運動綜合指數;LTB4:白三烯B4;TNF- α:腫瘤壞死因子- α;IL:白細胞介素;GOLD:慢性阻塞性肺疾病的全球倡議;a與對照組比較,P<0.05;b與BODE 1級比較,P<0.05;c與BODE 2級比較,P<0.05;d與BODE 3級比較,P<0.05
3 討 論
當前臨床多依據2013年中華醫學會呼吸病學分會慢性阻塞性肺疾病學組所編纂的慢性阻塞性肺疾病診治指南,參考支氣管舒張試驗后FEV1占預計值百分比標準對COPD患者的嚴重程度進行評估,近年來相關研究顯示,FEV1占預計值百分比僅為單純氣流受限指標,并不能準確地預測患者病死率和呼吸困難程度等[9]。因此,單一采用FEV1占預計值百分比評估COPD患者嚴重程度和預后有局限性,無法全面地反映患者疾病發展狀況,同時GOLD綜合診斷和評估辦法較復雜,包含合并癥評估、COPD評估測試問卷、COPD急性加重評估、肺功能評估和COPD控制問卷等,臨床操作困難,且多為患者主觀判斷,無法作為客觀評估指標。GOLD分級為2011年提出評估COPD患者的新概念,以期對患者起到更好的指導作用與疾病治療效果,BODE也是綜合的評估系統,涉及患者多方面的參數[10]。本研究結果顯示,COPD患者GOLD分級與BODE呈正相關,說明BODE評估患者病情也是一個較好的指標,適合在臨床應用。國外有研究顯示,采用BODE對COPD患者病情、預后、肺移植、肺減容術效果和患者生活質量評估效果優于其他評分系統[11]。
目前關于COPD的發病機制尚未完全明確,有研究顯示[12],臨床COPD患者肺部有炎癥細胞活化,進而將更多炎癥細胞因子釋放,上述炎癥因子還可調控、趨化中性粒細胞,進而導致氣道內存在激活的中性粒細胞,影響氣道炎癥的發展,并最終造成機體肺血管、肺實質與氣道等部位出現慢性炎癥,LTB4、IL- 8、IL- 17及TNF- α等炎癥因子參與COPD病情發展。TNF- α為單核- 巨噬細胞所形成的單核因子,為機體內主要免疫反應與炎癥反應的介質,與感染聯系緊密,可局部殺傷、浸潤、吞噬病原體及誘引中性粒細胞趨化的影響,從而啟動炎癥反應。TNF- α有多種功能,可激活中性粒細胞、巨噬細胞,造成中性粒細胞分解IL- 8,使患者血清內IL- 8水平升高,IL- 8為細胞趨化因子的主要成員,為炎性疾病的主要介質之一,可使中性粒細胞趨化、活化[13- 15]。中性粒細胞被IL- 8、TNF- α激活后還能使細胞內外的蛋白分解功能加強,導致肺氣腫。IL- 17為T細胞所誘導的炎癥反應前期的啟動因子,是由T細胞所形成的一種前炎癥細胞因子,同時也是一種炎癥反應的微調因子,不僅可在呼吸道內誘導并活化中性粒細胞募集,還可誘導形成IL- 8、TNF- α等細胞因子,使中性粒細胞的趨化、活化進一步加重。IL- 17可加強肺部彈性蛋白活性,通過增加氣道內分泌物參與COPD發病進程。LTB4為當前已知的最強細胞趨化劑,可使中性粒細胞趨化并活化,至機體炎癥部位導致更多炎癥介質釋放,使局部的炎癥反應擴大。巨噬細胞作為COPD氣道重建與氣道炎癥反應的靶細胞,可加速小氣道內炎癥反應。巨噬細胞能夠形成LTB4,而LTB4可增加毛細血管的通透性,加大氣道阻力,使支氣管平滑肌收縮,進而造成滲出的水分與蛋白質增加,導致氣道黏膜水腫[16- 20]。本研究結果顯示,不同BODE分級患者血清LTB4、TNF- α、IL- 8及IL- 17較對照組升高,伴隨患者BODE分級升高各血清炎癥因子水平逐漸上升,BODE與血清LTB4、TNF- α、IL- 8及IL- 17呈正相關,說明COPD患者病情和血清炎癥因子水平聯系密切,能作為評估患者病情的生物學指標。但炎癥細胞因子容易受到機體其他疾病影響,當前在臨床應用還較為困難。生物學指標為COPD研究的新方向,可經分子生物學、動物實驗等進一步分析其相關機制,為臨床COPD患者的治療提供新思路。
綜上所述,臨床COPD患者血清炎癥因子水平與疾病嚴重程度呈正相關,檢測血清炎癥因子水平有利于評估患者病情并指導治療。

