黃酮類化合物干預糖尿病視網膜病變的研究進展
黃永杰,李 鋒,李大鵬*
(山東農業大學食品科學與工程學院,山東省高校食品加工技術與質量控制重點實驗室,山東 泰安 271018)
糖尿病血管并發癥具有發病率高和致死率高的特點,糖尿病視網膜病變(diabetic retinopathy,DR)是糖尿病眾多并發癥中最常見的微血管并發癥。截至2015年,全球范圍內大約有4億 人患有糖尿病,其中超過45%的人患有DR[1]。DR是一種時間依賴性疾病,其發病率隨糖尿病病程的延長而升高,幾乎所有病程20 年的I型糖尿病患者和80%接受胰島素治療及50%不需要胰島素治療的II型糖尿病患者都會有不同程度的視網膜病變[2]。在歐美發達國家,DR已成為20~74 歲成年人失明的主要原因[3],現在這種趨勢已經蔓延到發展中國家。DR因其高發病率、高致盲率的特點受到了廣泛關注。研究表明,高血糖誘導機體活性氧(reactive oxygen species,ROS)水平的升高進而誘導氧化應激生物過程的發生。在眼部,氧化應激可以導致細胞非正常死亡,最終引起組織損傷,導致DR的發生。因此,抑制ROS的過量產生可能在控制DR中起關鍵作用[4-7]。
黃酮類化合物主要存在于水果、蔬菜和谷物等植物膳食中,是植物產生的次級代謝產物,可以保護機體免受紫外線、氧化劑以及病原體的侵害[8]。黃酮類化合物具有兩個芳香環(A環和B環)的共同結構,通過形成含氧雜環(C環)的三碳鏈連接在一起。根據C環的通用結構以及C環的氧化和官能團不同,可以將其分為黃酮、黃酮醇、黃烷酮、黃烷醇、花青素、異黃酮以及二氫黃酮7 個亞類(圖1)。

圖1 黃酮類化合物的基本結構Fig. 1 Basic structures of flavonoids
研究表明,膳食黃酮的分布極其廣泛,每個亞類代表性黃酮類化合物在膳食中的分布如表1所示。膳食黃酮的潛在生理功效包括抗氧化、抗炎、抗病毒、抗微生物、抗誘變和清除自由基等。流行病學研究表明,富含黃酮的水果、蔬菜和全谷物可以防止許多慢性疾病的發展,包括癌癥、糖尿病及其并發癥、心血管疾病、骨質疏松癥和神經退行性疾病[9-10]。日常飲食中攝入足量的黃酮類化合物能有效地預防糖尿病及其并發癥的發生。本文就氧化應激在DR發生發展中的可能作用以及黃酮類化合物對DR干預的最新實驗研究進行了綜述。

表1 黃酮類化合物在膳食中的分布Table 1 Distribution of flavonoids in plant diets
1 DR的發病機理
高血糖是糖尿病患者共有的一個特征,也是產生氧化應激的主要原因:高血糖引起機體異常代謝,通過直接誘導ROS的過量產生或通過改變氧化還原平衡而促成機體氧化應激環境[28]。視網膜中不飽和脂肪酸含量極高,與其他組織相比其氧攝取量和葡萄糖氧化量最高,這種現象使視網膜更容易發生氧化應激[29]。在視網膜中ROS通過引起血管內皮生長因子(vascular endothelial growth factor,VEGF)過量表達、細胞凋亡以及炎癥反應造成視網膜病變。因此,高血糖、氧化還原穩態變化和氧化應激之間的相關性是DR發病機制中的關鍵因素(圖2)。
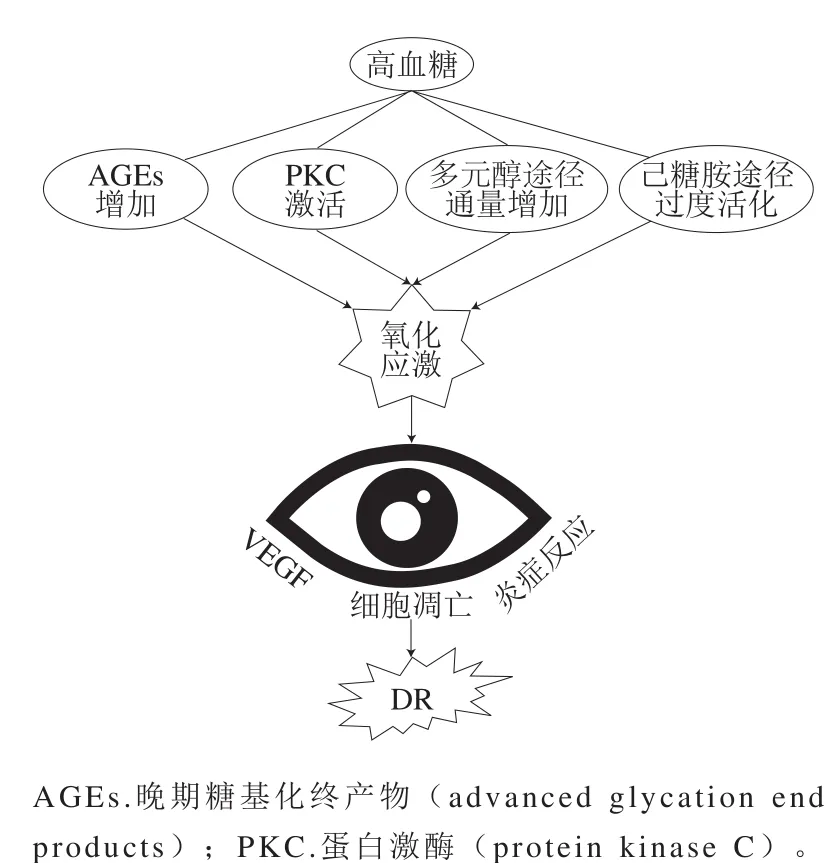
圖2 高血糖誘導的氧化應激與DRFig. 2 Hyperglycemia-induced oxidative stress and DR
1.1 高血糖誘導ROS的產生
高血糖通過引起多元醇途徑的通量增加、PKC的激活、AGEs含量的增加以及己糖胺途徑的過度活化會提高機體ROS水平,引起機體氧化應激狀態,造成細胞損傷,這是高血糖誘導DR的重要機制。
1.1.1 多元醇途徑的通量增加與ROS的產生
多元醇途徑是葡萄糖代謝途徑之一,涉及葡萄糖向山梨糖醇的轉變過程。在多元醇途徑中,醛糖還原酶(aldose reductase,AR)將未被利用的葡萄糖轉化成山梨糖醇,同時將煙酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化成NADP+;然后山梨糖醇脫氫酶將山梨糖醇氧化成果糖,并將NAD+轉化成NADH。高血糖狀態下細胞內葡萄糖通量的增加導致了多元醇途徑的異常激活,AR與細胞內葡萄糖的親和力異常升高,而AR對葡萄糖的過度利用導致了細胞內NADPH水平的降低。NADPH在細胞內用于從氧化型谷胱甘肽再生谷胱甘肽(體內重要的ROS清除物質),其在細胞中水平的降低會導致谷胱甘肽的缺乏。此外,NADPH水平的降低還會減少一氧化氮(nitric oxide,NO)(血管中最重要的血管擴張劑之一)的合成[30]。因此,NADPH水平的降低是ROS積累和造成氧化應激的重要原因。另外,多元醇途徑的通量增加會導致NAD+向NADH的過度轉化,細胞內NADH/NAD+比例的升高以及ROS水平的增加會抑制甘油醛-3-磷酸脫氫酶的活性,其反過來會導致細胞內磷酸丙糖的濃度升高,進而誘導甲基乙二醛(甘油二酯和AGEs的前體物質)的形成,從而導致AGEs水平的增加和PKC途徑的激活[31]。
1.1.2 PKC的激活與ROS的產生
PKC是指基于其激活機制分組的絲氨酸/蘇氨酸蛋白激酶家族。PKC可以被多種信號激活,例如甘油二酯或鈣離子濃度的增加。由于高血糖癥而增加的ROS水平抑制了糖酵解酶甘油醛-3-磷酸脫氫酶的活性,導致細胞內甘油二酯前體物質磷酸丙糖濃度增加。因此,高血糖能夠刺激甘油二酯的形成,進而刺激PKC途徑的激活[32]。在高血糖條件下,PKC-α是NADPH氧化酶(能生成用于清除病原微生物的ROS)的有效激活劑,可被α-生育酚抑制。還有報道顯示PKC-α和PKC-δ可以激活NADPH氧化酶,進而負責在高葡萄糖條件下誘導Toll樣受體(Toll-like receptors,TLR)-2和TLR-4表達[33]。這些改變可直接通過產生ROS或通過激活其他途徑間接促成氧化應激環境。PKC的激活還可誘導一系列事件的發生,包括抑制內皮細胞中內皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的表達[34]、增加血管平滑肌細胞中VEGF的表達[35]、減少平滑肌細胞中NO的產生[36]。通過高血糖激活PKC也會誘導轉化生長因子的表達,其被認為是與硬化相關的疾病中纖維化的主要介質[37]。PKC途徑也與核因子-κB(nuclear factor-κB,NF-κB)活化有關,它將高血糖誘導的氧化應激與炎癥聯系起來。
1.1.3 AGEs的形成與ROS的產生
AGEs的形成過程如下,還原糖的醛基或酮基與蛋白質的游離氨基共價結合形成Schiff堿,然后Schiff堿自發地重新排列成Amadori產物,接著Amadori產物通過兩種方式轉化為AGEs:一是直接轉化;二是經歷自動氧化以形成反應性羰基中間體,這些反應性羰基中間體完成一系列復雜的化學重排,產生不可逆的AGEs結構。另外,單獨的葡萄糖也可以經歷自動氧化以形成反應性羰基中間體,最終形成AGEs[38-39]。由于AGEs積累,導致包括參與基因轉錄調節在內的許多蛋白質在體內失去其功能。AGEs能夠影響細胞外功能和細胞內功能。在細胞外基質中,AGEs的積累有助于形成永久改變細胞結構的交聯[40]。在內皮下積聚的AGEs誘導單核細胞遷移穿過內皮細胞單層,導致NF-κB活化[41]。推測NADPH氧化酶的激活是AGEs誘導氧化應激的主要機制,氧化應激反過來轉導多種信號,最終導致NF-κB活化、細胞因子形成和促炎途徑的激活。
1.1.4 己糖胺途徑的過度活化與ROS的產生
高血糖誘導的脂肪酸過量氧化能夠增加果糖-6-磷酸進入己糖胺途徑的通量,造成己糖胺途徑的過度活化,進而促成糖尿病并發癥。在己糖胺途徑中,谷氨酰胺6-磷酸果糖酰胺轉移酶(己糖胺途徑的限速酶)將果糖-6-磷酸轉化為葡糖胺-6-磷酸,然后將其轉化為尿苷二磷酸-N-乙酰氨基葡萄糖,后者參與包括轉錄因子在內的細胞內因子的翻譯后修飾過程[42]。相關研究表明,高血糖誘導氨基己糖途徑的主要方式是通過增加關鍵基因腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)以及TNF-β1的轉錄而實現,通過氨基己糖途徑的過度活化,經大量產生的ROS激活前炎癥因子[43]。
1.2 DR與氧化應激
視網膜是體內代謝最活躍的組織,因此很容易受到高血糖的影響。高血糖引起的機體異常代謝狀態導致了ROS的過量產生,ROS在眼部的積累會造成視網膜氧化應激損傷,氧化應激標志物水平與DR的嚴重程度相關,這是DR的最主要的發病機理。
1.2.1 VEGF與氧化應激
VEGF是一種血管生成誘導劑,可以引發非增殖性和增殖性DR,在DR發病進程中起著關鍵作用[44-45]。視網膜中ROS水平的升高引起VEGF的過量表達[46]。VEGF也可與其他對視網膜病變有重要影響的代謝途徑相互作用,如PKC途徑和多元醇途徑[47-48]。
1.2.2 細胞凋亡與氧化應激
研究表明,視網膜細胞的凋亡是糖尿病視網膜發生組織病理學改變的先導事件[49-50]。氧化應激促進細胞凋亡的機制可能涉及膜脂質過氧化水平的增加和氧自由基對DNA等維持細胞功能所必需的大分子氧化損傷,以及信號轉導和基因表達的改變[51-52]。在體外實驗和動物模型實驗中,視網膜細胞暴露于高葡萄糖條件下表現出氧化應激狀態,在這一過程中Caspase-3、Bax活性和導致毛細血管細胞死亡的其他轉錄因子基因表達上調[53-55]。
Caspases是一組對氧化應激非常敏感的半胱氨酸蛋白酶,對于介導細胞凋亡至關重要[56]。Caspase-3在糖尿病視網膜中被激活,抑制糖尿病大鼠視網膜病變發展的同時也抑制視網膜中Caspase-3的活化,表明氧化應激可能通過調節Caspase-3活性誘導糖尿病患者視網膜細胞凋亡。視網膜及其毛細血管中被高血糖激活的NF-κB是另一種促進細胞凋亡的細胞因子,而且NF-κB的激活被認為是高血糖誘導內皮細胞凋亡的關鍵信號通路[57]。已有實驗證明,高葡萄糖條件下培養的視網膜細胞,在發生細胞死亡或組織病理學改變之前就已經發生了NF-κB的激活,并且NF-κB的激活在組織病理學發展期間持續進行,這表明NF-kB的激活是DR發展的早期事件[53]。
1.2.3 炎癥反應與氧化應激
炎癥反應可能在DR的發展和進展中起重要作用,而氧化應激可直接或間接誘導炎癥介質的釋放和涉及DR發病機理的炎癥過程,例如ROS可以極大程度地促進細胞炎癥因子的釋放[58]。高血糖誘導的超氧化物可通過各種途徑促進炎癥反應,導致內皮細胞被破壞,增加微血管通透性和釋放細胞因子,并有助于在炎癥部位募集中性粒細胞[59]。
2 黃酮類化合物干預DR的研究進展
大量研究表明,黃酮類化合物具有良好的干預DR的功能。黃酮類化合物通過兩個方面起到干預DR的作用:一是通過控制血糖水平來控制機體ROS水平以達到控制DR的目的;二是通過激活多種分子信號途徑降低機體ROS含量。
2.1 降血糖作用
橙皮素可以顯著降低鏈脲佐菌素(streptozotocin,STZ)誘導的小鼠血漿葡萄糖含量,改善血漿胰島素和糖原水平[17]。向糖尿病大鼠體內注射異槲皮素可以顯著降低其血糖水平,并調節胰島素信號基因和碳水化合物代謝酶的mRNA表達[60]。在Pinent等[61]的研究中,原花青素顯示出顯著的抗高血糖活性。給糖尿病大鼠口服蘆丁可降低其空腹血糖水平,并可顯著改善糖化血紅蛋白和胰島素水平[14]。槲皮素、(-)-表兒茶素和蘆丁是植物中分布最廣的3 種黃酮類化合物,可以改善大鼠胰腺的抗氧化狀態,抑制高血糖和β-細胞的破壞以及阻斷NO的產生和抑制胰島素從胰島中釋放[62-64]。高血糖狀態可以引起機體代謝失衡,造成氧化應激狀態,損傷視網膜細胞與組織,進而引發DR。過往的大量實驗數據表明,黃酮類化合物具有降血糖、抗糖尿病的功效。這可以為防治DR提供新的研究方向,即黃酮類化合物通過降低機體血糖水平治療DR。
2.2 抑制AGEs積累和AR活性
蓮葉提取物(主要成分為槲皮素-3-O-β-D-吡喃葡萄糖苷和槲皮素-3-O-β-D-葡萄糖醛酸吡喃糖苷)對ROS、大鼠晶狀體AR和AGEs顯示出優異的抑制效果[65]。橙皮苷通過抗血管生成、抗炎和抗氧化作用以及對多元醇途徑和AGEs積累的抑制作用,可以減弱STZ誘導的糖尿病大鼠視網膜和血漿異常[66]。表沒食子兒茶素沒食子酸酯、根皮素和6-姜酚預處理可以顯著降低血糖水平、AGEs積累和AR活性[67]。Kumar等[68]發現,從金鳳花中提取的化合物3,6,7,4’,5’-五甲氧基-5,3’-二羥基黃酮以劑量依賴性方式降低STZ誘導的糖尿病大鼠中的AR活性,從而抑制視網膜中山梨糖醇的積累。
2.3 抗氧化及抗炎作用
氧化應激是DR的主要致病因素。體內ROS的水平直接影響DR患者的病情發展,黃酮類化合物等抗氧化劑的使用對視網膜病變的發展具有抑制作用。藍莓花青素可以通過調節Nrf2/HO-1信號傳導保護視網膜細胞免受高血糖誘導的氧化應激和炎癥[69]。柚皮苷能減輕糖尿病視網膜實驗模型中的炎癥反應、氧化應激和NF-κB活化[70]。香葉木素-7-O-蕓香糖苷通過調節c-Jun氨基末端激酶(JNK)和p38信號通路,降低細胞色素c、Bax和Caspase-3的表達水平,同時增加B淋巴細胞瘤(B-cell lymphoma-2,Bcl-2)表達,在體外保護人體視網膜色素上皮(retinal pigment epithelium,RPE)細胞免受高糖誘導的氧化損傷[71]。槲皮素通過抑制絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)和蛋白激酶B(Akt)使NF-κB信號失活,從而抑制VEGF誘導的視網膜光感受器細胞過度炎癥反應[15]。芒柄花素可以通過抑制NF-κB的激活阻止過氧化氫誘導的氧化應激指標水平的升高,進而阻止視網膜神經節細胞(retinal ganglion cells,RGCs)的凋亡[72]。鷹嘴豆芽素A可通過降低血糖水平、下調TNF-α和IL-1β表達來抑制炎癥,并通過降低視網膜組織中的VEGF來減少血管生成,從而改善和延緩視網膜病變[73]。Kumar等[18]用橙皮素處理STZ誘導的糖尿病大鼠24 周,結果顯示,橙皮素處理的視網膜與糖尿病視網膜相比抗氧化酶活性升高,促炎細胞因子TNF-α和IL-1β、Caspase-3、膠質纖維酸性蛋白和水通道蛋白4的表達顯著降低。
2.4 抑制細胞凋亡
在DR疾病進程中會出現RGCs的凋亡,另外ROS水平的升高與細胞凋亡有關。視網膜細胞的凋亡在糖尿病引起的視網膜病變中起著重要的促進作用,而黃酮類化合物可以通過抑制高血糖引起的細胞凋亡控制DR的進程。在DR中,長時間的高血糖水平可能引起包括RPE細胞在內的各種視網膜組織的顯著損傷,7,8-二羥基黃酮可以通過激活激酶B原肌球蛋白受體信號通路有效地預防人RPE細胞中高葡萄糖誘導的視網膜細胞凋亡[74]。橙皮苷通過抑制Caspase-9、Caspase-3的表達和Bax/Bcl-2的下調來抑制高葡萄糖誘導的RGCs的凋亡[75]。在Hao Lina等[23]的研究中,葛根素可通過降低過氧亞硝酸鹽水平和誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表達來減少糖尿病大鼠RPE細胞凋亡,從而減緩DR的進程。槲皮素通過提高抗氧化酶活性、抑制NF-κB和Caspase-3活性發揮抗糖尿病視網膜細胞凋亡的作用,同時通過抑制水通道蛋白4在視網膜內層的表達預防視網膜水腫[76]。柚皮素處理可以改善糖尿病大鼠硫代巴比妥酸活性物質水平的升高和谷胱甘肽水平的降低,提高糖尿病視網膜中神經保護因子(腦源性神經營養因子)、原肌球蛋白相關激酶B和突觸素的水平,調控細胞凋亡調節蛋白的水平抑制細胞凋亡[26]。槲皮素可以通過改善神經營養因子的水平以及通過調控關鍵基因抑制神經元的凋亡來保護糖尿病視網膜中的神經元損傷[77]。在糖尿病視網膜中,蘆丁補充劑可改善降低的腦源性神經營養因子、神經生長因子和谷胱甘肽水平,并降低硫代巴比妥酸活性物質的水平。此外,蘆丁處理通過抑制糖尿病視網膜中Caspase-3的表達和提高Bcl-2的水平顯示出抗細胞凋亡活性[78]。
2.5 抗VEGF
新血管形成增加的視網膜VEGF是眼部新生血管疾病的重要致病因素,其在DR的發生發展中起重要作用。葛花總黃酮可改善糖尿病小鼠視網膜病變的病理形態,并可通過下調糖尿病小鼠視網膜VEGF表達,對DR組織發揮一定的保護作用[79]。黃芩素通過抑制氧化應激,增強缺氧誘導因子-1α(hypoxia inducible factor-1α,HIF-1α)降解和降低VEGF分泌表現出抗血管生成作用,從而減緩DR[13]。葛根素通過調節VEGF和HIF-1α的表達可顯著降低STZ誘導的糖尿病大鼠DR發病率,表明葛根素對大鼠DR具有顯著的保護作用[24]。芒柄花素通過抑制RPE細胞的VEGF分泌,下調VEGFA和脯氨酰羥化酶-2的mRNA表達,降低VEGF、HIF-1α和脯氨酰羥化酶-2的蛋白表達從而改善視網膜新血管形成[80]。視網膜中的VEGF主要來源于Müller細胞,Ke Min等[81]的研究結果表明,黃芪素可以減少Müller細胞中VEGF的過度表達,減輕高糖對其的影響。在早期糖尿病期間,氧化應激可能參與視網膜VEGF的上調,3’,4’,7-三羥乙基蘆丁的防治可以減少VEGF的形成[82]。
表沒食子兒茶素沒食子酸酯通過對MAPK/細胞外調節蛋白激酶(extracellular regulated protein kinase,ERK)-VEGF途徑的負調節顯著降低了高葡萄糖誘導的人視網膜內皮細胞中炎癥細胞因子的表達,抑制了VEGF的表達,提高了細胞存活率[83]。Elgayar等[25]研究結果表明,與糖尿病大鼠相比,金雀異黃素處理組大鼠的宏觀和小神經膠質細胞反應性和視網膜毛細血管的組織學變化得到改善,膠質纖維酸性蛋白和iNOS在視網膜中的表達和血糖水平降低。圣草酚治療以劑量依賴性方式顯著降低糖尿病視網膜中TNF-α、細胞間黏附分子-1、VEGF和eNOS。此外,圣草酚治療能夠顯著抑制糖尿病相關的脂質過氧化以及血-視網膜屏障分解[27]。在Kang等[84]的研究中,白楊素能夠減少葡萄糖刺激的RPE細胞和糖尿病小鼠眼中VEGF、胰島素樣生長因子-1和色素上皮衍生因子的產生;此外,白楊素通過阻止AGE-RAGE活化來阻斷內質網應激,從而抑制類視黃醇視覺周期的損害。山柰酚通過靶向下調VEGF和胎盤生長因子的表達并抑制Src Akt1-Erk1/2信號通路的激活,從而抑制人視網膜內皮細胞的血管生成[16]。
2.6 其他
以小膠質細胞激活和黏膜細胞功能障礙為特征的炎癥過程與STZ誘導的DR有關,黃芩素治療可改善炎癥過程,從而抑制糖尿病視網膜血管異常和神經元丟失[85]。在視網膜病變早期,采取碧蘿芷處理可以增強視網膜血液循環,同時伴有水腫消退,有利于改善患者的視力[86]。Zhang Hongtao等[87]的研究結果表明水飛薊素減少了實驗性糖尿病中閉塞的視網膜毛細血管數量,并且恢復了視網膜血管白細胞停滯和細胞間黏附分子-1水平。淫羊藿苷通過調節視網膜微血管中的內皮標志物和膠原蛋白IV表達以及RGC中的Thy-1和Brn3a表達從而減緩DR的進程[88]。與糖尿病視網膜相比,橙皮苷處理的視網膜中VEGF和PKC-β表達量顯著降低,且視網膜未出現任何血管功能障礙[89]。

表2 黃酮類化合物在干預DR中的作用及機制Table 2 Role and mechanism of flavonoids in intervention of DR
3 結 語
中國大陸糖尿病人群DR患病率為23%,其中非增生型DR為19.1%,增生型DR為2.8%,農村高于城市,北方高于南方和東部[90]。DR已成為我國50 歲以上人群最主要的致盲性眼病之一。目前,DR確切的發病機制尚未完全明了,但已知氧化應激在DR中的作用非常重要,因此可以通過了解氧化應激與DR之間的相互作用,積極地減少氧化應激對DR的損傷,利用各種有作用的抗氧化劑增強抗氧化酶的活性,減少氧化應激標志物的產生,從而延緩DR的發生發展。細胞和體內研究表明,大量黃酮類化合物對糖尿病視網膜神經變性有益。因此,利用黃酮類物質的膳食干預策略將是改善DR的有效方法。然而,這些研究中使用的黃酮化合物的劑量遠高于人類從食物中正常攝入的劑量;另外,使用單一化合物來評估膳食黃酮的生物活性并不合適,因此很難從這些結果中預測膳食黃酮的攝入對預防DR的影響。同樣地,大多數體外研究的濃度遠遠超過膳食黃酮進入人體后在血漿和組織中所達到的生理濃度,這意味著膳食黃酮在體外誘導的某些生物效應可能在飲食攝入后并不會出現。因此,需要進行額外的動物研究和臨床實驗來探究膳食黃酮的劑量以及各成分之間的相互作用對DR干預效果的影響,以更好地了解膳食黃酮可能對健康的影響。
目前對于DR的治療主要依靠藥物進行,包括血管內皮生長抑制劑、AR抑制劑、PKC抑制劑等,同時還應輔以控制血糖、降壓、降脂進行治療,但是藥物治療或多或少地會帶來一定的副作用。功能食品可以調節機體功能且不會對機體產生危害,因此開發以膳食黃酮為主要成分、對干預DR有積極作用的功能食品具有重要的現實意義。

