法舒地爾對ICH大鼠炎性因子水平、神經及認知功能的影響
符 晶,孟開順
(海南省三亞市人民醫院老年病科,海南 三亞 572000)
腦出血(intracerebral hemorrhage,ICH )指的是非外傷性腦實質內血管破裂引起的出血,引起神經細胞的血供不足,導致周圍的神經組織受到壓迫而引發代謝及功能障礙[1]。腦出血病情兇險,死亡率高,是高血壓病最嚴重的并發癥之一,占全部腦卒中的20%~30%[2]。目前ICH的發病機制尚不明確,常見的病因有:微動脈瘤破裂、脂肪玻璃樣變或纖維壞死、腦動脈粥樣硬化以及腦動脈的外膜和中層在結構上薄弱等[3]。法舒地爾是Rho/Roek信號通路的選擇性蛋白激酶抑制劑,Rho/Rho激酶信號通路可以為多種心血管疾病的預防和治療提供治療靶點。法舒地爾在急性腦缺血中的作用已得到證實[4],但其對于腦出血腦損傷的影響及相關機制研究較少。本研究探討鹽酸法舒地爾治療腦出血(ICH)大鼠對炎性因子水平、大鼠神經功能及認知功能恢復的影響。
1 材料與方法
1.1 實驗動物
選取健康成年Wistar雄性大鼠36只,12周齡,體重250.4±9.0 g,均為SPF級別,喂養于室溫23 ℃~25 ℃、相對濕度45%~60%、光照12 h的環境中。采用隨機數字表法分為對照組、模型組和治療組,每組12只。
1.2 實驗方法
1.2.1 動物模型制備 首先固定大鼠,將大鼠固定在小動物手術臺上,使用10%水合氯醛腹腔注射麻醉,使用從大鼠頭部順著人字縫皮膚切開大約3~5 cm,露出頭骨。在人字縫右邊1 mm處標記,使用穿孔器垂直鉆孔。ICH大鼠模型采用非抗凝自體股動脈血注入右側尾狀核建立,使用微量進樣器沿著小孔注射自體股動脈血50 μL,注射時間維持在5 min內,隨后封閉小孔,縫合傷口。對照組只進行與模型組相同手術不注射藥物。
1.2.2 治療方法 術后3組大鼠同條件飼養,治療組采取腹腔注射鹽酸法舒地爾每天12 mg/kg治療,模型組和對照組均給予等量的生理鹽水進行腹腔注射。
1.2.3 Morris水迷宮試驗 采用XR-XM101通用型Morris水迷宮(上海欣軟信息科技有限公司),實驗訓練階段連續進行3天,每天訓練4次。訓練時,將大鼠面向池壁從四個入水點分別放入水池,對比各組大鼠的Morris水迷宮試驗逃避潛伏期、穿越平臺次數,操作步驟按照說明書進行。
1.2.4 神經功能缺損評分 大鼠神經功能評估應用Longa評分標準:正常,無神經功能缺損(0分);左側前爪不能完全伸展,輕度神經功能缺損(1分);行走時,大鼠向左側旋轉,中度神經功能缺損(2分);行走時,大鼠向左側傾倒,中度神經功能缺損(3分);不能自發行走,存在意識喪失(4分)。
1.2.5 實驗室指標檢測 大鼠眼球取血,3500 r/min離心15 min,取上清,使用ELASA法測量血清白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)含量,所用試劑盒購自上海紀寧生物,操作按照說明書進行。大鼠經麻醉處理后,4%多聚甲醛磷酸鹽緩沖液灌注后斷頭取腦,免疫組化測定腦組織NF-κB表達,熒光掃描結果。
1.3 統計學方法
2 結 果
2.1 大鼠的神經功能缺損評分
在造模后第1天至第14天,模型組大鼠的Longa評分均顯著的高于對照組(P<0.05),治療組大鼠的Longa評分顯著的低于模型組(P<0.05)(表1)。圖1為各組大鼠在腦出血后14天的血腫情況,對照組未發現血腫形成;模型組可見見圖1所示血腫,血腫周圍有較多的炎性細胞浸潤;治療組可見血腫基本被吸收,膠質細胞增生改變。
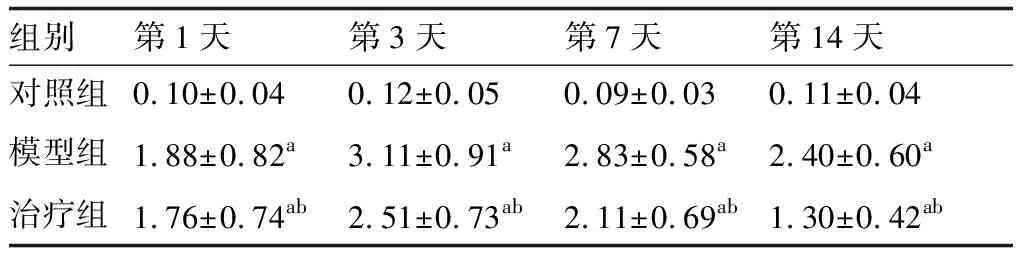
表1 各組大鼠的神經功能缺損Longa評分比較 (分)
與對照組比較,aP<0.05;與模型組比較,bP<0.05(n=12)
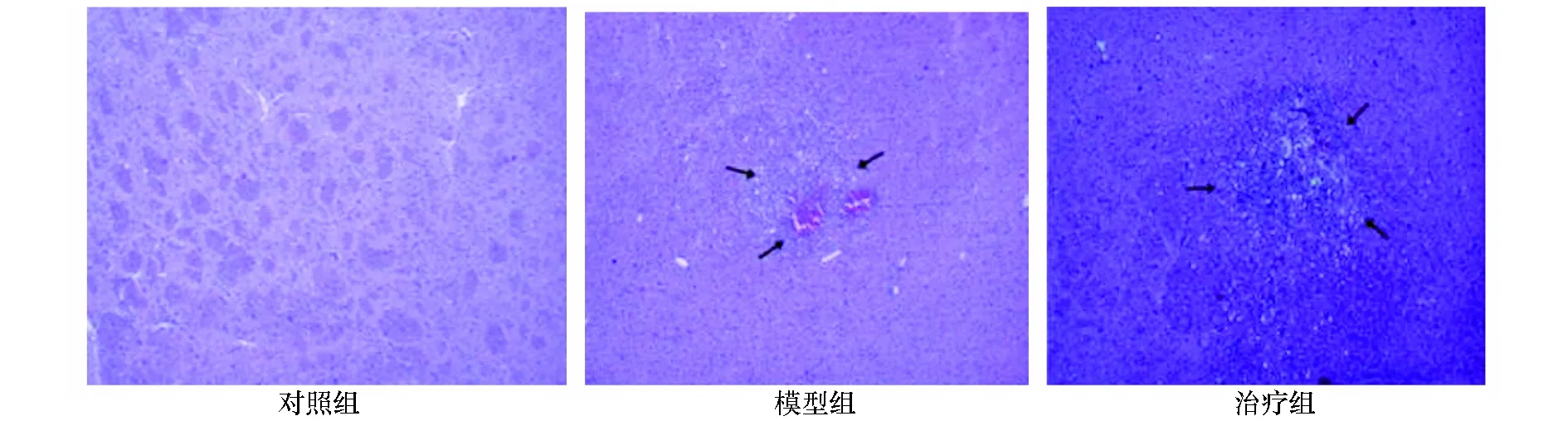
圖1 各組大鼠腦組織血腫情況(HE×40)
2.2 大鼠的Morris水迷宮試驗逃避潛伏期、穿越平臺次數
在造模后第3天至第14天,模型組大鼠的Morris水迷宮試驗逃避潛伏期高于對照組(P<0.05),穿越平臺次數顯著少于對照組(P<0.05);治療后,治療組大鼠的Morris水迷宮試驗逃避潛伏期低于模型組(P<0.05),穿越平臺次數高于模型組(P<0.05);(表2)。
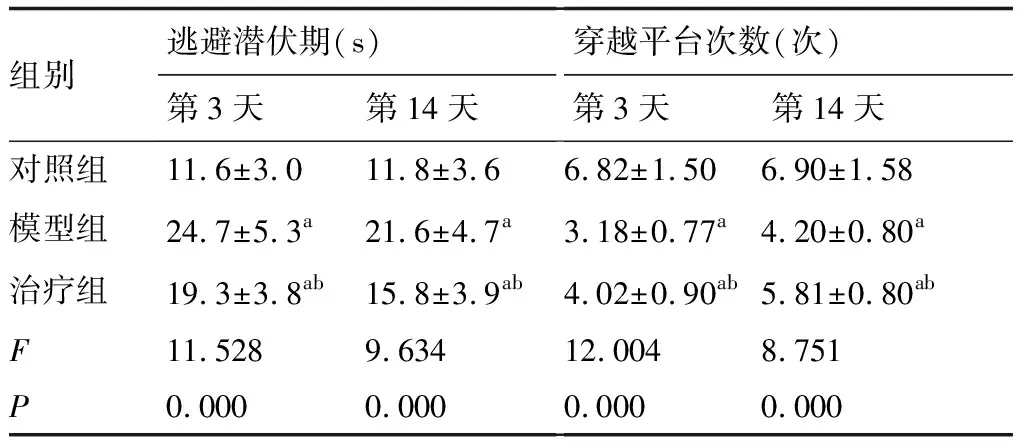
表2 各組大鼠的Morris水迷宮試驗逃避潛伏期、穿越平臺次數比較
與對照組比較,aP<0.05;與模型組比較,bP<0.05(n=12)
2.3 大鼠炎性相關指標
在造模后第3天至第14天,與對照組比較,模型組大鼠的血清IL-6、TNF-α顯著升高(P<0.05);治療后大鼠血清IL-6、TNF-α降低(P<0.05)(表3)。
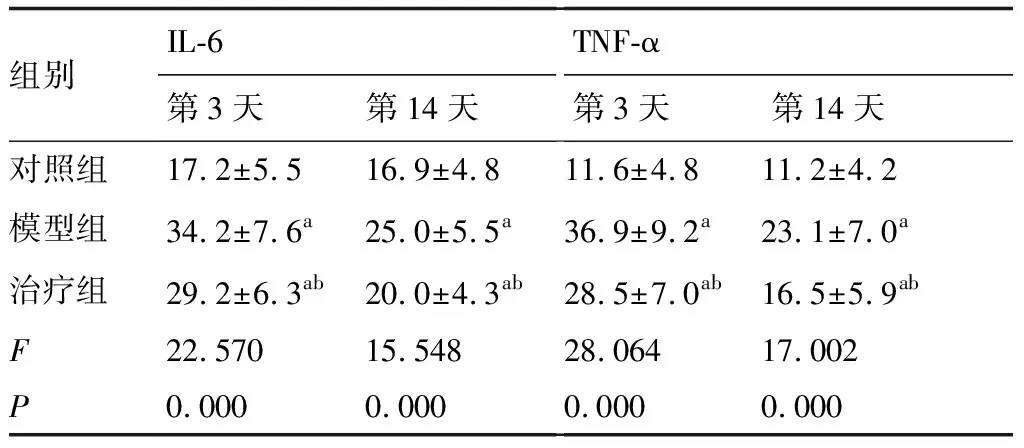
表3 各組大鼠炎性相關指標比較 (pg/mL)
與對照組比較,aP<0.05;與模型組比較,bP<0.05(n=12)
2.4 大鼠腦組織中的NF-κB表達
在造模后第14天,處死大鼠,取出腦組織,可見模型組中的NF-κB陽性表達細胞較多,治療組的NF-κB陽性表達細胞顯著減少(圖2)。陽性定量分析見表4,模型組大鼠腦組織中的NF-κB表達高于對照組(P<0.05);治療組大鼠腦組織中的NF-κB表達低于模型組(P<0.05)。

表4 各組大鼠腦組織中的NF-κB表達相對值比較
與對照組比較,aP<0.05;與模型組比較,bP<0.05(n=12)
3 討 論
腦出血具有較高的致殘率和死亡率,已經成為威脅老年人健康的最重要因素。尋找有效的臨床診治措施十分必要。目前ICH的發病機制尚不明確,臨床中絕大多數腦出血是因高血壓合并小動脈硬化引起的。研究認為,長期的高血壓可導致血管壁纖維素樣壞死或脂質透明變性,形成小動脈瘤或夾層動脈瘤[6]。血壓驟然升高時,血管容易破裂,血液進入腦組織形成血腫。此外,高血壓會導致遠端小血管痙攣,引發出血。腦出血的誘發因素有很多,發病機制尚未完全明確,所以缺乏功效明顯的藥物[7]。因此目前研究探討腦出血的發生發展機制及研發高效的藥物具有重要的臨床意義。
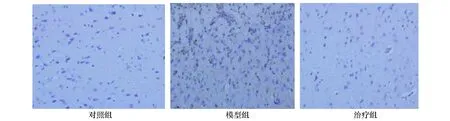
圖2 各組大鼠腦組織免疫組化染色(SP 200×)
分子免疫學和分子生物學的研究表明[8],炎性反應在腦出血導致的神經功能缺損中起著重要作用。因此治療腦出血可以從抑制炎性反應、減輕腦水腫、促進神經功能恢復方面入手。鹽酸法舒地爾是一種具有廣泛藥理作用的新型藥物,為RHO激酶抑制物,具有拮抗炎性因子,保護神經抗凋亡,促進神經再生的作用。目前多項研究顯示[9-10],法舒地爾有助于改善腦缺血癥狀及伴隨的神經元損傷。但其對于腦出血所致腦損傷的影響及相關機制未見報道。本研究觀察法舒地爾在大鼠腦出血性損傷中是否具有保護作用,以及可能的作用機制。研究結果顯示,在造模后第1天至第14天,模型組大鼠的Longa評分均顯著的高于對照組,給予鹽酸法舒地爾治療后的大鼠Longa評分顯著的降低,說明法舒地爾可以降低神經缺陷評分,與其他研究結果相一致[11]。有研究顯示,經過法舒地爾治療,慢性低灌注大鼠的認知功能損害有所減輕[12]。本研究Morris水迷宮試驗結果顯示,治療組大鼠在第3天至第14天逃避潛伏期低于模型組,且穿越平臺次數也增高;結果表明法舒地爾干預大鼠學習認知損害顯著減輕,提示ROCK抑制劑對ICH引起的認知功能損害有保護作用。機制可能與法舒地爾抑制Rho激酶,減少梗死容積,促進神經功能恢復有關[13]。Sanjari等研究發現[14],Rho激酶抑制劑可以顯著抑制IL-6、T NF-α的分泌,其機制可能與抑制NF-κB信號通路、減少下游炎癥因子有關。NF-κB 信號通路參與炎癥反應,NF-κB作為轉錄因子在免疫系統中起到關鍵作用。研究顯示,ICH后腦內NF-B表達上調,這可能與ICH的發病機制有一定關系[15]。本研究也發現,模型組大鼠的血清IL-6、TNF-α、NF-κB增高,給予法舒地爾治療后大鼠血清IL-6、TNF-α、NF-κB降低;表明鹽酸法舒地爾治療ICH大鼠能降低 IL-6、TNF-α、NF-κB的表達水平,說明舒地爾治療ICH大鼠可以抑制炎性因子釋放,從而減少對神經細胞的損傷。
綜上所述,鹽酸法舒地爾治療ICH大鼠能顯著的改善大鼠神經及認知功能、降低腦出血后大鼠的炎癥反應程度,具有一定的臨床推廣價值,但具體的作用機制有待進一步研究。

