下調CD36在心肌中的表達對肥胖小鼠心肌纖維化和凋亡的影響
陶 靜 錢潤芳 陳俊婷 周佳莉 夏 巍 張逸杰
肥胖是一種慢性代謝性疾病,主要表現為體脂含量的增加,其發生率在全球均呈上升趨勢。臨床上通常將體重指數>30kg/m2定義為肥胖。世界衛生組織(WHO)的調查報告顯示,當前全球約有5億肥胖癥患者[1]。該疾病已超越營養不良,成為全球成年人最大的慢性健康問題[2]。雖然我國肥胖的發生率低于美國、英國等發達國家,但由于人口基數大,患病人群的絕對數量僅次于美國,居世界第2位[3]。病理性肥胖是導致勞力喪失和死亡的主要原因之一,不僅影響到成人,而且影響到兒童和青少年[2]。
肥胖與心血管疾病的發生密切相關,是高血壓、冠心病、2型糖尿病等疾病的高風險因素,其患病人群多合并高脂血癥、胰島素抵抗等代謝紊亂,可引起不同器官的病理改變[4~6]。即使排除其他心血管病危險因素,肥胖患者心肌也可出現廣泛病變而導致心臟重構,表現為從舒張性心力衰竭(以下簡稱心衰)到收縮性心衰的演變[7]。
心肌細胞在生理狀態時主要通過脂肪酸(fatty acids, FA)的β氧化及葡萄糖的有氧氧化供能。肥胖或糖尿病時,機體發生胰島素抵抗,心肌細胞對葡萄糖的利用率降低,更加依賴FA的β氧化供能,對FA的轉運及利用效率均提升[8]。這種能量代謝譜的改變使得心肌內有害脂質蓄積、代謝副產物生成增多,通過脂毒性效應及氧化應激損傷,介導心肌纖維化、心肌細胞凋亡及鈣調控異常等一系列病理改變,最終導致肥胖性心肌病[9~11]。因此,改變肥胖狀態下心肌細胞FA的代謝率,可能成為治療肥胖性心肌病的一種策略。
脂肪酸轉位酶又稱為CD36,是FA分解代謝過程中的限速酶,分布于心肌細胞膜上及胞質中。位于細胞膜上的CD36負責將FA轉運入胞參與β氧化。肥胖或糖尿病時,胞質中的CD36可轉移至細胞膜,導致更多的FA攝取入胞參與氧化供能[12]。本研究假設下調肥胖小鼠心肌CD36的表達可降低FA代謝率,改善心肌能量代謝紊亂,進而抑制心肌纖維化,降低心肌細胞凋亡率。為驗證該假設,筆者構建了靶向小鼠CD36的重組慢病毒,通過RNA干擾下調其在心肌組織中的表達。
材料與方法
1.實驗動物及研究方案:本實驗與此前已發表的研究共用同一批實驗動物,詳見參考文獻[10]:4周齡的雄性SPF級C57BL/6小鼠,隨機分為3組,即正常對照(N-mock)組、肥胖對照(O-mock)組和肥胖干預(O-CD36)組。研究方案見圖1。小鼠4周齡時,依據分組給予相應的喂養方案;6周齡時,通過向小鼠心肌內注射不同的慢病毒以下調目標基因的表達;16周齡時,處死取材,獲取左心室組織用于心肌纖維化及凋亡相關指標檢測。所有操作均遵循 “3R原則”。

圖1 研究方案小鼠自斷乳后給予正常飲食,4周齡起根據分組給予不同的飲食方案,6周齡時通過向心肌內注射不同的慢病毒以下調目標基因的表達,16周齡時處死取材完成心肌纖維化和凋亡相關指標檢測
2.儀器與試劑:實驗用到的儀器包括病理切片機(RM 2016,德國Leica公司)、正置明場顯微鏡(Eclipse Ci-E,日本Nikon公司)、實時定量PCR儀(CFX96,美國Bio-Rad公司)等。主要試劑包括SYBR Green試劑盒(FP205,北京天根生化科技有限公司)、CD36一抗(sc-9154,美國Santa Cruz公司)、GAPDH一抗(CW0100A,北京康為世紀生物科技有限公司)、caspase-8一抗(66093-1-AP,武漢三鷹生物技術有限公司)、caspase-12一抗(Ab62484,英國Abcam公司)、CHOP一抗(2895,美國CST公司)、β-actin一抗(BM0627,武漢博士德生物工程有限公司)、TUNEL細胞凋亡檢測試劑盒(11684817910,瑞士Roche Applied Science公司)。
3.慢病毒制備:分別構建靶向小鼠CD36及綠色熒光蛋白(green fluorescent protein,GFP)的重組慢病毒用于心肌內注射。其中,CD36為本研究中RNA干擾的目標基因,GFP則作為對照,慢病毒靶點序列詳見參考文獻[10]。
4.心肌內注射介導靶向心肌的RNA干擾:心肌內注射的方法參照本課題組已建立的方法學,在不斷肋開胸的情況下,使用微量注射針向每只小鼠左心室肌內注射10μl慢病毒[13]。
5.實時熒光定量RT-PCR:取小鼠左心室組織,提取總RNA后合成cDNA,再按照SYBR Green說明書進行real-time RT-PCR。選取GAPDH作為內參,引物序列如下:TGF-β1正向引物:5′-TTGCTTCAGCTCCACAGAGA-3′,反向引物:5′-TGGTTGTAGAGGGCAAGGAC-3′;TGF-β2正向引物:5′-TGAGTCACAACAGACCAACC-3′,反向引物:5′-TCAATGTAAAGTGGACGTAGGC-3′;CTGF正向引物:5′-GGAAGACACATTTGGCCCAG-3′,反向引物:5′-TAGGTGTCCGGATGCACTTT-3′;Col-Ⅰ正向引物:5′-GGCAAAGATGGAGAAGCTGG-3′,反向引物:5′-GGAAACCTCTCTCGCCTCTT-3′;Col-Ⅲ正向引物:5′-ACGTCCTGGTGAAGTTGGTC-3′,反向引物:5′-CAGGGAAGCCTCTTTCTCCT-3′;GAPDH正向引物:5′-CTCATGACCACAGTCCATGC-3′,反向引物:5′-GGATGACCTTGCCCACAGCC-3′。
6.Western blot法:取小鼠左心室組織,提取總蛋白并進行蛋白定量,經SDS-PAGE分離,電轉至PVDF膜,再經一抗、二抗孵育,顯影及定影,最終獲得凝膠圖像。實驗中的一抗濃度分別為caspase-8 1∶2000,caspase-12 1∶1000,CHOP 1∶1000,β-actin 1∶200,采用Image J軟件分析凝膠圖像。
7.Masson染色檢測心肌纖維化:Masson染色心肌組織可使膠原纖維呈藍色,肌纖維呈紅色,常用于檢測心肌纖維化程度。取小鼠左心室前壁心肌組織固定后制作石蠟切片(4μm),經蘇木精、麗春紅、苯胺藍順序染色,明場下200倍隨機拍照,并用Image-Pro Plus 6.0分析膠原纖維的相對著色面積,以反映心肌中膠原含量。
8.TUNEL法分析心肌細胞凋亡率:細胞凋亡時,胞內的DNA碎裂成片段,TUNEL法可有效探測DNA片段的產生,使凋亡細胞呈現棕褐色。取小鼠左心室組織制作石蠟切片(4μm),行TUNEL染色,明場下400倍隨機拍照,人工計數TUNEL陽性細胞的比例,以評估心肌細胞凋亡率。
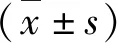
結 果
1.高脂飲食成功誘導小鼠肥胖模型:經過12周的高脂喂養,O-mock小鼠和O-CD36小鼠的體重較正常飲食的N-mock小鼠顯著增加,具體數據詳見本課題組前期論文[10]。
2.RNA干擾下調了CD36在肥胖小鼠心肌中的表達:real-time RT-PCR和Western blot法的結果提示,高脂飲食對小鼠心肌組織中CD36的表達無明顯影響,RNA干擾顯著下調了CD36的mRNA和蛋白表達,詳見本課題組前期論文[10]。
3.下調CD36的表達改善了高脂飲食相關的心肌纖維化:心臟重構是心衰的基本病理生理機制,而纖維化是心臟重構的重要表現。經12周的高脂飲食,肥胖小鼠心肌組織中膠原纖維的面積占比顯著增加(O-mock 6.36%±1.31% vs N-mock 2.88%±0.49%,P<0.01),下調CD36的表達減少了心肌膠原纖維的含量(O-CD36 4.54%±0.41% vs O-mock 6.36%±1.31%,P<0.05),但未降至正常水平(O-CD36 4.54%±0.41% vs N-mock 2.88%±0.49%,P<0.05;圖2中A、B)。RT-PCR的結果提示,高脂飲食引起小鼠心肌組織中纖維化相關基因的mRNA表達水平均顯著增加:TGF-β1(O-mock 1.44±0.18 vs N-mock 1.00±0.15,P<0.05),TGF-β2(O-mock 3.59±0.25 vs N-mock 1.00±0.09,P<0.01),CTGF(O-mock 2.96±0.27 vs N-mock 1.00±0.14,P<0.01),Col-Ⅰ(O-mock 2.32±0.50 vs N-mock 1.00±0.33,P<0.05),Col-Ⅲ(O-mock 1.88±0.25 vs N-mock 1.00±0.18,P<0.05);下調CD36的表達減輕甚至逆轉了高脂飲食所引起的上述改變:TGF-β1(O-CD36 1.15±0.15 vs O-mock 1.44±0.18,P<0.05),TGF-β2(O-CD36 1.54±0.21 vs O-mock 3.59±0.25,P<0.01),CTGF(O-CD36 0.95±0.20 vs O-mock 2.96±0.27,P<0.01),Col-Ⅰ(O-CD36 1.11±0.29 vs O-mock 2.32±0.50,P<0.05),Col-Ⅲ(O-CD36 1.08±0.11 vs O-mock 1.88±0.25,P<0.05;圖2中C~G)。

圖2 心肌組織纖維化指標檢測A.取小鼠左心室組織石蠟包埋后連續切片,分別行HE染色和Masson染色,同一視野下的代表性圖片(×200),Masson染色使膠原纖維呈藍色,肌纖維呈紅色,標尺=200μm;B.Masson染色下,膠原纖維占心室組織切片總面積的比值(每組n=4,每只小鼠分析4~5個視野);C~G:使用RT-PCR檢測小鼠左心室組織中各種纖維化標志物的mRNA表達水平(每組n=3);*P<0.05,**P<0.01
4.下調CD36的表達減輕了肥胖導致的心肌細胞凋亡:心肌細胞是不可再生細胞,其凋亡使得參與做功的心肌細胞絕對數量減少,將促進心臟重構的發生、發展。TUNEL染色的結果提示,肥胖引起小鼠心肌細胞凋亡率增加(O-mock 3.76%±0.44% vs N-mock 0.54%±0.35%,P<0.01),下調CD36的表達減輕了心肌細胞凋亡率(O-CD36 2.14%±0.40% vs O-mock 3.76%±0.44%,P<0.01),但未完全降至正常水平(O-CD36 2.14%±0.40% vs N-mock 0.54%±0.35%,P<0.01;圖3中A、C)。Western blot法檢測結果提示,肥胖小鼠心肌組織內凋亡相關蛋白的表達上調:caspase-8(O-mock 1.94±0.26 vs N-mock 1.00±0.21,P<0.05),caspase-12(O-mock 1.74±0.18 vs N-mock 1.00±0.12,P<0.01),CHOP(O-mock 3.14±0.48 vs N-mock 1.00±0.22,P<0.01);下調肥胖小鼠心肌CD36的表達改善甚至逆轉了上述異常:caspase-8(O-CD36 1.21±0.25 vs O-mock 1.94±0.26,P<0.05),caspase-12(O-CD36 0.99±0.20 vs O-mock 1.74±0.18,P<0.01),CHOP(O-CD36 1.80±0.22 vs O-mock 3.14±0.48,P<0.01,圖3中B、D~F)。

圖3 心肌細胞凋亡相關指標檢測A.小鼠TUNEL染色左心室組織切片(×400),凋亡細胞呈現棕褐色,標尺=100μm;B.Western blot法檢測凋亡相關蛋白,以β-actin作為內參;C.TUNEL陽性細胞占心肌細胞總數的比率(每組n=4,每只小鼠分析4~5個視野);D~F.Western blot法定量分析結果顯示各種凋亡相關基因的蛋白表達水平;*P<0.05,**P<0.01
討 論
包括本課題組前期研究在內的大量資料表明,肥胖或糖尿病時,機體發生胰島素抵抗,心肌細胞對葡萄糖利用率降低,更加依賴FA氧化供能,這種能量代謝譜的轉變引起內質網應激、鈣調控異常、線粒體超微結構改變等一系列病理生理效應,最終影響心肌的舒縮功能而導致心臟重構[8~11,14,15]。肥胖性心肌病患者早期常表現為射血分數保留型心衰(HFpEF),又稱舒張功能不全,主要表現為左心室順應性下降及僵硬度增加[4]。纖維化是HFpEF時常見的病理改變。然而,高脂飲食在誘導機體肥胖的同時是否促進心肌纖維化的發生尚不清楚;此外,心臟重構往往涉及心肌細胞凋亡,因而本實驗將凋亡相關指標也納為研究內容。
本研究旨在通過下調肥胖小鼠CD36表達,減少其所介導的心肌FA高代謝率,并觀察此干預對纖維化及凋亡的影響。筆者的前期研究已經證實,高脂飲食可成功誘導小鼠肥胖模型,而慢病毒介導的RNA干擾可顯著下調肥胖小鼠心肌中CD36的表達[10]。
Masson染色證實,肥胖引起心肌組織膠原纖維的含量顯著增加;TGF-β1、CTGF、Col-Ⅰ等纖維化標志物的mRNA表達上調也支持該結論。下調CD36的表達雖未完全逆轉,但顯著改善心肌纖維化程度;與之相印證,心肌纖維化標志物的mRNA表達也相應下調(圖2)。TUNEL染色的結果提示,高脂飲食導致心肌細胞凋亡率增加,并引起caspase-8、caspase-12、CHOP等凋亡相關蛋白的表達上調;干擾CD36在心肌中的表達減輕甚至逆轉了上述異常(圖3)。
現有研究表明,肥胖導致心肌纖維化可能有多種機制參與:(1)心肌細胞過度依賴FA氧化供能,代謝副產物活性氧簇生成增多,通過氧化應激損傷肌質網,后者攝取和釋放鈣離子的能力是引起心肌細胞舒張和收縮的關鍵因素,肌質網鈣調控異常及胞質內鈣超載將損害左心室舒張和收縮功能,促進心肌纖維化[16]。(2)肥胖導致機體血管床面積增大,交感神經興奮并激活RAAS系統,引起水鈉潴留,左心室容量和壓力負荷均增加,介導心室重塑和心肌纖維化。(3)神經體液因子激活,介導炎性反應引起心肌損傷,促進成纖維細胞的增殖加劇心肌纖維化[17]。(4)脂肪細胞相對缺氧,促進免疫細胞的遷移和激活,促進脂肪組織纖維化,后者與心肌纖維化密切相關[18]。(5)分子機制,包括GSK-3β的表達下調,TGF-β、內皮素1、晚期糖基化終產物、基質細胞蛋白上調也在纖維化的發生中起重要作用[11]。本課題組的前期研究證實,下調CD36的表達可顯著抑制肥胖小鼠心肌細胞內活性氧簇的生成,并改善心肌細胞鈣調控異常[10,14]。因此,干擾CD36的表達以改善肥胖所導致的心肌纖維化,有其理論基礎。
衰老是引起心肌纖維化的另一個重要因素,筆者的研究周期僅12周,雖然肥胖小鼠已表現出纖維化的趨勢,但整體程度并不強烈(纖維化面積占比6.36%),如果延長飼養周期,心肌纖維化的程度可能更加明顯。
內質網是真核細胞內蛋白質翻譯合成以及鈣離子儲存的場所,對細胞應激反應起調節作用。內質網應激實質上是細胞對外界有害刺激的一種應答,其最終結果是對刺激的適應或凋亡[19]。當有害刺激持續,超出細胞的調節能力時,內質網應激將經由CHOP、caspase-12、JNK 3條途徑介導細胞凋亡[20]。肥胖時心肌內活性氧簇的過度生成可損傷內質網,引起內質網應激并介導凋亡。本研究結果亦證實,肥胖導致CHOP和caspase-12的表達上調,心肌細胞凋亡率增加,下調CD36的表達從起始環節抑制活性氧簇的生成,減少了心肌細胞的凋亡。
綜上所述,CD36在肥胖所致的心臟重構中起重要作用,下調CD36的表達可改善心肌纖維化,減少心肌細胞凋亡,是一種潛在的治療代謝性心臟重構的有效手段。

