阻塞性睡眠呼吸暫停低通氣綜合征對成人聽力影響研究
吳 揚 仝 悅 邢宇軒 蔣 雯 劉 穩 喬月華
阻塞性睡眠呼吸暫停低通氣綜合征(OSAHS)是一種睡眠期間的呼吸節律紊亂,頻繁發生完全或不完全的上氣道塌陷阻塞所致的呼吸暫停和通氣不足,反復發作易引起機體的低氧血癥、高碳酸血癥以及機體代謝障礙,對人體內代謝旺盛且需氧量大的器官功能易造成影響[1]。由于耳蝸的解剖和生理特點,當微循環發生缺血時,其無法在短時間內建立有效的側支循環,容易受到缺血、缺氧的直接和間接損傷導致聽功能障礙[2]。筆者的研究采取純音測聽、寬頻聲導抗(WAI)及畸變產物耳聲發射(DPOAE)對OSAHS患者進行測試,將結果與正常對照組比較,以了解患者聽力情況以及聽覺傳導系統各部分功能是否正常。
資料與方法
1.病例選擇:(1)臨床資料:選取主訴長期睡眠打鼾來門診就診的患者,收集其完整臨床資料且篩選符合研究標準的OSAHS患者共30例,男性23例,女性7例,患者年齡20~57歲,平均年齡43.40±11.99歲,病史4~20年。對照組12例,其中,男性8例,女性4例,患者年齡25~54歲,平均年齡39.75±10.31歲。(2)入選標準:OSAHS組:①符合OSAHS診斷標準,且呼吸暫停低通氣指數(apnea hypopnea index,AHI)≥15次/小時,男性女性不限;②無高血糖、高血脂,血壓控制在140/90mmHg以內(包括藥物治療);③既往無耳科相關疾病史,無長期噪聲接觸史,無耳毒性藥品應用史,無顱腦疾病或外傷史;④患者未訴雙耳悶脹感等特殊不適,行耳內鏡檢查見雙側外耳道通暢,鼓膜完整,標志清。雙耳226Hz鼓室導抗圖為A型。對照組:均由家人以及本人證實無打鼾癥狀,男女不限;其余入選條件同OSAHS組第②③④項。
2.儀器及方法:(1)多導睡眠監測(polysomnography,PSG):采用美國安波瀾公司生產的Embletta X100睡眠呼吸監測系統,記錄整夜睡眠≥7h,記錄呼吸暫停低通氣指數(AHI)、最長呼吸暫停時間和經皮血氧飽和度等指標,用Remlogic軟件進行分析。(2)寬頻聲導抗:采用美國米莫薩聲學公司生產的HearID聽覺診斷系統,于標準隔聲室,本底噪聲<20dB,頻率范圍200~6000Hz,將數據處理后得出正常環境壓力下聲能吸收率值和吸收率曲線。(3)純音聽力測試:采用丹麥爾聽美公司Aurical Aud純音聽力儀,隔聲室中噪聲<20dB SPL,測試頻率范圍為0.125kHz~8kHz。(4)耳聲發射檢測:采用美國米莫薩聲學公司生產的 HearID聽覺診斷系統,于隔聲室內測試。DPOAE測試時兩個初始刺激信號L1-L2=10dB SPL,兩者頻率之比f2/fl=1.2,f1、f2的幾何均數范圍位于1kHz~16kHz,讀取2f1-f2的強度。所有耳聲發射的測定都重復兩次,兩次的信號較穩定時為有效值,DPOAE反應幅值以高于本底噪聲6dB為引出。
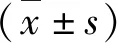
結 果
1.PSG監測結果:OSAHS組中30例成人患者,其AHI介于15.8~80.7,平均血氧飽和度78.6%~95.6%,最低血氧飽和度50%~80%。
2.純音測聽結果:OSAHS組60耳和對照組24耳,在4kHz、6kHz、8kHz的平均聽閾值OSAHS組明顯高于對照組,其余頻率比較差異無統計學意義(表1)。
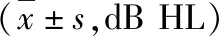
表1 OSAHS組與對照組純音聽閾各頻率比較
3.WAI測試結果:在所分析的200~6000Hz范圍內的7個頻率中,OSAHS患者與對照組其聲能吸收率值比較,差異無統計學意義(P>0.05,表2)。
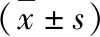
表2 OSAHS組與對照組各頻率WAI曲線吸收率均值比較
4.DPOAE檢查結果:在1kHz~16kHz頻率范圍內所選取的各頻率,DPOAE幅值OSAHS組均低于對照組,除16kHz外其余頻率比較差異有統計學意義(P<0.05,表3、表4)。
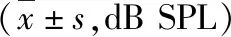
表3 OSAHS組與對照組1kHz~6kHz頻率DPOAE幅值變化
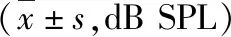
表4 OSAHS組與對照組8~16kHz頻率DPOAE幅值變化
討 論
依照最新指南OSAHS定義為每夜7h睡眠過程中呼吸暫停及低通氣反復發作達30次以上,或AHI≥5次/h,呼吸暫停事件以阻塞性為主,伴打鼾、睡眠結構紊亂、頻繁出現血氧飽和度下降、白天嗜睡等病征[3]。OSAHS患者大腦或腦干的神經功能及末梢器官等可因長期處于慢性缺氧狀態而受到損害,同時耳蝸微血管屬于終末血管,缺少側支循環,且為高能量依賴器官,因而對缺血、缺氧十分敏感,機體長期處于缺氧狀態可代償性地引起促紅細胞生成素的增加致血液流變學改變,全血比黏度增加,加上血氧飽和度下降,從而影響腦干部位和耳蝸的氧及能量供應,導致聽覺系統興奮傳遞的延遲及內耳功能的下降[4]。
因單一頻率的聲導抗檢測在反映中耳微小病變中存在不足,且中耳疾患中不同病變相互影響可能因增高降低的聲順值彼此抵消而使鼓室圖表現為正常波形[5]。所以在本研究中,采用寬頻聲導抗測試0.2kHz~6kHz頻率范圍,獲取中耳鼓室圖的同時測得各頻率的聲能吸收率及反射率,將所選取頻率OSAHS組與對照組WAI吸收率值進行比較,發現兩組結果差異無統計學意義,表明OSAHS組受試者不存在中耳內細微或復雜病變,這與Matsumura等[6]對38例OSAHS患者的研究結果相吻合。
閱讀近年來相關文獻資料發現,在多數研究者的研究中,均采取純音測聽、耳聲發射及聽覺腦干誘發電位等方式檢測患者的聽覺功能,然而研究中雖然采取同樣的測試手段評估患者聽力情況,其所得結果及結論并非完全一致。純音聽力測試中,研究結果顯示OSAHS組較對照組在4kHz、6kHz及8kHz頻率段存在明顯的聽閾值升高,而在4kHz以下差異無統計學意義。在Martine等[7]研究中,對100例OSAHS患者進行測試,按照病情輕重程度分組后,純音測聽示在0.25kHz~3kHz所有分組聽閾均正常,而在6kHz以上聽閾值則隨病情程度加重而呈上升趨勢。同樣Ekin等[8]選取了27例OSAHS患者,純音測聽結果顯示OSAHS組較對照組聽閾值常頻比較,差異無統計學意義,而在擴展高頻(10kHz~16kHz)則顯著增高。有研究觀察發現不同頻率的聲波在基膜產生最大振幅其部位不同,高頻聲波所引起基膜最大振幅的部位靠近前庭窗。由于蝸底的血液供應豐富,代謝旺盛,且耗氧量大,當機體長期受OSAHS影響時,其相對耳蝸頂部對缺血、缺氧更加敏感[9]。因此,OSAHS患者的聽功能受損早期可表現為高頻聽力的下降。
DPOAE由不同頻率的誘發源引發,反映的是各頻率耳蝸節段外毛細胞的功能,各頻率的特異性和穩定性可提示所受累的基膜節段[10]。DPOAE幅值明顯下降,表明耳蝸外毛細胞可能已有結構或功能的改變。本研究中1kHz~16kHz頻率范圍內測定DPOAE的幅值,OSAHS組均明顯低于對照組,提示OSAHS患者耳蝸功能已受到不同程度損害。在佘萬東及韓浩倫等研究中,分別選取20例及24例重度OSAHS患者,DPOAE檢測幅值在0.5kHz~8kHz同樣較對照組存在明顯降低[4,11],而華娜等[12]及Erika等[6]研究也得出相似的數據結果。有動物試驗發現耳聲發射比ABR能更早地顯示出缺血、缺氧對耳蝸功能損害,同時,DPOAE也比純音測聽檢測更加敏感,因此即使純音聽力測試正常的OSAHS患者,其DPOAE振幅的減低也提示缺氧等因素可能已經對患者的聽覺功能造成一定程度損害。
長期慢性缺氧引起的機體代謝障礙及血液流變學改變,繼而導致耳蝸功能損害,為OSAHS患者聽功能下降的主要原因。長期受OSAHS困擾的患者,其清醒狀態下的基礎腦血流速度較正常人低,尤其大腦中動脈及椎-基底動脈[13]。在Fischer等[14]研究中發現,睡眠狀態下呼吸暫停階段,右側大腦中動脈的血流較正常明顯減慢,血液流變學變化為全血比黏度增高,紅細胞聚集指數增高,加上機體缺氧,將影響腦干部位及耳蝸的氧和能量供應,從而造成聽覺系統的興奮傳遞延遲以及內耳功能的下降。同樣Mom等[15]實驗發現,當阻斷內聽動脈血供時間不超過7s時所引起的DPOAE改變和耳蝸血流的下降可以完全恢復正常,但若是持續部分阻斷或多次間歇性中斷內聽動脈的血流,DPOAE改變和耳蝸血流下降則難以完全恢復。因而OSAHS患者DPOAE檢測的異常可能為睡眠狀態下頻繁發生呼吸暫停,造成耳蝸的慢性間斷性缺氧而導致的不可逆結果。但同時筆者還考慮是否有打鼾產生的噪聲因素同樣參與其中。噪聲對聽力的損害是一個復雜的多因素機制,噪聲可損害耳蝸內的微循環,導致耳蝸缺血、缺氧,造成毛細胞和螺旋器的退行性變[16]。另外噪聲可引起毛細胞、支持細胞酶系統嚴重紊亂,導致氧和能量代謝障礙,致細胞變性、死亡。噪聲所引起聽力曲線變化最明顯的特征是早期出現4kHz處的“V”字型切跡,隨著病變發展,3kHz、6kHz的聽力也出現下降,聽力曲線呈“U”型[16]。而筆者的純音測聽結果也顯示OSAHS患者組在4kHz處其聽閾值較對照組升高最明顯,具有一定相似性,提示鼾聲可能同樣為致OSAHS患者聽功能受損的潛在因素。因而在以后的研究中還應擴大所納入研究對象數量,設計更完善的對照實驗,來獲取詳盡數據以明確解釋其機制。

